Эффективность нейроцитопротекторов метаболической и медиаторной групп и их комбинаций при астеническом синдроме
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В проспективном открытом исследовании принимали участие 90 пациентов обоего пола в возрасте 35–55 лет с АС (по Международной классификации 10-го пересмотра – F48, R13, R53), без противопоказаний к проводимой терапии. Изучено действие цитофлавина (Ц), холина альфосцерата (ХАС), мельдония (М) и их комбинаций Ц + ХАС, Ц + М, Ц + М + ХАС в дозах 17 мг/кг (в пересчете на сукцинат, две таблетки два раза в день), 8,5 мг/кг (один флакон два раза в день), 14,2 мг/кг (1 г один раз в день) соответственно (в комбинациях дозы не меняли). Препараты назначали дважды в день в течение 60 дней. Пациенты были разделены на семь групп, включая контрольную. Исследование проводилось с марта 2018 г. по декабрь 2019 г. Диагноз формулировали на основании клинических и нейропсихологических показателей: тревоги (тест Спилбергера – Ханина), продуктивности внимания (тест Ландольта), качества сна (показатель PSQI) и степени астении (шкала астенического состояния Л.Д. Малковой и Т.Г. Чертовой). На этапе скрининга использовали шкалу MMSE.
Результаты. В исходном периоде выявлены высокая степень АС, тревоги и нарушение качества сна, превышавшие вариант нормы в 2,4, 2,5 и 5,3 раза (р < 0,01) соответственно, а также снижение продуктивности внимания в 1,6 раза ниже нормы. К 30-му дню закономерности в ряду составили:
Ц + ХАС + М > Ц + ХАС > М > Ц и Ц + М > ХАС; по купированию тревожности:
Ц + ХАС > ХAC > Ц > Ц + ХАС + М > Ц + М > M; усилению продуктивности внимания:
Ц + ХАС + М > Ц + М > Ц + ХАС > М > Ц > ХАС; улучшению качества сна:
Ц + ХАС > ХАС и Ц + ХАС +М > Ц + ХАС + М > ХАС > Ц и Ц + М.
Выводы. На фоне нейроцитопротекторов метаболической и медиаторной групп снизились клинические и нейрофизиологические проявления АС. Препараты и их комбинации по-разному влияли на динамику нейрофизиологических показателей на 30-й и 60-й дни исследования. Определены закономерности на 60-й день исследования:
- по силе противоастенического действия: Ц + ХАС > Ц + ХАС + М = Ц + М;
- купированию тревоги: Ц + ХАС > Ц + ХАС + М = Ц + М;
- продуктивности внимания: Ц + ХАС + М > Ц + М > Ц;
- улучшению качества сна: Ц + ХАС > Ц + ХАС + М > Ц + М.
Материал и методы. В проспективном открытом исследовании принимали участие 90 пациентов обоего пола в возрасте 35–55 лет с АС (по Международной классификации 10-го пересмотра – F48, R13, R53), без противопоказаний к проводимой терапии. Изучено действие цитофлавина (Ц), холина альфосцерата (ХАС), мельдония (М) и их комбинаций Ц + ХАС, Ц + М, Ц + М + ХАС в дозах 17 мг/кг (в пересчете на сукцинат, две таблетки два раза в день), 8,5 мг/кг (один флакон два раза в день), 14,2 мг/кг (1 г один раз в день) соответственно (в комбинациях дозы не меняли). Препараты назначали дважды в день в течение 60 дней. Пациенты были разделены на семь групп, включая контрольную. Исследование проводилось с марта 2018 г. по декабрь 2019 г. Диагноз формулировали на основании клинических и нейропсихологических показателей: тревоги (тест Спилбергера – Ханина), продуктивности внимания (тест Ландольта), качества сна (показатель PSQI) и степени астении (шкала астенического состояния Л.Д. Малковой и Т.Г. Чертовой). На этапе скрининга использовали шкалу MMSE.
Результаты. В исходном периоде выявлены высокая степень АС, тревоги и нарушение качества сна, превышавшие вариант нормы в 2,4, 2,5 и 5,3 раза (р < 0,01) соответственно, а также снижение продуктивности внимания в 1,6 раза ниже нормы. К 30-му дню закономерности в ряду составили:
Ц + ХАС + М > Ц + ХАС > М > Ц и Ц + М > ХАС; по купированию тревожности:
Ц + ХАС > ХAC > Ц > Ц + ХАС + М > Ц + М > M; усилению продуктивности внимания:
Ц + ХАС + М > Ц + М > Ц + ХАС > М > Ц > ХАС; улучшению качества сна:
Ц + ХАС > ХАС и Ц + ХАС +М > Ц + ХАС + М > ХАС > Ц и Ц + М.
Выводы. На фоне нейроцитопротекторов метаболической и медиаторной групп снизились клинические и нейрофизиологические проявления АС. Препараты и их комбинации по-разному влияли на динамику нейрофизиологических показателей на 30-й и 60-й дни исследования. Определены закономерности на 60-й день исследования:
- по силе противоастенического действия: Ц + ХАС > Ц + ХАС + М = Ц + М;
- купированию тревоги: Ц + ХАС > Ц + ХАС + М = Ц + М;
- продуктивности внимания: Ц + ХАС + М > Ц + М > Ц;
- улучшению качества сна: Ц + ХАС > Ц + ХАС + М > Ц + М.

Введение
Астенический синдром (АС) проявляется повышенной утомляемостью, эмоциональной неустойчивостью, нарушением сна, снижением умственной и физической работоспособности, раздражительностью и быстро наступающей истощаемостью. Астенические проявления увеличивают риск развития сердечно-сосудистых заболеваний и метаболического синдрома у молодых лиц и усугубляются психогенными нагрузками. Нормализация режима труда, отдыха и соблюдение диеты не дают должного результата. Назначение антидепрессантов и нейролептиков для устранения клинических симптомов астении у лиц трудоспособного возраста сопровождается нарушением качества жизни. На фоне АС отмечаются гипоксия головного мозга, угнетение холинергической реакции и снижение интенсивности промежуточного обмена веществ. Отдельную проблему представляет астенический постоперационный синдром. Сказанное обусловливает актуальность поиска и изучения препаратов, одновременно повышающих когнитивный резерв и устраняющих симптомы астении.
Цель исследования – снизить клинические проявления АС у пациентов средней возрастной группы.
Задачи исследования включали:
- сравнение эффективности нейроцитопротекторов (НЦП) метаболотропной и синаптотропной групп и их комбинаций у больных АС;
- оценку влияния метаболотропных и синаптотропных НЦП на степень астении, тревожности, качество сна и продуктивность выполненной работы;
- анализ эффективности препаратов в комбинации и монорежиме;
- обоснование необходимости применения НЦП при АС.
Материал и методы
Работа выполнена на базе Северо-Западного государственного медицинского университета им. И.И. Мечникова и Первого Санкт-Петербургского государственного медицинского университета им. aкад. И.П. Павлова.
В исследовании принимали участие 90 пациентов обоего пола в возрасте 40–55 лет с выявленным АС (согласно Международной классификации болезней 10-го пересмотра, F48, R13, R53) в отсутствие противопоказаний к проводимому лечению и непереносимости изучаемых препаратов. Исследование проводилось с марта 2018 г. по декабрь 2019 г. АС оценивали клинически и верифицировали нейрофизиологически на основании стандартизованных шкал. Применяли Краткую шкалу оценки психического статуса (MMSE – Mini-Mental State Examination) (на этапе скрининга в исследование включали пациентов, набравших свыше 24 баллов). Уровень реактивной тревоги оценивали по шкале Спилбергера – Ханина (< 30 баллов – отсутствие тревоги, 31–44 – умеренная тревога, > 45 баллов – выраженная тревога), степень астении – по шкале астенических состояний (ШАС) Л.Д. Малковой и Т.Г. Чертовой (30–50 баллов – отсутствие астении, 51–70 – слабая астения, 71–100 – умеренная астения, 101–120 баллов – выраженная астения). Динамику качества сна определяли на основании Питтсбургского опросника индекса качества сна (PSQI – Pittsburgh Sleep Quality Index) (< 5 – хороший сон, от 5 до 10 – сон среднего качества, от 10 до 21 – сон плохого качества). Динамику средней продуктивности внимания за пять минут работы характеризовал показатель S по тесту Ландольта.
Характеристика исследуемых препаратов
Изучено влияние аденозинергического антигипоксанта цитофлавина (Ц) из расчета 17 мг/кг (две таблетки два раза в день) в пересчете на сукцинат (первая группа больных), холинергического препарата холина альфосцерата (ХАС) в дозе 8,5 мг/кг, один флакон два раза в день (вторая группа), актопротектора мельдония (М) 14,2 мг/кг (третья группа), а также их комбинаций Ц + ХАС, Ц + М, Ц + М + ХАС. При назначении комбинаций дозы препаратов не меняли. Назначения выполняли дважды в день рer os (второе назначение не позднее 18.00) в течение 60 дней. Пациенты были разделены на семь групп, включая контрольную (здоровые добровольцы, у которых функциональные показатели находились в пределах нормы).
Дизайн исследования
Первый визит – скрининг – выявление больных с клиническими проявлениями АС и его нейропсихологической верификацией. Второй и третий визиты – 30-й и 60-й дни. На всех визитах проводились рутинные клинико-лабораторные исследования и нейропсихологическое тестирование по указанным шкалам.
Критерии включения в исследование: диагностированный клинически и нейрофизиологически АС (тест Спилбергера – Ханина > 31 балла, ШАС > 60 баллов, PSQI > 9 баллов). Тест ММSE (> 24 баллов) выполняли на этапе скрининга.
Критерии невключения: АС при тяжелых сердечно-сосудистых заболеваниях, перенесенных черепно-мозговых травмах, инсультах, инфарктах, тяжелых инфекциях в анамнезе, сахарный диабет 2-го типа, психические заболевания, хроническая интоксикация этанолом, гепатиты, вирус иммунодефицита человека, туберкулез в анамнезе, а также участие в других клинических исследованиях и непереносимость препаратов.
Результаты обработаны с применением пакета статистических программ SPSS 12RU и критерия U (Вилкоксона – Манна – Уитни, р = 0,05).
Результаты и их обсуждение
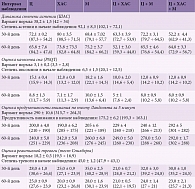
При поступлении у всех пациентов степень астении и реактивная тревожность превосходили вариант нормы в 2,5 раза – 92,1 ± 8,3 и 45,0 ± 1,2 соответственно. При этом показатель качества сна был снижен почти в пять раз – 16,3 ± 1,5 и 3,1 ± 0,2 соответственно (таблица). У всех пациентов отмечалось уменьшение продуктивности мышления за единицу времени по показателю S в два раза по сравнению с исходным значением (рис. 1). Больные предъявляли жалобы на трудности засыпания, плохой, прерывистый сон, слабость, утомляемость, снижение работоспособности. Наиболее часто звучали жалобы следующего характера: «еле ноги таскаю», «нет сил», «ничего не хочется».
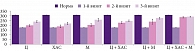
Применение Ц в течение 30 дней сопровождалось уменьшением показателя астении (ШАС) на 29% (р < 0,05) и тревоги на 60% (р = 0,01) по сравнению с исходным (почти в 1,3 и 1,6 раза соответственно). При этом незначительно, но достоверно увеличилась продуктивность мышления – на 12%, или в 1,1 раза, по сравнению с первым визитом (рис. 1). Качество сна улучшилось незначительно (р > 0,05) (рис. 2).
В группе ХАС показатель астении снизился на 15% (в 1,2 раза) по сравнению с исходным (р = 0,05), но был на 11% выше, чем в первой группе (Ц) (р > 0,05, абсолютные цифры). Уровень тревоги на фоне приема ХАС также был снижен по сравнению с исходным, но различий между первой и второй группами не выявлено (р > 0,05). В отношении показателя S (тест Ландольта) различий в механизме действия ХАС и Ц не зарегистрировано (p > 0,05) (рис. 1). Важно, что на фоне применения ХАС у больных существенно повысилось качество сна: показатель PSQI улучшился на 22% по сравнению с исходным (почти в 1,3 раза; р = 0,05) и на 17% относительно показателя первой группы (р < 0,05) (рис. 2).
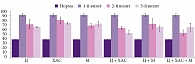
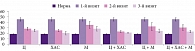
В третьей группе (М) степень астении составила 68,4 ± 4,4 (92,1 ± 8,3) на первом визите (таблица), то есть показатель улучшился на 34% (р < 0,01) и достоверно отличался от показателя второй группы на 25% (р < 0,05) (рис. 3). Отметим, что колебания доверительных интервалов были наименьшими среди трех групп, то есть достоверность изменений была выше. Интересно, что при достоверном снижении астении уровень тревоги в третьей группе превосходил аналогичные показатели в группах Ц и ХАС на 20 и 29% соответственно (р = 0,05). По сравнению с контрольной группой тревожность снизилась на 28% (в 1,3 раза) (р = 0,05) (рис. 4). Возможно, это отразилось на качестве сна больных, которое, исходя из абсолютных значений, ухудшилось по сравнению с исходным фоном на 11% (р > 0,05) с большим разбросом доверительных интервалов PSQI (рис. 2). Жалоб по поводу тревоги больные не предъявляли. М продемонстрировал лучший эффект, о чем свидетельствовал тест Ландольта (продуктивность внимания) – снижение АС на 8 и 3% (р > 0,05) (рис. 1). Такие разнонаправленные изменения могли быть связаны с особенностями действия М как актопротектора. Хотя известно, что ХАС способен активировать восходящие холинергические проекции и вызывать возбуждение коры мозга [1–3]. Полученные результаты подтверждают данные об актопротекторном эффекте М.
Была предпринята попытка изучить эффективность комбинации исследуемых препаратов. Показано, что эффективность комбинации Ц + ХАС (четвертая группа) в отношении редукции АС по абсолютным цифрам ШАС превышала таковую препаратов, используемых в монорежиме: в 1,1 раза (на 12%) по сравнению с Ц (р > 0,05), в 1,3 раза (на 21%) по сравнению с ХАС (р = 0,05) и на 8% по сравнению с М (р = 0,05) (таблица, рис. 3). Уровень тревоги существенно снизился и был наименьшим среди всех групп наблюдений. Так, к 30-му дню он составил 23,0 ± 0,7 (45 ± 1,2 исходно и 18,2 ± 0,5 в норме). Противотревожное действие комбинации превышало таковое Ц (на 25%; р = 0,05), ХАС (на 8%; р > 0,05) и М (на 52%; р = 0,05), причем с наименьшим разбросом доверительных интервалов (рис. 4). Иными словами, комбинация Ц + ХАС оказала наиболее выраженный противотревожный эффект на 30-й день лечения (по сравнению с другими вариантами лечения). Можно предположить, что действие Ц, который «открывает» метаболический шунт в биотрансформации ацетил-КоА – субстрата гликолиза, обеспечивает высокую скорость оборота ацетилхолина, для которого ХАС является донатором. Продуктивность внимания по показателю S (тест Ландольта) увеличилась в 1,3 раза (на 23%) по сравнению с исходным фоном (р = 0,01), 1,1 (на 13%), 1,2 (на 18%) и 1,1 раза (на 11%) по сравнению с Ц, ХАС и М соответственно (р = 0,05) (рис. 1). Отметим, что действие комбинации Ц + ХАС приводило к нормализации сна, хотя и с максимальным разбросом доверительных интервалов: абсолютные значения показателя составили 10 ± 2 (14,6 ÷ 5,4) при норме 3,1 ± 0,2 (3,3 ÷ 2,8) (таблица, рис. 2). Полученные результаты скорее всего обусловлены усилением действия ХАС на фоне применения Ц, поскольку химический синтез ацетилхолина, основного трофотропного медиатора центральной нервной системы, связан со скоростью образования ацетил-КоА, которая возрастает под действием Ц [4, 5].
При изучении комбинации Ц + М отмечалось снижение уровня АС в 1,3 раза (на 22%) по сравнению с исходным (р = 0,05). Достоверных различий в редукции АС между группами Ц, ХАС и М и группой Ц + М не выявлено. Уровень тревожности в группе Ц + М был ниже по сравнению с исходным (на 29%; р = 0,01), но по сравнению с группой М изменений практически не наблюдалось (рис. 4). Важной особенностью комбинации было повышение продуктивности внимания по тесту Ландольта по сравнению с исходной в 1,4 раза (26%) (р = 0,01) и действием препаратов в монотерапии. Эффективность комбинации Ц + М была сравнима с таковой комбинации Ц + ХАС (рис. 1). В отличие от монорежима М на фоне применения комбинации Ц + М отмечалось улучшение сна больных (р > 0,05). Ц активирует гликолиз, а М блокирует окисление жирных кислот, направляя их энергетический потенциал в реакции гликолиза [6]. Возможно, сочетанное действие сказалось на продуктивности внимания по показателю S (тест Ландольта) и одновременном снижении степени астении. Действие комбинации превысило действие ХАС в монотерапии. На приеме пациенты отмечали, что «сил стало больше». Вероятно, добавление к комбинации корригирующего сон препарата призвано улучшить показатели последнего не в ущерб основному действию комбинации в отношении продуктивности работы, что станет предметом будущих исследований.
На 30-й день исследования зафиксировано значительное снижение степени АС на фоне применения трехкомпонентной комбинации Ц + ХАС + М: на 44% относительно исходного уровня (р < 0,01) (рис. 3), на 36% – относительно Ц (р < 0,01), на 53% – ХАС (p < 0,01), на 31% – М (p = 0,05), на 21% – Ц + ХАС (p = 0,05), на 38% – Ц + М (p = 0,05) (рис. 3). Данная комбинация продемонстрировала максимальное снижение показателя среди всех исследуемых препаратов и их комбинаций. Кроме того, при использовании трехкомпонентной комбинации увеличилась продуктивность внимания: величина показателя S превысила исходный фон в 1,64 раза (на 40%), аналогичные показатели, достигнутые на фоне применения комбинаций Ц + ХАC, Ц + М и монотерапии, – на 22, 18 (p < 0,01) и более чем на 30% соответственно (р < 0,01) (рис. 1). При этом данная комбинация практически не повлияла на степень тревоги, чем практически не отличалась от М и его комбинации с Ц, но имела достоверное преимущество перед Ц, ХАС и Ц + ХАС (р = 0,05). Можно предположить, что противоастеническое действие и продуктивность мышления происходили за счет потенцирования действия ингредиентов комбинированных препаратов, работающих в одном ключе. Важно, что редукция тревоги и астении наряду с увеличением продуктивности не ухудшали качества сна больных (Ц – 15,1 ± 0,4, ХАС – 12,8 ± 0,9, Ц + ХАС – 10,0 ± 2,0, Ц + М – 15,0 ± 3,3) (таблица). Качество сна улучшилось на 35% (по сравнению с улучшением на фоне монотерапии М) (р = 0,01) (рис. 2).
Таким образом, на 30-й день исследования были установлены закономерности:
- по силе противоастенического действия: Ц + ХАС + М > Ц + ХАС > М > Ц и Ц + М > ХАС;
- купированию тревожности: Ц + ХАС > ХAC > Ц > Ц + ХАС + М > Ц + М > M;
- усилению продуктивности внимания: Ц + ХАС + М > Ц + М > Ц + ХАС > М > Ц > ХАС;
- улучшению качества сна: Ц + ХАС > ХАС и Ц + ХАС + М > Ц + ХАС + М > ХАС > Ц и Ц + М.
Назначение М в монорежиме имело тенденцию к ухудшению качества сна к 30-му дню исследования (без субъективных жалоб больных) при одновременном выраженном увеличении работоспособности.
На 60-й день (третий визит) в группах Ц, ХАС и М наблюдалась стабилизация динамики астении (различия по группам при р > 0,05). Уровень тревоги снизился во всех группах пациентов, получавших монотерапию. Однако достоверными были только изменения в группе ХАС, причем они достигали нормы. Важный момент: по сравнению с исходным фоном при использовании Ц реактивная тревога снизилась на 45% (p < 0,01), на фоне применения ХАС – на 55%, М – на 40% (рис. 4). По показателю S (тест продуктивности внимания) наибольшие изменения зафиксированы в группе М: увеличение продуктивности мышления на 40% по сравнению с исходным, на 22% – по сравнению с 30-м днем. Действие М превышало таковое Ц и ХАС на 8 и 16% соответственно (рис. 1). При этом в группе М достоверно улучшилось качество сна – на 45% относительно предыдущего периода наблюдения. Больные отмечали уменьшение дневной сонливости, отсутствие трудностей при засыпании в вечернее время, которые имели место на фоне увеличения дневной работоспособности и уменьшения тревоги (таблица). Увеличение дневной активности позволило нормализовать режим сна и бодрствования. Из сказанного следует, что у больных АС прием М (до достижения нормализации качества сна) должен быть длительным и превышать 30 дней. В группах Ц и ХАС качество сна также улучшилось по сравнению с 30-дневным периодом на 42 (р < 0,05) и 45% (р = 0,05) соответственно и, согласно PSQI, перешло в категорию «среднее качество сна».
Назначение Ц + ХАС сопровождалось максимальным снижением степени астении среди всех исследуемых групп: состояние улучшилось на 18% по сравнению с показателем, зарегистрированным на 30-й день, и на 45% (p < 0,05) по сравнению с исходным (р < 0,01), причем действие Ц + ХАС превышало таковое Ц + М и Ц + ХАС + М на 21 и 20% (p = 0,05) соответственно. Однако показатель степени астении все же превышал норму на 27% (р = 0,01). На фоне применения комбинации Ц + ХАС удалось стабилизировать уровень тревоги (р > 0,05). При использовании комбинации Ц + М уровень тревоги снизился на 25% по сравнению уровнем, зафиксированным на 30-й день наблюдения (р = 0,05). Трехкомпонентная комбинация позволила снизить уровень тревоги на 24% (р = 0,05). По показателю S происходил прирост продуктивности внимания при назначении Ц + ХАС на 9% (р = 0,05), Ц + М – на 14% (р = 0,05), Ц + ХАС + М – на 1% (p > 0,05) (рис. 1). По абсолютным значениям показателя качества сна максимальное улучшение показателя PSQI отмечалось на фоне применения Ц + ХАС: он находился на уровне нормы, но имели место большие колебания доверительных интервалов (рис. 2). При использовании комбинации Ц + М качество сна улучшилось на 27% (р > 0,05). Трехкомпонентная комбинация оказала наиболее выраженный эффект: качество сна у больных этой группы улучшилось на 34% относительно показателя предыдущего периода (р < 0,05) (рис. 2).
Таким образом, на 60-й день исследования определены закономерности:
- по силе противоастенического действия: Ц + ХАС > Ц + ХАС + М = Ц + М;
- купированию тревоги: Ц + ХАС > Ц + ХАС + М = Ц + М;
- продуктивности внимания: Ц + ХАС + М > Ц + М > Ц + ХАС;
- улучшению качества сна: Ц + ХАС > Ц + ХАС + М > Ц + М.
Выводы
Исследование показало, что при использовании НЦП метаболической и медиаторной групп снижаются клинические и нейрофизиологические проявления АС.
В действии препаратов и их комбинаций имелись различия по влиянию на динамику показателя тревоги (тест Спилбергера), продуктивности работы (тест Ландольта), качества сна (PSQI) и астении (ШАС), выявленные на 30-й и 60-й дни исследования.
На 60-й день (третий визит) исследования определены закономерности:
- по силе противоастенического действия: Ц + ХАС > Ц + ХАС + М = Ц + М;
- купированию тревоги: Ц + ХАС > Ц + ХАС + М = Ц + М;
- продуктивности внимания: Ц + ХАС + М > Ц + М > Ц + ХАС;
- улучшению качества сна: Ц + ХАС > Ц + ХАС + М > Ц + М.
- НЦП метаболической (цитофлавин) и медиаторной (холина альфосцерата) групп следует применять длительно: на 30-й и 60-й дни исследования зафиксированы отличия между препаратами и их комбинациями в отношении влияния на степень астении, продуктивность работы и качество сна.
Цитофлавин, входящий в схему терапии (как двух-, так и трехкомпонентной), оптимизирует сон, повышает внимание и купирует тревогу.
V.V. Afanasiev, PhD, Prof., Ye.L. Pugachyova, PhD, Ye.R. Barantsevich, PhD, Prof., N.V. Petrova, PhD, G.Ya. Lapkina, PhD, Yu.P. Orlov, PhD, Prof., A.A. Lebedeva
I.I. Mechnikov North-Western State Medical University, Saint Petersburg
Academician I.P. Pavlov First St. Petersburg State Medical University
Omsk State Medical University
Academician I.P. Pavlov Research Institute for Surgery and Emergency Medicine of the First St. Petersburg State Medical University
Contact person: Vasily V. Afanasiev, sobaka_liza@mail.ru
Purpose – to reduce clinical manifestations of asthenia in patients of the middle age group.
Material and methods. Prospective, open label, observational study. 90 patients (35-55 y.o.) with identified asthenia (IDC-10: F48, R13, R53), were divided into 7 gr. Interventions were identical, except treated gr. received cytoflavine (C), choline-alfascerate (Ch-α), meldonium (M), and combinations of C + Ch-α, C + M, and C + Ch-α + M in corresponding doses: 17 mg/kg calculated according succinate, 8,5 mg/kg, 14,2 mg/kg BID. Level of asthenia, anxiety status, sleep disturbances and fine motor skills reflecting attention productivity were recorded by clinical evaluation and neuropsychological testing for the period of March 2018 – December 2019. Tests included: Asthenic Scale, Spilberger Test, Sleep Quality Score (PSQI), and Landolt Scale (S criteria).
Results. In the initial period, a high degree of asthenia, anxiety, and impaired sleep quality were detected, exceeding the normal value by 2.4, 2.5, and 5.3 times (p < 0.01), decrease in attention productivity by 1.6 times also was recorded. On the 30th day, efficacy patterns in the series were: for asthenia reduction:
C + Ch-α + M > C + Ch-α > M > C and C + M > Ch-α;
for anxiety relief: C + Ch-α > Ch-α > C > C + Ch-α + M > C + M > M;
productivity of attention: C + Ch-α + M > C + M > C+ Ch-α > M > C > Ch-α;
quality of sleep improvement: C + Ch-α > Ch-α and C + Ch-α + M > C+ Ch-α + M > Ch-α > C and C + M with different reliability.
Conclusions. Neurocytoprotectors of metabolic and neurotransmitter mimic groups reduced the clinical and neurophysiological manifestations of asthenia in middle aged patients. Clinical efficacy of given medications was different on 30th and 60th day according to patient neuropsychologic exam. Final efficacy rates: for asthenia reduction:
C+ Ch-α > C + Ch-α + M = C + M; for anxiety relief: C + Ch-α > C + Ch-α +M = C + M;
productivity of attention: C + Ch-α + M > C + M > C; quality of sleep improvement: C + Ch-α > C + Ch-α + M > C + M.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.