количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Эффективность препаратов альфа-липоевой кислоты при диабетической полиневропатии
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №3 (29)
- Аннотация
- Статья
- Ссылки
- English
Представлен обзор работ, обосновывающих эффективность лечения диабетической полиневропатии (ДПН) препаратами альфа-липоевой кислоты (АЛК) для внутривенного введения и перорального приема. Показано, что применение препаратов АЛК является патогенетически обоснованным, приводит к уменьшению позитивной и негативной невропатической симптоматики. Использование таблетированных форм АЛК способствует замедлению или остановке прогрессирования ДПН при длительном применении, что подтверждено данными собственного исследования «ЭТИКА». Ретроспективный (post-hoc) анализ изменения оценки по шкале NISS-LL показал, что прием пациентами с ДПН таблетированного препарата АЛК (Тиолепта®) 600 мг один раз в день в течение четырех недель уменьшил позитивные и негативные невропатические симптомы на срок до трех месяцев. Рекомендовано инфузионное и пероральное применение препаратов АЛК для лечения и профилактики ДПН.
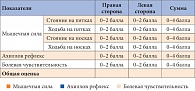
Таблица. Модифицированная шкала NIS-LL
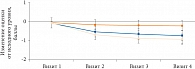
Рисунок. Динамика негативной невропатической симптоматики по модифицированной шкале NIS-LL в ходе исследования «ЭТИКА»
Число больных сахарным диабетом (СД) в мире стремительно увеличивается и, по прогнозам экспертов, к середине столетия должно достигнуть полумиллиарда. В настоящий момент основную угрозу продолжительности и качеству жизни больных СД представляют его осложнения. Самое частое осложнение СД – дистальная симметричная сенсорно-моторная полиневропатия (ДПН). ДПН повышает заболеваемость и смертность, ухудшает качество жизни больных СД [1, 2]. Распространенность ДПН широко варьирует в разных этнических группах. В США и России частота выявления ДПН в популяции больных СД 1 типа более 50%, у индусов – менее 25%, что, предположительно, связано с генетической детерминированностью диабетического тканевого поражения [3–6].
Факторы риска развития ДПН
Как показало исследование DCCT (Diabetes Control and Complications Trial – Исследование контроля сахарного диабета и его осложнений) и его наблюдательное продолжение EDIC (Epidemiology of Diabetes Interventions and Complications – Эпидемиология вмешательств и осложнений при сахарном диабете), у больных СД 1 типа интенсивная инсулинотерапия c достижением целевого уровня гликемии снижает риск развития ДПН, но не может полностью предотвратить ее возникновение [7, 8]. У больных СД 2 типа подавляющее большинство исследований (например, Steno-2, в котором больные СД 2 типа наблюдались в течение 13 лет) не подтвердило достоверного снижения риска развития ДПН на фоне интенсивной инсулинотерапии [9]. Не обнаружено снижения риска развития ДПН и в группе пожилых больных СД 2 типа, получавших интенсивную инсулинотерапию, по сравнению с группой традиционного лечения, хотя снижение уровня HbA1c в группе интенсивной терапии инсулином было достоверным [10]. В исследовании ADVANCE (Action in Diabetes and Vascular disease: preterAx and diamicroN-MR Controlled Evaluation trial – Действие при сахарном диабете и заболеваниях сосудов: контролируемая оценка Претеракса и Диамикрона МВ) на большой выборке (более 11 тысяч пациентов) также не обнаружено снижения риска развития ДПН в группе, находившейся на интенсивной терапии инсулином, по сравнению с группой, получавшей традиционное лечение [11]. Исследование ACCORD (Action to Control CardiOvascular Risk in Diabetes – Исследование по контролю риска развития сердечно-сосудистых заболеваний при сахарном диабете 2 типа) не выявило существенного влияния интенсивной терапии инсулином на риск развития микрососудистых осложнений у больных СД 2 типа, причем исследование было прекращено из-за увеличения смертности в этой группе больных [12].
В 2005 г. Майкл Браунли (M. Brownlee) в Бентингской лекции включил в число основных факторов, влияющих на формирование ДПН, длительные изменения метаболизма глюкозы [13]. Влияние продолжительности метаболических нарушений на формирование ДПН подтверждено в эпидемиологическом исследовании у 120 больных СД 1 типа [14]. Амплитуда двигательного и сенсорного потенциалов, отражающая число сохранных волокон в периферическом нерве, была обратно пропорциональна продолжительности СД. Другие факторы риска развития ДПН (СД 1 типа, неудовлетворительный контроль гликемии, избыточный вес, наличие артериальной гипертонии, пожилой возраст, курение, дислипидемия, низкий уровень инсулина и С-пептида) уступают по значимости фактору длительности метаболических нарушений, связанных с гипергликемией [14–17].
Роль продолжительности и выраженности метаболических нарушений при СД подразумевает, что лечение ДПН в первую очередь должно основываться на хорошем контроле СД. Другими словами, хороший контроль СД является приоритетным в профилактике развития ДПН. Вместе с тем только компенсации СД недостаточно для предотвращения и обратного развития ДПН, поэтому вопрос о патогенетическом лечении поражения периферических нервов чрезвычайно актуален.
Патогенетическая терапия ДПН
Принципы патогенетической терапии ДПН базируются на современных представлениях о механизмах поражения периферических нервов. Хорошо известен основной ряд патофизиологических механизмов, ответственных за нарушение структуры и функции нервных волокон, – активация полиолового пути утилизации глюкозы; повышение уровня и накопление конечных продуктов неферментативного гликирования белков (Advanced Glycation Endproducts (AGEs) – КПГ); нарушение обмена основных жирных кислот; снижение эндоневрального кровотока с развитием ишемии и гипоксии. Объединяющая большинство известных механизмов теория молекулярного и биохимического нарушения клеточной функции, включая нервные волокна, была предложена в начале двухтысячных годов. Согласно данной модели, основную роль в развитии нарушений в клетках различных органов играет окислительный стресс [13, 18]. Определение ключевого звена патогенеза ДПН обосновало применение для лечения диабетического поражения периферических нервов антиоксидантов и антигипоксантов, не исключая при этом возможность воздействия на другие важные звенья патогенеза путем использования блокаторов образования КПГ, альдозоредуктаз, протеинкиназы С, активаторов транскетолазы, нейротрофических факторов, стимуляторов нейрорегенерации и реиннервации [19].
Внутривенное введение АЛК в лечении ДПН
Анализ исследований, посвященных различным методам фармакологического лечения ДПН, показывает, что наиболее внушительной доказательной базой обладает антиоксидантная терапия альфа-липоевой кислотой (АЛК) [20, 21, 22]. АЛК является мощным естественным липофильным антиоксидантом, что определяет возможность ее терапевтического использования [23]. Вводимая в организм АЛК восстанавливается в основном из R(+)-изоформы до дигидролипоевой кислоты, которая и обеспечивает терапевтические эффекты, в частности за счет действия в качестве «уборщика» основного свободного кислородного радикала – супероксида. Экспериментальные исследования, проведенные у животных с СД, показали, что АЛК снижает содержание свободных радикалов, в том числе супероксида, и активность перекисного окисления липидов, повышает активность супероксиддисмутазы и каталазы, увеличивает скорость распространения возбуждения по периферическим нервам, улучшает эндоневральный кровоток, увеличивает утилизацию глюкозы в кардиомиоцитах, ингибирует развитие катаракты, предотвращает поражение клубочкового аппарата почек [24–28]. В клинических исследованиях с применением АЛК у больных СД отмечено улучшение состояния системы микроциркуляции, уменьшение интенсивности перекисного окисления липидов, нормализация содержания оксида азота и стресс-белков, а также эндотелийзависимых реакций сосудистой стенки, уменьшение активации ядерного фактора транскрипции каппа-B (NF-каппа-B), улучшение фильтрационной функции почек и утилизации глюкозы [29–32].
Первым рандомизированным двойным слепым плацебоконтролируемым исследованием эффективности внутривенного введения АЛК стало проведенное в Германии исследование ALADIN (Alpha-Lipoic Acid in DIabetic Neuropathy – Альфа-липоевая кислота при диабетической невропатии). У 328 амбулаторных пациентов с СД 2 типа оценивалась эффективность внутривенного введения АЛК. Больные были разделены на 4 группы: получавшие АЛК в дозе 100 мг, 600 мг, 1200 мг и группу плацебо (14 инфузий в течение 3 недель). ДПН оценивалась по шкале TSS (Total Symptom Score – Общая оценка симптомов), с помощью которой контролируют интенсивность и частоту позитивных невропатических симптомов (стреляющая боль, жжение, онемение и парестезии) в течение последних 24 часов [33, 34]. Побочные эффекты (головная боль, тошнота, рвота) чаще отмечались при дозировке 1200 мг (32,6%), чем при дозировке 600 мг (19,8%) и введении плацебо (20,7%) [35].
Исследование ALADIN позволило сделать несколько важных заключений. Во-первых, были предложены адекватные критерии оценки ДПН, которые использовались в дальнейших работах. В первую очередь это относится к принятию оценки по шкале TSS в качестве основного показателя эффективности АЛК. Во-вторых, была показана дозозависимая эффективность АЛК, причем доза 600 мг признана оптимальной, так как доза 1200 мг не приводила к дополнительному повышению эффективности лечения. В-третьих, была доказана эффективность и безопасность лечения ДПН внутривенным введением АЛК.
В проведенном в Германии исследовании ALADIN III двум амбулаторным группам больных СД 2 типа (167 и 174 пациентов соответственно) на первой стадии внутривенно вводили 600 мг АЛК или плацебо в течение 3 недель [34]. Для анализа динамики силы мышц, рефлексов и порогов чувствительности использовалась шкала невропатических нарушений в нижних конечностях NIS-LL (Neuropathy Impairment Score Low Limbs), более подробная, чем шкала NDS (Neuropathy Disability Score). Через 3 недели лечения отмечено статистически значимо более выраженное снижение балльной оценки по шкале NIS-LL в группе приема АЛК по сравнению с плацебо-контролем (p = 0,02). Исследование ALADIN III подтвердило снижение выраженности позитивной невропатической симптоматики и показало возможность уменьшения неврологического дефицита у больных СД 2 типа с ДПН на фоне терапии АЛК.
Рандомизированное двойное слепое плацебоконтролируемое исследование SYDNEY 1 (Symptomatic Diabetic Neuropathy – Симптоматическая диабетическая невропатия) в России проводилось с той же целью, что и исследование ALADIN в Германии, но отличалось целым рядом особенностей дизайна [36, 37]. С тестированием TSS (ежедневно) и NIS-LL было обследовано (до и после лечения) 120 больных СД 1 и 2 типов с ДПН. Пациенты были разделены на две группы: в течение 3 недель пациенты первой группы получали внутривенно АЛК в дозе 600 мг, второй – плацебо (0,04 мг рибофлавина). Среди особенностей исследования SYDNEY 1 выделим следующие:
- госпитализация больных на месяц, что обеспечило постоянный контроль гликемии, соблюдение диеты, стандартные физические нагрузки и таким образом – хороший контроль СД;
- высокий исходный уровень баллов по шкале TSS (не менее 7,5 балла), тогда как в предыдущих исследованиях исходным был уровень от 5 баллов, что обеспечивало гораздо больший возможный диапазон изменений TSS;
- предварительное обучение эндокринологов и неврологов, принимавших участие в исследовании, что позволило стандартизировать оценку TSS и NIS-LL в процессе лечения, причем тестирование проводил один врач-невролог в одно и то же время дня в ходе всего исследования;
- в течение первой недели пациенты обеих групп получали плацебо (период отмывки); за этот период счет баллов по шкале TSS не должен был снижаться более чем на 3 балла или опускаться ниже отметки в 5 баллов, что позволило исключить плацебо-респондеров.
Средняя оценка по шкале TSS уменьшилась на 5,72 ± 1,53 в группе, получавшей АЛК, и лишь на 1,82 ± 1,92 в группе плацебо-контроля (p < 0,001). Достоверное различие между группами по средней оценке по шкале TSS отмечено только на четвертой неделе лечения. Анализ динамики баллов по каждому отдельному симптому (боль, жжение, онемение, парестезии) в процессе лечения показал достоверное уменьшение выраженности всех симптомов на четвертой неделе в группе, получавшей АЛК, по сравнению с группой приема плацебо (p < 0,001). Балльная оценка по шкале NIS-LL уменьшилась на 2,70 ± 3,37 балла в группе, получавшей АЛК, и только на 1,20 ± 4,14 в группе плацебо-контроля (p < 005).
Эффективность амбулаторного трехнедельного курса внутривенного введения АЛК больным СД (n = 241) в сравнении с плацебо (n = 236) по данным тестирования пациентов по шкалам TSS и NIS также изучалась в исследовании NATHAN 2 (Neurological Assessment of Thioctic Acid in Diabetic Neuropathy – Неврологическая оценка применения тиоктовой кислоты при диабетической невропатии) на базе 33 диабетологических центров США, Канады и Европы. Исследование подтвердило эффективность АЛК при внутривенном введении препарата [22].
Стандартный метод и сроки введения АЛК в четырех исследованиях (ALADIN, ALADIN III, SYDNEY, NATHAN 2) позволили провести метаанализ полученных в них результатов, сравнив данные 716 больных ДПН, получавших АЛК, и 542 больных, получавших плацебо [22]. Выявлен достоверно лучший эффект АЛК по шкале TSS в сравнении с плацебо (p < 0,05). Снижение TSS более чем на 50% отмечено у 52,7% больных, получавших АЛК, и у 36,9% пациентов в группе плацебо (p < 0,05). Из отдельных симптомов шкалы TSS в наибольшей степени уменьшалось жжение. Метаанализ динамики NIS-LL проводился только для трех исследований, так как в исследовании ALADIN шкала NIS-LL не использовалась. Не было выявлено достоверного различия в отношении NIS-LL при использовании АЛК и плацебо. Среди отдельных симптомов NIS-LL достоверная разница была получена в отношении болевой и тактильной чувствительности и ахилловых рефлексов. Результаты метаанализа свидетельствуют о том, что при ДПН внутривенное введение АЛК в течение 3 недель (14 инфузий) безопасно и приводит к значительному улучшению в отношении позитивной невропатической симптоматики и неврологического дефицита. Вопрос о длительности эффекта курса внутривенных инфузий АЛК остается открытым. В исследовании, проведенном в России, было показано, что после окончания трехнедельного курса внутривенного введения АЛК в течение первого месяца наблюдается дальнейшее улучшение состояния, причем эффект лечения существенно снижается только через 6 месяцев [38].
Рассматривая вопрос о лечении ДПН с помощью АЛК, необходимо учитывать, что внутривенное введение препарата возможно далеко не у всех больных с СД 2 типа из-за плохого состояния вен. Одни больные отказываются от внутривенного введения АЛК, другие по причине негативного отношения к внутривенному введению каких-либо препаратов получают неполноценный и неэффективный курс лечения в виде 5–10 инфузий. Некоторые больные не имеют возможности провести внутривенный курс лечения АЛК в больничных или амбулаторных условиях. Кроме того, при введении препарата в вену существует опасность местных реакций – болевых ощущений или развития флебита. Наконец, может возникнуть необходимость длительного введения препарата у больных с плохим контролем СД, при наличии тяжелой ДПН или при применении АЛК с профилактическими целями. Последний аспект особенно важен, так как проблема применения АЛК для профилактики развития или прогрессирования ДПН безусловно актуальна. В связи с этим необходимо рассмотреть возможность применения таблетированной формы АЛК с самого начала курса лечения.
Таблетированные формы АЛК для лечения и профилактики ДПН: международный и российский опыт
Первая оценка эффективности таблеток АЛК относится к 1988 г., когда было проведено двойное слепое исследование влияния перорального приема 600 мг АЛК в течение 84 дней у 35 больных СД с оценкой неврологического статуса и электромиографических (ЭМГ) показателей [39]. У больных СД на фоне перорального приема АЛК не было отмечено позитивного эффекта по сравнению с пациентами, получавшими витамины группы B. Поскольку в настоящее время доказано, что тиамин, активируя транскетолазу, может патогенетически влиять на течение ДПН [40], дизайн этого исследования не представляется адекватным.
В исследовании ORPIL (Oral Pilot – Пилотное исследование перорального приема) изучали эффективность приема в течение 3 недель таблеток АЛК, назначаемых 3 раза в день (суммарная дневная доза 1800 мг) в группе из 12 больных СД 2 типа с ДПН, в сравнении с эффектом плацебо в аналогичной группе из 12 пациентов. Показатели TSS в достоверно большей степени уменьшались в группе АЛК (p = 0,021). Баллы по шкале NDS также достоверно уменьшались в группе АЛК по сравнению с группой плацебо (p = 0,025). Различий в частоте побочных эффектов между группами не отмечено. Основным недостатком работы можно считать небольшое число обследованных больных, что затрудняет статистическую обработку [34].
В исследовании DEKAN (Deutsche Kardiale Autonome Neuropathie – Германское исследование кардиальной автономной невропатии) у 73 больных СД 2 типа с нарушением вариабельности сердечного ритма в течение 4 месяцев использовали для лечения либо АЛК в таблетках (200 мг 4 раза в день, суммарная доза 800 мг), либо плацебо. Выявлено достоверное увеличение вариабельности сердечного ритма в группе приема АЛК по сравнению с группой плацебо-контроля (p < 0,05). Частота побочных эффектов в группах достоверно не различалась [34].
Целесообразность длительного приема таблеток АЛК с целью лечения и замедления прогрессирования ДПН изучалась в исследовании ALADIN II [21]. В течение двух лет таблетки АЛК получали две группы больных СД 1 и 2 типов: первая группа (n = 18) получала АЛК в дозе 600 мг 2 раза в день, вторая (n = 27) – в дозе 600 мг 1 раз в день, пациенты третьей группы (n = 20) получали таблетки-плацебо. Исследование показало увеличение скорости реакции возбуждения (СРВ) по чувствительному нерву (n. suralis) по сравнению с плацебо для обеих групп, получавших АЛК. Потенциал действия n. suralis достоверно увеличился только в группе больных, получавших 600 мг АЛК (p < 0,05), а СРВ по двигательному n. tibialis достоверно возросло по сравнению с плацебо только в группе больных, получавших 1200 мг АЛК. Через 2 года различий между группами по баллам NDS не отмечено.
Остается нерешенным вопрос и об эффективности лечения ДПН короткими курсами таблеток АЛК. В 2005 г. в нескольких эндокринологических и неврологических центрах России и Израиля проведено исследование SYDNEY II, в котором изучали эффективность лечения ДПН при помощи таблеток АЛК в течение 3 недель у больных СД 1 и 2 типов. Пациенты были разделены на 4 группы: первая группа получала 600 мг АЛК в день, вторая – 1200 мг, третья – 1800 мг и четвертая группа получала таблетки плацебо. Полученные результаты показали, что отличий в уменьшении оценки по шкале TSS между группами не было, при этом эффективность лечения АЛК во всех группах была достоверно выше, чем при приеме плацебо [41].
Уменьшение позитивной и негативной невропатической симптоматики при использовании АЛК не вызывает сомнений, так как подтверждено многочисленными контролируемыми исследованиями. Но вопрос, способна ли АЛК замедлить или остановить прогрессирование ДПН при длительном применении, некоторое время оставался открытым. В рандомизированном двойном слепом исследовании NATHAN 1 460 пациентов с СД и ДПН получали 600 мг АЛК или плацебо в течение 4 лет [42]. Применяли следующие методы: оценка по шкале NIS-LL, 5 электрофизиологических тестов, контроль вариабельности сердечного ритма и порога вибрационной чувствительности согласно разработкам P.J. Dyck из клиники Mayo. В ходе исследования показаны достоверные различия между группой пациентов, получавших АЛК, и группой приема плацебо в отношении неврологического дефицита, вариабельности сердечного ритма и скорости проведения возбуждения. Таким образом, АЛК можно использовать не только в виде коротких курсов для улучшения состояния больных, но и в качестве длительной терапии с целью профилактики прогрессирования ДПН и предотвращения развития синдрома диабетической стопы.
В России используются несколько препаратов АЛК: Тиогамма®, Берлитион®, Тиоктацид®, Эспа-Липон. Недавно на российском рынке лекарственных средств появились отечественные препараты АЛК, один из которых препарат Тиолепта® фирмы ЗАО «Канонфарма продакшн».
В связи с тем что препарат АЛК Тиолепта® появился на российском фармакологическом рынке относительно недавно, проведено исследование «ЭТИКА», целью которого стала оценка клинической эффективности и безопасности лечения Тиолептой при дистальной симметричной сенсорно-моторной ДПН. Одной из задач исследования было определение длительности клинического эффекта Тиолепты после курса лечения. Исследование клинического эффекта препарата Тиолепта® начато в 2011 г. при амбулаторном лечении больных СД 1 и 2 типов с ДПН. Выбор амбулаторного приема таблетированной формы Тиолепты обусловлен тем, что наибольшее число больных СД 1 и 2 типов нуждаются именно в длительном амбулаторном приеме препарата. Внутривенное капельное введение АЛК с необходимым числом капельниц (однократно в день, не менее 14 инфузий) в поликлинических условиях может быть затруднено.
Для решения поставленной цели 93 врача из 12 городов (Москва, Санкт-Петербург, Ставрополь, Красноярск, Пермь, Волгоград, Ростов-на-Дону, Краснодар, Екатеринбург, Самара, Нижний Новгород, Новосибирск) проанализировали динамику клинических показателей ДПН у 205 больных СД 1 и 2 типов (196 больных СД 2 типа, 9 больных СД 1 типа; 134 женщины и 71 мужчина). Средний возраст больных составил 59,3 ± 10,1 года, средний индекс массы тела – 30,9 ± 5,42 кг/м2, средняя длительность СД – 10,3 ± 5,36 года, средний уровень HbA1c – 7,89 ± 1,28, средняя длительность ДПН – 5,6 ± 3,49 года, среднее систолическое артериальное давление (АД) – 142,5 ± 18,4 мм рт. ст., среднее диастолическое АД – 87,5 ± 10,4 мм рт. ст. Все пациенты несколько лет наблюдались у врачей, участвовавших в исследовании, – в среднем 7,99 ± 4,21 года. 93,7% больных регулярно получали лечение по поводу СД. Большинство больных не курили (89,27%) и не употребляли алкоголь (88,29%). У участников исследования были зарегистрированы следующие сопутствующие заболевания: артериальная гипертония – у 73,66% пациентов, ишемическая болезнь сердца – у 30%, хронический холецистит и панкреатит – у 16,59%.
В исследование включались больные с симптомной ДПН. Разделение на стадии ДПН проводилось по классификации P.J. Dyck [43]. Согласно этой классификации, на стадии 2а ДПН у больных отмечаются жалобы на типичные позитивные невропатические симптомы (боль, жжение, онемение, парестезии) и негативная невропатическая симптоматика (снижение чувствительности и рефлексов), но отсутствует слабость в стопах (больной стоит и ходит на пятках). На стадии 2b ДПН дополнительно выявляется дистальная слабость в ногах. При ДПН 3-й стадии возникают нарушения социальной адаптации и трудоспособности. В исследование «ЭТИКА» в основном были включены больные с 2а и 2b стадиями ДПН – 204 пациента, 3-я стадия ДПН была диагностирована у 1 больной.
Основным показателем выраженности сенсорных феноменов при ДПН в исследовании «ЭТИКА» служила оценка по шкале TSS. Для оценки выраженности неврологического дефицита (негативная невропатическая симптоматика) использовалась модифицированная шкала NIS-LL (таблица). Необходимость применения модифицированной шкалы NIS-LL была вызвана тем, что подавляющее большинство врачей проводили исследование в поликлинических условиях, не имея возможности тратить много времени на использование полной шкалы.
Мышечную силу оценивали следующим образом: 0 баллов – норма, 1 балл – снижение, 2 балла – не может стоять или ходить на пятках или носках. Рефлексы также оценивали по балльной системе: 0 баллов – норма, 1 балл – снижение, 2 балла – отсутствие. Для пациентов в возрасте 50 лет и старше снижение ахиллова рефлекса оценивали как 0 баллов, отсутствие ахиллова рефлекса – как 1 балл. Болевая чувствительность к уколу тупой иглой оценивалась на 1-й фаланге большого пальца стопы: 0 баллов – норма, 1 балл – снижение, 2 балла – отсутствие.
Перед назначением лечения все больные проходили оценку клинического состояния (визит 1). Затем пациенты в течение четырех недель получали препарат Тиолепта® в дозе 600 мг ежедневно утром, за 30–40 минут до завтрака.
После лечения (4 недели) проводилось повторное тестирование состояния больных (визит 2). В дальнейшем больные продолжали наблюдаться с повторной оценкой состояния через 30 дней (визит 3) после начала лечения и через 90 дней после начала лечения (визит 4). Все результаты тестирования на визитах 2, 3, 4 сравнивались с данными визита 1. Сопоставление данных по визитам 1 и 2 позволило оценить эффективность препарата Тиолепта®, а сопоставление данных визита 1 и визитов 3 и 4 – оценить продолжительность действия четырехнедельного курса лечения.
Первые результаты проведенного исследования (опубликованы в 2012 г.) продемонстрировали, что Тиолепта® достоверно улучшает состояние больных ДПН, приводя к уменьшению оценки по шкале TSS после месячного приема препарата в дозе 600 мг ежедневно. Эффект от проведенного курса лечения сохранялся в течение 3 месяцев [44].
Позже была проведена обработка данных, полученных при тестировании с помощью модифицированной шкалы NIS-LL. Известно, что позитивная невропатическая симптоматика обладает свойством уменьшаться под действием плацебо, что было показано в ряде исследований влияния на ДПН различной патогенетической терапии [35, 45]. Результат тестирования с помощью шкалы NIS-LL демонстрирует меньшую зависимость от плацебо-эффекта [46]. В этой связи полученное улучшение (уменьшение суммы баллов) по шкале NIS-LL подтверждает, что улучшение по шкале TSS действительно отражает улучшение функционального состояния периферических нервов (рисунок).
Наблюдение за больными, получившими полный курс инфузий АЛК в течение трех недель, выявило, что уменьшение позитивной невропатической симптоматики (боль, жжение, онемение, парестезии) достоверно сохраняется в течение 6 месяцев [44]. Результаты исследования «ЭТИКА» показали, что прием Тиолепты в течение четырех недель уменьшил позитивные и негативные невропатические симптомы на срок до трех месяцев (визит 4).
На основании полученных в исследовании «ЭТИКА» данных можно сделать несколько выводов. Препарат Тиолепта® эффективен при ДПН, он достоверно уменьшает позитивную невропатическую симптоматику и частично редуцирует негативную невропатическую симптоматику. После прекращения приема препарата его эффект в отношении уменьшения жалоб больных и неврологического дефицита сохраняется на срок до трех месяцев. Препарат хорошо переносится и характеризуется благоприятным профилем безопасности.
Оценивая в целом эффективность лечения ДПН с применением инфузионной и таблетированной форм АЛК, можно сказать, что есть все основания рекомендовать врачам-неврологам, эндокринологам и терапевтам использование АЛК в клинической практике.
1. Котов С.В., Калинин А.П., Рудакова И.Г. Диабетическая нейропатия. М.: МИА, 2011. 438 с.
2. Tesfaye S., Boulton A.J., Dyck P.J. et al. Diabetic neuropathies: update on definitions, diagnostic criteria, estimation of severity, and treatments // Diabetes Care. 2010. Vol. 33. № 10. P. 2285–2293.
3. Зотова Е.В., Савостьянов К.В., Чистяков Д.А. и др. Поиск ассоциации полиморфных маркеров генов, кодирующих ферменты антиоксидантной защиты с диабетической полинейропатией у больных сахарным диабетом типа 1 // Молекулярная биология. 2004. № 2. С. 244–249.
4. Зотова Е.В., Чистяков Д.А., Савостьянов К.В. и др. Изучение ассоциации полиморфных маркеров Ala(-9) Val гена SOD2 и Arg213Gly гена SOD3 с диабетической полинейропатией у больных сахарным диабетом типа 1 // Молекулярная биология. 2003. № 3. С. 345–348.
5. Nikitin A.G., Chudakova D.A., Strokov I.A. et al. Leu54Phe and Val762Ala polymorphisms in the poly(ADP-ribose)polymerase-1 gene are associated with diabetic polyneuropathy in Russian type 1 diabetic patients // Diabetes Res. Clin. Pract. 2008. Vol. 79. № 3. P. 446–452.
6. Strokov I.A., Bursa T.R., Drepa O.I. et al. Predisposing genetic factors for diabetic polyneuropathy in patients with type 1 diabetes: a population-based case-control study // Acta Diabetol. 2003. Vol. 40. Suppl. 2. P. 375–379.
7. Albers J.W., Herman W.H., Pop-Busui R. et al. Effect of prior intensive insulin treatment during the DCCT on peripheral neuropathy in type 1 diabetes during the Epidemiology of Diabetes Interventions and Complications (EDIC) Study // Diabetes Care. 2010. Vol. 33. № 5. P. 1090–1096.
8. The DCCT Research Group. The effect of intensive diabetes therapy on the development and progression of neuropathy // Ann. Intern. Med. 1995. Vol. 122. № 8. P. 561–568.
9. Gaede P., Lund-Andersen H., Parving H.H. et al. Effect of a multifactorial intervention on mortality in type 2 diabetes // N. Engl. J. Med. 2008. Vol. 358. № 6. P. 580–591.
10. Duckworth W., Abraira C., Moritz T. et al. Glucose control and vascular complications in veterans with type 2 diabetes // N. Engl. J. Med. 2009. Vol. 360. № 2. P. 129–139.
11. Patel A., MacMahon S., Chalmers J. et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes // N. Engl. J. Med. 2008. Vol. 358. № 24. P. 2560–2572.
12. Ismail-Beigi F., Craven T., Banerji M.A. et al. Effect of intensive treatment of hyperglycaemia on microvascular outcomes in type 2 diabetes: an analysis of the ACCORD randomised trial // Lancet. 2010. Vol. 376. № 9739. P. 419–430.
13. Brownlee M. The pathobiology of diabetic complications: a unifying mechanism // Diabetes. 2005. Vol. 54. № 6. P. 1615–1625.
14. Строков И.А., Мельниченко Г.А., Альбекова Ж.С. и др. Распространенность и факторы риска развития диабетической полиневропатии у стационарных больных сахарным диабетом 1-го типа // Нервно-мышечные болезни. 2012. № 1. С. 25–31.
15. Dyck P.J., Kratz K.M., Karnes J.L. et al. The prevalence by staged severity of various types of diabetic neuropathy, retinopathy, and nephropathy in a population-based cohort: the Rochester Diabetic Neuropathy Study // Neurology. 1993. Vol. 43. № 4. P. 817–824.
16. Happich M., Breitscheidel L., Meisinger C. et al. Cross-sectional analysis of adult diabetes type 1 and type 2 patients with diabetic microvascular complications from a German retrospective observational study // Curr. Med. Res. Opin. 2007. Vol. 23. № 6. P. 1367–1374.
17. Shaw J.E., Zimmer P.Z., Greis F.A. et al. Epidemiology of diabetic neuropathy. New York: Thieme, 2003. P. 64–82.
18. Brownlee M. Biochemistry and molecular cell biology of diabetic complications // Nature. 2001. Vol. 414. № 6865. P. 813–820.
19. Ziegler D. Current concepts in the management of diabetic polyneuropathy // Curr. Diabetes Rev. 2011. Vol. 7. № 3. P. 208–220.
20. Аметов А.С., Строков И.А., Ziegler D. и др. Лечение диабетической полиневропатии тиоктовой кислотой (обзор литературы) // Фарматека. 2008. № 17. С. 28–35.
21. Ziegler D. Thioctic acid for patients with symptomatic diabetic polyneuropathy: a critical review // Treat. Endocrinol. 2004. Vol. 3. № 3. P. 173–189.
22. Ziegler D., Nowak H., Kempler P. et al. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha-lipoic acid: a meta-analysis // Diabet. Med. 2004. Vol. 21. № 2. P. 114–121.
23. Packer L., Witt E.H., Tritschler H.J. Alpha-Lipoic acid as a biological antioxidant // Free Radic. Biol. Med. 1995. Vol. 19. № 2. P. 227–250.
24. Borenshtein D., Ofri R., Werman M. et al. Cataract development in diabetic sand rats treated with alpha-lipoic acid and its gamma-linolenic acid conjugate // Diabetes Metab. Res. Rev. 2001. Vol. 17. P. 44–50.
25. Melhem M.F., Craven P.A., Liachenko J. et al. alpha-Lipoic acid attenuates hyperglycemia and prevents glomerular mesangial matrix expansion in diabetes // J. Am. Soc. Nephrol. 2002. Vol. 13. № 1. P. 108–116.
26. Nagamatsu M., Nickander K.K., Schmelzer J.D. et al. Lipoic acid improves nerve blood flow, reduces oxidative stress, and improves distal nerve conduction in experimental diabetic neuropathy // Diabetes Care. 1995. Vol. 18. № 8. P. 1160–1167.
27. Ramrath S., Tritschler H.J., Eckel J. Stimulation of cardiac glucose transport by thioctic acid and insulin // Horm. Metab. Res. 1999. Vol. 31. № 12. P. 632–635.
28. Stevens M.J., Obrosova I., Cao X. et al. Effects of DL-alpha-lipoic acid on peripheral nerve conduction, blood flow, energy metabolism, and oxidative stress in experimental diabetic neuropathy // Diabetes. 2000. Vol. 49. № 6. P. 1006–1015.
29. Золоев Г.К., Манухина Е.Б., Малышев И.Ю. и др. Состояние эндогенных протекторных систем у больных инсулинзависимым сахарным диабетом с полинейропатией: эффект антиоксидантной терапии // Бюллетень экспериментальной биологии и медицины. 2000. Т. 130. № 10. С. 437–441.
30. Borcea V., Nourooz-Zadeh J., Wolff S.P. et al. alpha-Lipoic acid decreases oxidative stress even in diabetic patients with poor glycemic control and albuminuria // Free Radic. Biol. Med. 1999. Vol. 26. № 11–12. P. 1495–1500.
31. Haak E.S., Usadel K.H., Kohleisen M. et al. The effect of alpha-lipoic acid on the neurovascular reflex arc in patients with diabetic neuropathy assessed by capillary microscopy // Microvasc. Res. 1999. Vol. 58. № 1. P. 28–34.
32. Hofmann M.A., Schiekofer S., Kanitz M. et al. Insufficient glycemic control increases nuclear factor-kappa B binding activity in peripheral blood mononuclear cells isolated from patients with type 1 diabetes // Diabetes Care. 1998. Vol. 21. № 8. P. 1310–1316.
33. Яхно Н.Н., Строков И.А., Новосадова М.В. и др. Клинические методы оценки тяжести диабетической полиневропатии // Неврологический журнал. 2000. № 5. С. 14–19.
34. Ziegler D., Reljanovic M., Mehnert H. et al. alpha-Lipoic acid in the treatment of diabetic polyneuropathy in Germany: current evidence from clinical trials // Exp. Clin. Endocrinol. Diabetes. 1999. Vol. 107. № 7. P. 421–430.
35. Ziegler D., Hanefeld M., Ruhnau K.J. et al. Treatment of symptomatic diabetic peripheral neuropathy with the anti-oxidant alpha-lipoic acid. A 3-week multicentre randomized controlled trial (ALADIN Study) // Diabetologia. 1995. Vol. 38. № 12. P. 1425–1433.
36. Аметов А.С., Строков И.А., Баринов А.Н. и др. Альфа-липоевая кислота в лечении симптомной диабетической полиневропатии: symptomatic diabetic neuropathy (SYDNEY) trial // Фарматека. 2004. № 11. С. 69–73.
37. Ametov A.S., Barinov A., Dyck P.J. et al. The sensory symptoms of diabetic polyneuropathy are improved with alpha-lipoic acid: the SYDNEY trial // Diabetes Care. 2003. Vol. 26. № 3. P. 770–776.
38. Strokov I.A., Novosadova M.V., Lavrova I.N. et al. The prolonged clinical effect of tioctic acid in symptomatic distal diabetic polyneuropathy. Abstr. of the 14th Annual Scientific Meeting of the DFSG and NEURODIAB, Regensburg, Germany, 2004. P. 195.
39. Jörg J., Metz F., Scharafinski H. Zur medikamentösen Behandlung der diabetischen polyneuropathie mit der α-liponsäure oder vitamin B-Praparaten // Nervenarzt. 1988. Vol. 59. № 1. P. 36–44.
40. Строков И.А., Строков К.И., Альбекова Ж.С. Тиамин и бенфотиамин в лечении поздних осложнений сахарного диабета // Доктор.Ру. 2009. № 6. Ч. 2. С. 14–18.
41. Ziegler D., Ametov A., Barinov A. et al. Oral treatment with alpha-lipoic acid improves symptomatic diabetic polyneuropathy: the SYDNEY 2 trial // Diabetes Care. 2006. Vol. 29. № 11. P. 2365–2370.
42. Ziegler D., Low P.A., Litchy W.J. et al. Efficacy and safety of antioxidant treatment with α-lipoic acid over 4 years in diabetic polyneuropathy: the NATHAN 1 trial // Diabetes Care. 2011. Vol. 34. № 9. P. 2054–2060.
43. Dyck P.J.B. Diabetic polyneuropathy. 2nd ed. Philadelphia: W.B. Saunders, 1999. P. 255–278.
44. Строков И.А., Фокина А.С. Тиолепта® уменьшает позитивную невропатическую симптоматику при диабетической полиневропатии – исследование «Этика» // Медицинский совет. 2012. № 4. С. 60–65.
45. Ziegler D., Movsesyan L., Mankovsky B. et al. Treatment of symptomatic polyneuropathy with actovegin in type 2 diabetic patients // Diabetes Care. 2009. Vol. 32. № 8. P. 1479–1484.
46. Dyck P.J., Thomas P.K. Diabetic neuropathy. 2nd ed. Philadelphia: W.B. Saunders, 1999. 720 p.
Efficacy of alpha-lipoic acid in patients with diabetic polyneuropathy
I.A. Strokov, V.A. Golovacheva,
State Budgetary Educational Institution for Higher Professional Education ‘I.M. Sechenov First Moscow State Medical University’
State Budgetary Educational Institution for Higher Professional Education ‘I.M. Sechenov First Moscow State Medical University’
Neurology Department
A.S. Fokina
State Budgetary Educational Institution for Higher Professional Education ‘I.M. Sechenov First Moscow State Medical University’
Endocrinology Department
Contact person: Igor Alekseyevich Strokov, strigoral@mail.ru
The authors reviewed efficacy studies of intravenous and oral alpha-lipoic acid in diabetic polyneuropathy. They concluded that pathogenetical therapy with alpha-lipoic acid reduced positive and negative symptoms of neuropathy. The results of own study ETIKA have demonstrated that long-term treatment with oral alpha-lipoic acid delays or prevents diabetic polyneuropathy progression. According to the results of post-hoc analysis of NISS-LL estimates 4-week therapy with alpha-lipoic acid (Thiolepta) tablets 600 mg daily produces the reduction of positive and negative symptoms of neuropathy with effect duration up to three months. Parenteral and oral alpha-lipoic acid preparations are recommended for treatment and prevention of neuropathy in diabetic patients.
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.