количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Фармакологическая терапия болевой диабетической полиневропатии
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Неврология и Психиатрия" №5 (47)
- Аннотация
- Статья
- Ссылки
- English
В статье обсуждаются методы лечения пациентов с болевым синдромом при диабетической полиневропатии (ДПН) с учетом патофизиологических механизмов ее развития. Существует два возможных подхода: патогенетическая терапия с целью улучшения функционального состояния периферических нервов и симптоматическое лечение, направленное на непосредственное устранение болевого синдрома.
Доказана эффективность применения альфа-липоевой кислоты, которая является мощным липофильным антиоксидантом и способна значительно уменьшить болевые ощущения при ДПН. Для симптоматического лечения ДПН используются антиконвульсанты, антидепрессанты и местные анестетики. Международные и европейские рекомендации по лечению невропатической боли относят антиконвульсант нового поколения габапентин к препаратам первой линии терапии болевых синдромов при ДПН. Подчеркивается необходимость назначения не только высокоэффективных и безопасных, но и доступных по цене лекарственных средств.
В статье обсуждаются методы лечения пациентов с болевым синдромом при диабетической полиневропатии (ДПН) с учетом патофизиологических механизмов ее развития. Существует два возможных подхода: патогенетическая терапия с целью улучшения функционального состояния периферических нервов и симптоматическое лечение, направленное на непосредственное устранение болевого синдрома.
Доказана эффективность применения альфа-липоевой кислоты, которая является мощным липофильным антиоксидантом и способна значительно уменьшить болевые ощущения при ДПН. Для симптоматического лечения ДПН используются антиконвульсанты, антидепрессанты и местные анестетики. Международные и европейские рекомендации по лечению невропатической боли относят антиконвульсант нового поколения габапентин к препаратам первой линии терапии болевых синдромов при ДПН. Подчеркивается необходимость назначения не только высокоэффективных и безопасных, но и доступных по цене лекарственных средств.

Рис. 1. Уменьшение стреляющей боли на фоне приема АЛК/плацебо (исследование SYDNEY)

Рис. 2. Метаанализ отдельных невропатических симптомов (различия между АЛК 600 мг/сут в/в и плацебо через 3 недели)
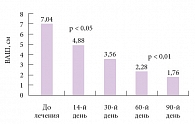
Рис. 3. Динамика боли по визуально-аналоговой шкале (ВАШ) при лечении Конвалисом пациентов с болевой диабетической полиневропатией
Невропатическая боль снижает качество жизни больных, их трудоспособность и социальную адаптацию. В основе невропатической боли лежит первичное повреждение или заболевание соматосенсорной системы [1–3]. Исследования, проведенные в Европе и США, показали, что невропатическая боль наблюдается у 6–8% населения [4, 5]. По данным российского исследования EPIC (Russian epidemiological study of Neuropathic Pain prevalence, conditions, underlying NeP and detailed pain characteristics among patients applying for medical care in outpatient neurology units), из 85 923 пациентов, обратившихся к врачам-неврологам, жалобы на боль предъявляли 33 664 больных (39%). По результатам тестирования с помощью опросника DN4 [6], невропатическая боль выявлена у 15 301 пациента (17,8%) [4]. Причиной формирования невропатической боли в исследовании EPIC в большинстве случаев (91,74%) были периферические невропатические боли. По частоте доминировали боли в спине (50,58%), а на втором месте располагался болевой синдром при диабетической полиневропатии (ДПН) (10,64%).
Болевой синдром при ДПН является «классическим» вариантом невропатической боли, поэтому все исследования новых препаратов, предлагаемых для лечения болей, связанных с поражением или заболеванием соматосенсорных проводников, в первую очередь проводятся при ДПН. Фармакологическое лечение болевого синдрома при ДПН базируется на современных представлениях о патофизиологических механизмах ее развития [7].
Число больных с сахарным диабетом (СД) стремительно растет и, по прогнозам, к 2035 г. превысит полмиллиарда человек во всем мире. В США в 2007 г. было 23,6 млн больных СД (7,8% популяции), точное число больных СД в России неизвестно. Много различных вариантов невропатий, сопровождающихся болевым синдромом, связано с СД – острые тонковолоконные полиневропатии (например, синдром Элленберга), тоннельные невропатии, торакоабдоминальная радикулопатия, диабетическая амиотрофия. Однако наиболее распространен болевой синдром при дистальной симметричной сенсорно-моторной полиневропатии. Это преимущественно аксональная полиневропатия, зависящая от длины нервов, что определяет дистальность распределения клинической симптоматики в виде снижения поверхностной чувствительности и, гораздо реже, поражения проприоцептивных и двигательных нервных волокон [8]. Распространение болевого синдрома у больных СД значительно варьирует в различных исследованиях и может составлять от 10% в популяции больных СД до 40% среди больных с подтвержденной ДПН [9]. Следует также учитывать, что полиневропатия с болевым синдромом может развиваться у больных с повышением тощаковой глюкозы и нарушением толерантности к глюкозе [10]. В России и США ДПН наблюдается более чем у 50% больных СД, причем болевой синдром отмечается у 25% больных с ДПН, а доминирует боль в клинической картине у 18% больных [11–13].
Болевой синдром при ДПН может проявляться ощущениями жжения, горения, удара электрическим током, болезненного ощущения холода, болевым покалыванием иголками, а также появлением боли при нанесении неболевого стимула – проведении по коже кисточкой или ватой (аллодиния). Болевой синдром возникает у больных с ДПН постепенно в течение нескольких месяцев (хроническая форма) или нескольких дней/недель (острая форма) и локализуется в дистальных отделах ног [14]. Длительность хронического болевого синдрома может составлять десятилетия.
Связь болевого синдрома с гипергликемией и гипоинсулинемией проверялась в многочисленных экспериментальных исследованиях у животных с СД 1 и 2 типа. Результаты этих исследований показывают, что не гипергликемия, а гипоинсулинемия играет основную роль в развитии болевого синдрома при наличии ДПН [15, 16].
В клинической практике диагностика невропатического характера боли часто бывает затруднена. Ощущение боли всегда субъективно, его нельзя точно измерить, и не существует абсолютных критериев, позволяющих выделить невропатическую боль. Судить о патофизиологических механизмах, лежащих в основе болевого синдрома, можно только ориентировочно, основываясь на характеристиках болевых ощущений, данных неврологического осмотра и результатах нейрофизиологического исследования. Причем выявление клинических признаков и изменений электрофизиологических показателей, свидетельствующих о патологическом изменении состояния ноцицептивной системы, достоверно не доказывает наличия невропатической боли. Невропатическая боль может возникать сразу после повреждения соматосенсорной системы, например, при острой невропатии тонких волокон, а может развиваться через годы и даже десятилетия после повреждения или появления болезни.
Диагностировать невропатический характер боли можно в случае подтверждения нарушения функции соматосенсорной системы при наличии:
Для лечения болевого синдрома при ДПН возможно использовать два подхода. Первый заключается в проведении патогенетического лечения ДПН с целью улучшения функционального состояния периферических нервов, что позволит уменьшить интенсивность болей или приведет к их исчезновению. Второй подход состоит в лечении самого болевого синдрома препаратами, блокирующими проведение импульсов по ноцицептивной системе. Для этого используют фармакологические воздействия, направленные на уменьшение периферической ноцицептивной афферентации, снижающие возбудимость ноцицептивных нейронов центральной нервной системы и усиливающие супраспинальные нисходящие тормозные антиноцицептивные влияния.
Патогенетическая терапия ДПН уменьшает сенсорные феномены, в том числе болевые, которые беспокоят больных, однако она относится к альтернативному фармакологическому лечению болевого синдрома у больных СД [17]. Препараты, уменьшающие оксидативный стресс, являющийся одной из основных причин развития ДПН, способны значительно уменьшить болевые ощущения у больных. Основным антиоксидантом, широко используемым для патогенетического лечения ДПН, является альфа-липоевая кислота (АЛК).
АЛК – естественный коэнзим митохондриального мультиэнзимного комплекса, катализирующего окислительное декарбоксилирование альфа-кетокислот, таких как пируват и альфа-кетоглюторат [19]. АЛК является мощным липофильным антиоксидантом, что определяет возможность ее терапевтического использования [18]. АЛК представляет собой рацемическую смесь R(+) и S(-) изомеров, плохо растворяющихся в воде и хорошо – в липофильных растворителях. Вводимая в организм АЛК восстанавливается в основном из R(+)-изоформы до дигидролипоевой кислоты, которая и обеспечивает основные терапевтические эффекты, в частности за счет действия в качестве «ловушки» основного свободного радикала – супероксида. В клинических исследованиях с применением АЛК у больных СД отмечено улучшение состояния системы микроциркуляции, уменьшение перекисного окисления липидов, нормализация содержания оксида азота и стресс-белков, улучшение эндотелийзависимых реакций сосудистой стенки, уменьшение активации фактора транскрипции NF-κB, улучшение фильтрационной функции почек и утилизации глюкозы [20–24].
Уже первое рандомизированное двойное слепое плацебоконтролируемое исследование эффективности внутривенного введения АЛК, выполненное с соблюдением требований доказательной медицины, – ALADIN (Alpha-Lipoic Acid in Diabetic Neuropathy) – показало способность АЛК достоверно снижать через 3 недели лечения интенсивность сенсорных феноменов ДПН, включая болевые ощущения [26]. Исследование ALADIN III подтвердило уменьшение позитивной невропатической симптоматики (неприятных ощущений) и продемонстрировало возможность уменьшения неврологического дефицита у больных СД 2 типа с ДПН при внутривенном введении АЛК [25]. Рандомизированное двойное слепое контролируемое исследование SYDNEY (Symptomatic Diabetic Neuropathy) проводилось в России с той же целью, что и исследование ALADIN [27, 28]. Были обследованы 120 больных СД 1 и 2 типов с симптомной ДПН, которые получали внутривенно АЛК в дозе 600 мг или плацебо (0,04 мг рибофлавина) в течение 3 недель. Была подтверждена достоверная эффективность АЛК при внутривенном введении в отношении всех сенсорных феноменов (стреляющая боль, жжение, парестезии, онемение) (рис. 1).
Проведенный метаанализ 4 исследований с внутривенным введением АЛК в дозе 600 мг в течение 14 дней позволил сравнить результаты, полученные при лечении 716 больных ДПН, с результатами 542 больных, получавших плацебо [29]. Выявлен достоверно лучший эффект АЛК в отношении всех сенсорных феноменов в сравнении с плацебо (p < 0,05). Снижение баллов по шкале TSS более чем на 50% было у 52,7% больных, получавших АЛК, и у 36,9% пациентов в группе плацебо (p < 0,05). Среди отдельных симптомов в наибольшей степени уменьшалось жжение (рис. 2). Метаанализ динамики неврологического дефицита проводился только для 3 исследований, так как в исследовании ALADIN его оценка не использовалась. Результаты метаанализа свидетельствуют, что при ДПН внутривенное введение АЛК в течение 3 недель (14 инфузий) безопасно и приводит к значительному улучшению в отношении болевых ощущений и онемения, а также неврологического дефицита.
В России зарегистрировано большое количество препаратов АЛК импортного и отечественного производства. Эффективность проводимой терапии определяется многими факторами, такими как дозировка препарата, длительность лечения, периодичность курсов, а также желанием больных соблюдать рекомендации врача. Высокая стоимость препаратов нередко снижает приверженность пациентов к лечению, что особенно актуально для препаратов, эффект от которых не ощущается мгновенно. Это относится и к препаратам АЛК, курс лечения которыми составляет 2–3 месяца. Октолипен® (ОАО «Фармстандарт», Россия) имеет 3 формы выпуска (таблетки 600 мг, капсулы 300 мг и концентрат для инфузий 300 мг/10 мл) и доступную стоимость, поэтому широко применяется в лечении пациентов с ДПН.
Помимо патогенетической терапии широко используется симптоматическое лечение невропатической боли при ДПН, направленное на непосредственное устранение болевого синдрома. Это связано с тем, что неприятные сенсорные ощущения, типичные для ДПН, в том числе болевые сенсорные феномены (стреляющая боль, жжение, болевые парестезии), уменьшаются при применении АЛК, как правило, через 2–3 недели лечения. Препаратами первой линии для симптоматического лечения невропатической боли при ДПН являются антиконвульсанты, антидепрессанты и местные анестетики [30, 31]. Нестероидные противовоспалительные средства (НПВС), действующие преимущественно на периферические альгогены воспаления, не рекомендованы для лечения невропатической боли при ДПН в связи с их неэффективностью [32].
Применение местных анестетиков при болевой ДПН ограничивается назначением лидокаина, обладающего ингибирующим действием на натриевые каналы. В последние годы появилась возможность использования лидокаина в виде накожного пластыря. Основным показанием для применения пластыря с лидокаином является аллодиния [33].
Антидепрессанты широко используются при лечении невропатической боли различной этиологии. Трициклические антидепрессанты (ТЦА), которые начали применяться с 1950-х гг., высокоэффективны при невропатической боли [34]. Основным механизмом действия ТЦА является блокирование обратного захвата норадреналина и серотонина в пресинаптическую терминаль за счет действия на натриевые и кальциевые каналы, что усиливает центральные антиноцицептивные влияния. Селективные блокаторы обратного захвата серотонина (пароксетин, флуоксетин) имеют меньше побочных эффектов, но их способность уменьшать невропатические боли существенно уступает ТЦА. Ограничения в использовании ТЦА при невропатической боли, особенно у пожилых пациентов, связаны с многочисленными и иногда тяжелыми побочными эффектами. Ортостатическая гипотония, задержка мочи, запоры, тахикардия, «сухой синдром» могут возникать не только у пожилых людей. Наличие глаукомы и аденомы предстательной железы является противопоказанием для назначения ТЦА. Кроме того, показано, что длительное применение ТЦА увеличивает в 2,2 раза риск развития инфаркта миокарда [35]. В последнее время активно разрабатываются так называемые сбалансированные ингибиторы обратного захвата норадреналина и серотонина, имеющие меньше побочных эффектов. Препарат этой группы дулоксетин используется для лечения невропатической боли при ДПН, однако он уступает амитриптилину в способности уменьшать невропатическую боль.
Антиконвульсанты стали применять для лечения болевых синдромов с 1940-х гг., когда была показана эффективность фенитоина при лечении тригеминальной невралгии. В 1962 г. для лечения невралгии тройничного нерва впервые был использован антиконвульсант карбамазепин, препарат, близкий по своей структуре к ТЦА, который до настоящего времени остается препаратом первой линии в лечении невралгии тройничного нерва. Основным механизмом действия фенитоина и карбамазепина является блокирование вольтажзависимых натриевых каналов, то есть они обладают периферическим механизмом действия.
В 1990-е гг. проведено изучение механизмов действия и клинической эффективности при невропатической боли нового поколения антиконвульсантов (габапентиноиды – габапентин и прегабалин). Габапентин близок по своей структуре к гамма-аминомасляной кислоте (ГАМК), однако доказано, что препарат не взаимодействует с рецепторами к ГАМК. Габапентин уменьшает сенситизацию центральных ноцицепторов, в основном за счет связывания с альфа-2-дельта- субъединицей потенциалзависимых кальциевых каналов мембраны ноцицептивных нейронов, что приводит к блокированию проведения через каналы ионов кальция и уменьшению возбудимости нейронов [36, 37]. Кроме того, габапентин обладает блокирующим действием на натриевые каналы и дополнительно оказывает стимулирующее влияние на синтез и выделение ГАМК. Побочных эффектов у габапентина немного, и, как показано при изучении 2216 пациентов, к основным относятся сонливость (15,2%), головокружение (10,9%) и атаксия (6,0%), однако тяжесть побочных эффектов незначительна, а их длительность не превышала 2–3 недель даже при продолжении приема препарата [38]. Габапентин не метаболизируется в печени и выводится в виде целой молекулы через почки, поэтому он не взаимодействует с другими препаратами, но должен с осторожностью использоваться у больных с нарушением функции почек. Детальное исследование, проведенное в клинике Мейо с участием 729 больных с поражением почек, получавших габапентин, показало, что токсичность габапентина (накопление избыточного содержания вещества в крови) обнаружена только у 5,6% пациентов с выраженным нарушением фильтрационной способности почек и у 77,8% пациентов, находившихся на диализе, причем клинически повышение дозы препарата проявлялось редко. Таким образом, препарат может назначаться больным с поражением почек, что важно при наличии СД, но при этом необходимо использовать меньшие дозы и по возможности контролировать его содержание в крови. Для уменьшения частоты и выраженности побочных эффектов дозу габапентина титруют.
Применение современных антиконвульсантов нередко ограничено их высокой стоимостью, особенно с учетом того, что препараты приобретаются пациентом за собственные средства. В настоящее время появился препарат габапентина отечественного производства (Конвалис), который выпускается ОАО «Фармстандарт». Прием габапентина (Конвалиса) начинают с дозы 300 мг в день (на ночь), затем дозу увеличивают до 600 мг (один прием днем и один прием вечером) и, наконец, дозу увеличивают до приема 300 мг 3 раза в день. На фоне приема 900 мг в день анализируют динамику болевого синдрома и при отсутствии эффекта дозу повышают до 1800 мг в день (увеличивая по 300 мг в день). Максимальные дозы габапентина в некоторых исследованиях, в которых получали высокую эффективность препарата при лечении невропатической боли, достигали 2700 или 3600 мг. При этом большинство исследователей отмечали уменьшение болевого синдрома при различных вариантах невропатической боли уже на первой неделе лечения габапентином.
В рандомизированном двойном слепом плацебоконтролируемом исследовании анализировали эффект лечения габапентином невропатической боли у пациентов с ДПН (n = 84) по сравнению с плацебо (n = 81) [39]. Исследование проводилось у амбулаторных больных в 20 различных медицинских центрах. Препарат или плацебо назначался больным в течение 8 недель. Титрование дозы габапентина осуществлялось в течение 4 недель (первая неделя – 900 мг/сут, вторая – 1800 мг/сут, третья – 2400 мг/сут и четвертая – 3600 мг/сут), причем ограничение дозы зависело только от побочных эффектов, но не от исчезновения боли. Интенсивность боли оценивалась по визуально-аналоговой шкале. Уже через 2 недели отмечено достоверное различие в интенсивности боли между группами, а через 8 дней в группе габапентина боль уменьшилась с 6,4 до 3,9 см, в то время как в группе плацебо – с 6,5 до 5,1 см (p < 0,001).
В другом двойном слепом плацебоконтролируемом исследовании по изучению эффективности габапентина при болевой ДПН использованы меньшие дозы препарата – 1200 мг, но в течение 3 месяцев. Из 17 пациентов с болевой формой ДПН боль значительно уменьшилась по интенсивности у 14 человек (82,4%), а при использовании плацебо – только у 2 из 15 пациентов (13,3%) (p < 0,001) [38].
В открытом исследовании эффективности препарата Конвалис (габапентин) у 25 больных СД 2 типа (возраст 25–70 лет) с болевой формой ДПН показано, что лечение препаратом в течение 3 месяцев (начальная доза – 300 мг, максимальная доза – 1800 мг) прогрессирующе уменьшало интенсивность болевого синдрома (рис. 3) [40]. Особо следует отметить выраженность снижения интенсивности боли по визуально-аналоговой шкале: с 7,04 ± 1,17 до 1,76 ± 0,52 cм. Авторы обращают внимание, что ни у одного больного побочные явления не послужили причиной отмены терапии. Продолжение лечения Конвалисом на втором месяце исследования привело к значительному снижению нежелательных явлений (головокружения – с 25 до 5%, сонливости – с 15 до 5%).
Анализ результатов исследования EPIC показал, что принципиально изменились назначения фармакологических препаратов пациентам с невропатической болью. Значительно увеличилось число больных, которым было назначено лечение препаратами первой линии в соответствии с европейскими и отечественными рекомендациями, и уменьшилось число больных, которым были рекомендованы анальгетики. Вместе с тем частота назначения НПВС уменьшилась очень незначительно. Можно было объяснить это тем, что в большинстве случаев невропатическая боль отмечалась при болях в спине, когда наряду с невропатической наблюдается ноцицептивная боль, обусловленная болевой афферентацией от суставов, связок, мышц и других структур скелетно-мышечной системы. Однако анализ назначения лекарственных средств при клинических формах, когда ноцицептивный компонент отсутствует, опроверг это предположение. Анальгетики и НПВС рекомендовались больным с диабетической полиневропатией, то есть в клинической ситуации, когда их назначение совершенно не оправдано. Остается признать, что традиционно назначавшиеся ранее фармакологические препараты по-прежнему остаются во врачебном арсенале при лечении невропатической боли, и требуются значительные усилия, в первую очередь направленные на повышение уровня знаний врачей, для преодоления этой ситуации.
Европейские и международные рекомендации по лечению невропатической боли подчеркивают факт высокой эффективности габапентина при лечении невропатических болевых синдромов и относят его к препаратам первой линии терапии при диабетической полиневропатии [41, 42].
Болевой синдром при ДПН является «классическим» вариантом невропатической боли, поэтому все исследования новых препаратов, предлагаемых для лечения болей, связанных с поражением или заболеванием соматосенсорных проводников, в первую очередь проводятся при ДПН. Фармакологическое лечение болевого синдрома при ДПН базируется на современных представлениях о патофизиологических механизмах ее развития [7].
Число больных с сахарным диабетом (СД) стремительно растет и, по прогнозам, к 2035 г. превысит полмиллиарда человек во всем мире. В США в 2007 г. было 23,6 млн больных СД (7,8% популяции), точное число больных СД в России неизвестно. Много различных вариантов невропатий, сопровождающихся болевым синдромом, связано с СД – острые тонковолоконные полиневропатии (например, синдром Элленберга), тоннельные невропатии, торакоабдоминальная радикулопатия, диабетическая амиотрофия. Однако наиболее распространен болевой синдром при дистальной симметричной сенсорно-моторной полиневропатии. Это преимущественно аксональная полиневропатия, зависящая от длины нервов, что определяет дистальность распределения клинической симптоматики в виде снижения поверхностной чувствительности и, гораздо реже, поражения проприоцептивных и двигательных нервных волокон [8]. Распространение болевого синдрома у больных СД значительно варьирует в различных исследованиях и может составлять от 10% в популяции больных СД до 40% среди больных с подтвержденной ДПН [9]. Следует также учитывать, что полиневропатия с болевым синдромом может развиваться у больных с повышением тощаковой глюкозы и нарушением толерантности к глюкозе [10]. В России и США ДПН наблюдается более чем у 50% больных СД, причем болевой синдром отмечается у 25% больных с ДПН, а доминирует боль в клинической картине у 18% больных [11–13].
Болевой синдром при ДПН может проявляться ощущениями жжения, горения, удара электрическим током, болезненного ощущения холода, болевым покалыванием иголками, а также появлением боли при нанесении неболевого стимула – проведении по коже кисточкой или ватой (аллодиния). Болевой синдром возникает у больных с ДПН постепенно в течение нескольких месяцев (хроническая форма) или нескольких дней/недель (острая форма) и локализуется в дистальных отделах ног [14]. Длительность хронического болевого синдрома может составлять десятилетия.
Связь болевого синдрома с гипергликемией и гипоинсулинемией проверялась в многочисленных экспериментальных исследованиях у животных с СД 1 и 2 типа. Результаты этих исследований показывают, что не гипергликемия, а гипоинсулинемия играет основную роль в развитии болевого синдрома при наличии ДПН [15, 16].
В клинической практике диагностика невропатического характера боли часто бывает затруднена. Ощущение боли всегда субъективно, его нельзя точно измерить, и не существует абсолютных критериев, позволяющих выделить невропатическую боль. Судить о патофизиологических механизмах, лежащих в основе болевого синдрома, можно только ориентировочно, основываясь на характеристиках болевых ощущений, данных неврологического осмотра и результатах нейрофизиологического исследования. Причем выявление клинических признаков и изменений электрофизиологических показателей, свидетельствующих о патологическом изменении состояния ноцицептивной системы, достоверно не доказывает наличия невропатической боли. Невропатическая боль может возникать сразу после повреждения соматосенсорной системы, например, при острой невропатии тонких волокон, а может развиваться через годы и даже десятилетия после повреждения или появления болезни.
Диагностировать невропатический характер боли можно в случае подтверждения нарушения функции соматосенсорной системы при наличии:
- спонтанных болевых сенсорных симптомов;
- результатов клинического осмотра с выявлением симптомов поражения нервной системы: позитивная невропатическая симптоматика (стимулозависимая боль) и негативная невропатическая симптоматика (неврологический дефицит);
- данных нейрофизиологических исследований (электромиография, количественное сенсорное тестирование, вызванные соматосенсорные потенциалы).
Для лечения болевого синдрома при ДПН возможно использовать два подхода. Первый заключается в проведении патогенетического лечения ДПН с целью улучшения функционального состояния периферических нервов, что позволит уменьшить интенсивность болей или приведет к их исчезновению. Второй подход состоит в лечении самого болевого синдрома препаратами, блокирующими проведение импульсов по ноцицептивной системе. Для этого используют фармакологические воздействия, направленные на уменьшение периферической ноцицептивной афферентации, снижающие возбудимость ноцицептивных нейронов центральной нервной системы и усиливающие супраспинальные нисходящие тормозные антиноцицептивные влияния.
Патогенетическая терапия ДПН уменьшает сенсорные феномены, в том числе болевые, которые беспокоят больных, однако она относится к альтернативному фармакологическому лечению болевого синдрома у больных СД [17]. Препараты, уменьшающие оксидативный стресс, являющийся одной из основных причин развития ДПН, способны значительно уменьшить болевые ощущения у больных. Основным антиоксидантом, широко используемым для патогенетического лечения ДПН, является альфа-липоевая кислота (АЛК).
АЛК – естественный коэнзим митохондриального мультиэнзимного комплекса, катализирующего окислительное декарбоксилирование альфа-кетокислот, таких как пируват и альфа-кетоглюторат [19]. АЛК является мощным липофильным антиоксидантом, что определяет возможность ее терапевтического использования [18]. АЛК представляет собой рацемическую смесь R(+) и S(-) изомеров, плохо растворяющихся в воде и хорошо – в липофильных растворителях. Вводимая в организм АЛК восстанавливается в основном из R(+)-изоформы до дигидролипоевой кислоты, которая и обеспечивает основные терапевтические эффекты, в частности за счет действия в качестве «ловушки» основного свободного радикала – супероксида. В клинических исследованиях с применением АЛК у больных СД отмечено улучшение состояния системы микроциркуляции, уменьшение перекисного окисления липидов, нормализация содержания оксида азота и стресс-белков, улучшение эндотелийзависимых реакций сосудистой стенки, уменьшение активации фактора транскрипции NF-κB, улучшение фильтрационной функции почек и утилизации глюкозы [20–24].
Уже первое рандомизированное двойное слепое плацебоконтролируемое исследование эффективности внутривенного введения АЛК, выполненное с соблюдением требований доказательной медицины, – ALADIN (Alpha-Lipoic Acid in Diabetic Neuropathy) – показало способность АЛК достоверно снижать через 3 недели лечения интенсивность сенсорных феноменов ДПН, включая болевые ощущения [26]. Исследование ALADIN III подтвердило уменьшение позитивной невропатической симптоматики (неприятных ощущений) и продемонстрировало возможность уменьшения неврологического дефицита у больных СД 2 типа с ДПН при внутривенном введении АЛК [25]. Рандомизированное двойное слепое контролируемое исследование SYDNEY (Symptomatic Diabetic Neuropathy) проводилось в России с той же целью, что и исследование ALADIN [27, 28]. Были обследованы 120 больных СД 1 и 2 типов с симптомной ДПН, которые получали внутривенно АЛК в дозе 600 мг или плацебо (0,04 мг рибофлавина) в течение 3 недель. Была подтверждена достоверная эффективность АЛК при внутривенном введении в отношении всех сенсорных феноменов (стреляющая боль, жжение, парестезии, онемение) (рис. 1).
Проведенный метаанализ 4 исследований с внутривенным введением АЛК в дозе 600 мг в течение 14 дней позволил сравнить результаты, полученные при лечении 716 больных ДПН, с результатами 542 больных, получавших плацебо [29]. Выявлен достоверно лучший эффект АЛК в отношении всех сенсорных феноменов в сравнении с плацебо (p < 0,05). Снижение баллов по шкале TSS более чем на 50% было у 52,7% больных, получавших АЛК, и у 36,9% пациентов в группе плацебо (p < 0,05). Среди отдельных симптомов в наибольшей степени уменьшалось жжение (рис. 2). Метаанализ динамики неврологического дефицита проводился только для 3 исследований, так как в исследовании ALADIN его оценка не использовалась. Результаты метаанализа свидетельствуют, что при ДПН внутривенное введение АЛК в течение 3 недель (14 инфузий) безопасно и приводит к значительному улучшению в отношении болевых ощущений и онемения, а также неврологического дефицита.
В России зарегистрировано большое количество препаратов АЛК импортного и отечественного производства. Эффективность проводимой терапии определяется многими факторами, такими как дозировка препарата, длительность лечения, периодичность курсов, а также желанием больных соблюдать рекомендации врача. Высокая стоимость препаратов нередко снижает приверженность пациентов к лечению, что особенно актуально для препаратов, эффект от которых не ощущается мгновенно. Это относится и к препаратам АЛК, курс лечения которыми составляет 2–3 месяца. Октолипен® (ОАО «Фармстандарт», Россия) имеет 3 формы выпуска (таблетки 600 мг, капсулы 300 мг и концентрат для инфузий 300 мг/10 мл) и доступную стоимость, поэтому широко применяется в лечении пациентов с ДПН.
Помимо патогенетической терапии широко используется симптоматическое лечение невропатической боли при ДПН, направленное на непосредственное устранение болевого синдрома. Это связано с тем, что неприятные сенсорные ощущения, типичные для ДПН, в том числе болевые сенсорные феномены (стреляющая боль, жжение, болевые парестезии), уменьшаются при применении АЛК, как правило, через 2–3 недели лечения. Препаратами первой линии для симптоматического лечения невропатической боли при ДПН являются антиконвульсанты, антидепрессанты и местные анестетики [30, 31]. Нестероидные противовоспалительные средства (НПВС), действующие преимущественно на периферические альгогены воспаления, не рекомендованы для лечения невропатической боли при ДПН в связи с их неэффективностью [32].
Применение местных анестетиков при болевой ДПН ограничивается назначением лидокаина, обладающего ингибирующим действием на натриевые каналы. В последние годы появилась возможность использования лидокаина в виде накожного пластыря. Основным показанием для применения пластыря с лидокаином является аллодиния [33].
Антидепрессанты широко используются при лечении невропатической боли различной этиологии. Трициклические антидепрессанты (ТЦА), которые начали применяться с 1950-х гг., высокоэффективны при невропатической боли [34]. Основным механизмом действия ТЦА является блокирование обратного захвата норадреналина и серотонина в пресинаптическую терминаль за счет действия на натриевые и кальциевые каналы, что усиливает центральные антиноцицептивные влияния. Селективные блокаторы обратного захвата серотонина (пароксетин, флуоксетин) имеют меньше побочных эффектов, но их способность уменьшать невропатические боли существенно уступает ТЦА. Ограничения в использовании ТЦА при невропатической боли, особенно у пожилых пациентов, связаны с многочисленными и иногда тяжелыми побочными эффектами. Ортостатическая гипотония, задержка мочи, запоры, тахикардия, «сухой синдром» могут возникать не только у пожилых людей. Наличие глаукомы и аденомы предстательной железы является противопоказанием для назначения ТЦА. Кроме того, показано, что длительное применение ТЦА увеличивает в 2,2 раза риск развития инфаркта миокарда [35]. В последнее время активно разрабатываются так называемые сбалансированные ингибиторы обратного захвата норадреналина и серотонина, имеющие меньше побочных эффектов. Препарат этой группы дулоксетин используется для лечения невропатической боли при ДПН, однако он уступает амитриптилину в способности уменьшать невропатическую боль.
Антиконвульсанты стали применять для лечения болевых синдромов с 1940-х гг., когда была показана эффективность фенитоина при лечении тригеминальной невралгии. В 1962 г. для лечения невралгии тройничного нерва впервые был использован антиконвульсант карбамазепин, препарат, близкий по своей структуре к ТЦА, который до настоящего времени остается препаратом первой линии в лечении невралгии тройничного нерва. Основным механизмом действия фенитоина и карбамазепина является блокирование вольтажзависимых натриевых каналов, то есть они обладают периферическим механизмом действия.
В 1990-е гг. проведено изучение механизмов действия и клинической эффективности при невропатической боли нового поколения антиконвульсантов (габапентиноиды – габапентин и прегабалин). Габапентин близок по своей структуре к гамма-аминомасляной кислоте (ГАМК), однако доказано, что препарат не взаимодействует с рецепторами к ГАМК. Габапентин уменьшает сенситизацию центральных ноцицепторов, в основном за счет связывания с альфа-2-дельта- субъединицей потенциалзависимых кальциевых каналов мембраны ноцицептивных нейронов, что приводит к блокированию проведения через каналы ионов кальция и уменьшению возбудимости нейронов [36, 37]. Кроме того, габапентин обладает блокирующим действием на натриевые каналы и дополнительно оказывает стимулирующее влияние на синтез и выделение ГАМК. Побочных эффектов у габапентина немного, и, как показано при изучении 2216 пациентов, к основным относятся сонливость (15,2%), головокружение (10,9%) и атаксия (6,0%), однако тяжесть побочных эффектов незначительна, а их длительность не превышала 2–3 недель даже при продолжении приема препарата [38]. Габапентин не метаболизируется в печени и выводится в виде целой молекулы через почки, поэтому он не взаимодействует с другими препаратами, но должен с осторожностью использоваться у больных с нарушением функции почек. Детальное исследование, проведенное в клинике Мейо с участием 729 больных с поражением почек, получавших габапентин, показало, что токсичность габапентина (накопление избыточного содержания вещества в крови) обнаружена только у 5,6% пациентов с выраженным нарушением фильтрационной способности почек и у 77,8% пациентов, находившихся на диализе, причем клинически повышение дозы препарата проявлялось редко. Таким образом, препарат может назначаться больным с поражением почек, что важно при наличии СД, но при этом необходимо использовать меньшие дозы и по возможности контролировать его содержание в крови. Для уменьшения частоты и выраженности побочных эффектов дозу габапентина титруют.
Применение современных антиконвульсантов нередко ограничено их высокой стоимостью, особенно с учетом того, что препараты приобретаются пациентом за собственные средства. В настоящее время появился препарат габапентина отечественного производства (Конвалис), который выпускается ОАО «Фармстандарт». Прием габапентина (Конвалиса) начинают с дозы 300 мг в день (на ночь), затем дозу увеличивают до 600 мг (один прием днем и один прием вечером) и, наконец, дозу увеличивают до приема 300 мг 3 раза в день. На фоне приема 900 мг в день анализируют динамику болевого синдрома и при отсутствии эффекта дозу повышают до 1800 мг в день (увеличивая по 300 мг в день). Максимальные дозы габапентина в некоторых исследованиях, в которых получали высокую эффективность препарата при лечении невропатической боли, достигали 2700 или 3600 мг. При этом большинство исследователей отмечали уменьшение болевого синдрома при различных вариантах невропатической боли уже на первой неделе лечения габапентином.
В рандомизированном двойном слепом плацебоконтролируемом исследовании анализировали эффект лечения габапентином невропатической боли у пациентов с ДПН (n = 84) по сравнению с плацебо (n = 81) [39]. Исследование проводилось у амбулаторных больных в 20 различных медицинских центрах. Препарат или плацебо назначался больным в течение 8 недель. Титрование дозы габапентина осуществлялось в течение 4 недель (первая неделя – 900 мг/сут, вторая – 1800 мг/сут, третья – 2400 мг/сут и четвертая – 3600 мг/сут), причем ограничение дозы зависело только от побочных эффектов, но не от исчезновения боли. Интенсивность боли оценивалась по визуально-аналоговой шкале. Уже через 2 недели отмечено достоверное различие в интенсивности боли между группами, а через 8 дней в группе габапентина боль уменьшилась с 6,4 до 3,9 см, в то время как в группе плацебо – с 6,5 до 5,1 см (p < 0,001).
В другом двойном слепом плацебоконтролируемом исследовании по изучению эффективности габапентина при болевой ДПН использованы меньшие дозы препарата – 1200 мг, но в течение 3 месяцев. Из 17 пациентов с болевой формой ДПН боль значительно уменьшилась по интенсивности у 14 человек (82,4%), а при использовании плацебо – только у 2 из 15 пациентов (13,3%) (p < 0,001) [38].
В открытом исследовании эффективности препарата Конвалис (габапентин) у 25 больных СД 2 типа (возраст 25–70 лет) с болевой формой ДПН показано, что лечение препаратом в течение 3 месяцев (начальная доза – 300 мг, максимальная доза – 1800 мг) прогрессирующе уменьшало интенсивность болевого синдрома (рис. 3) [40]. Особо следует отметить выраженность снижения интенсивности боли по визуально-аналоговой шкале: с 7,04 ± 1,17 до 1,76 ± 0,52 cм. Авторы обращают внимание, что ни у одного больного побочные явления не послужили причиной отмены терапии. Продолжение лечения Конвалисом на втором месяце исследования привело к значительному снижению нежелательных явлений (головокружения – с 25 до 5%, сонливости – с 15 до 5%).
Анализ результатов исследования EPIC показал, что принципиально изменились назначения фармакологических препаратов пациентам с невропатической болью. Значительно увеличилось число больных, которым было назначено лечение препаратами первой линии в соответствии с европейскими и отечественными рекомендациями, и уменьшилось число больных, которым были рекомендованы анальгетики. Вместе с тем частота назначения НПВС уменьшилась очень незначительно. Можно было объяснить это тем, что в большинстве случаев невропатическая боль отмечалась при болях в спине, когда наряду с невропатической наблюдается ноцицептивная боль, обусловленная болевой афферентацией от суставов, связок, мышц и других структур скелетно-мышечной системы. Однако анализ назначения лекарственных средств при клинических формах, когда ноцицептивный компонент отсутствует, опроверг это предположение. Анальгетики и НПВС рекомендовались больным с диабетической полиневропатией, то есть в клинической ситуации, когда их назначение совершенно не оправдано. Остается признать, что традиционно назначавшиеся ранее фармакологические препараты по-прежнему остаются во врачебном арсенале при лечении невропатической боли, и требуются значительные усилия, в первую очередь направленные на повышение уровня знаний врачей, для преодоления этой ситуации.
Европейские и международные рекомендации по лечению невропатической боли подчеркивают факт высокой эффективности габапентина при лечении невропатических болевых синдромов и относят его к препаратам первой линии терапии при диабетической полиневропатии [41, 42].
1. Боль. Руководство для студентов и врачей / под ред. Н.Н. Яхно. М.: МЕДпресс-информ, 2009. 304 с.
2. Данилов А.Б., Давыдов О.С. Нейропатическая боль. М.: Боргес, 2007. 135 с.
3. Bond M.R., Simpson K.H. Pain. Its nature and treatment. London: Churchill Livingstone, 2006. 291 p.
4. Яхно Н.Н., Кукушкин М.Л., Давыдов О.С. и др. Результаты российского эпидемиологического исследования распространенности невропатической боли, ее причин и характеристик в популяции амбулаторных больных, обратившихся к врачу-неврологу // Боль. 2008. № 3. С. 24–32.
5. Torrance N., Smith B.H., Bennett M.I. et al. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey // J. Pain. 2006. Vol. 17. P. 281–289.
6. Bouhassira D., Attal N., Alchaar H. et al. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4) // Pain. 2005. Vol. 114. № 1–2. P. 29–36.
7. Dworkin R.H., O'Connor A.B., Backonja M. et al. Pharmacologic management of neuropathic pain: evidence-based recommendations // Pain. 2007. Vol. 132. № 3. P. 237–251.
8. Boulton A.J., Vinik A.I., Arezzo J.C. et al. Diabetic neuropathies: a statement by the American Diabetes Association // Diabetes Care. 2005. Vol. 28. № 4. P. 956–962.
9. Galer B.S., Gianas A., Jensen M.P. Painful diabetic polyneuropathy: epidemiology, pain description, and quality of life // Diabetes Res. Clin. Pract. 2000. Vol. 47. № 2. P. 123–128.
10. Ziegler D., Rathmann W., Dickhaus T. et al. Neuropathic pain in diabetes, prediabetes and normal glucose tolerance: the MONICA/KORA Augsburg Survey // Pain Med. 2009. Vol. 10. № 2. P. 393–340.
11. Аметов А.С., Строков И.А. Диабетическая полиневропатия: настоящее и будущее // Российские медицинские вести. 2001. № 1. С. 35–40.
12. Chan A.W., MacFarlane L., Bowsher D.R. et al. Chronic pain in patients with diabetes mellitus: comparision with non-diabetic population // Pain Clinic. 1990. Vol. 3. P. 147–159.
13. Mayne N. Neuropathy in diabetic and non-diabetic populations // Lancet. 1965. Vol. 2. № 7426. P. 1313–1316.
14. Яхно Н.Н., Дубанова Е.А., Торопина Г.Г. и др. Клинические проявления болевого синдрома при дистальной диабетической полиневропатии // Боль. 2003. № 1. С. 21–25.
15. Romanovsky D., Cruz N.F., Dienel G.A. et al. Mechanical hyperalgesia correlates with insulin deficiency in normoglycemic streptozotocin-treated rats // Neurobiol. Dis. 2006. Vol. 24. № 2. P. 384–394.
16. Hoybergs Y.M., Meert T.F. The effect of low-dose insulin on mechanical sensitivity and allodinia in type I diabetes neuropathy // Neurosci. Lett. 2007. Vol. 417. № 2. P. 149–154.
17. Neuropathic pain / Ed. by D.M. Simpson, J.C. McArthur, R.H. Dworkin. Oxford: Oxford university press, 2012. 529 p.
18. Packer L., Witt E.H., Tritschler H.J. Alfa-lipoic acid as a biological antioxidant // Free Radic. Biol. Med. 1995. Vol. 19. № 2. P. 227–250.
19. Reed L.J. Multienzyme complex // Acc. Chem. Res. 1974. Vol. 7. P. 40–46.
20. Строков И.А., Манухина Е.Б., Бахтина Л.Ю. и др. Состояние эндогенных протекторных систем у больных инсулинзависимым сахарным диабетом с полинейропатией: эффект антиоксидантной терапии // Бюллетень экспериментальной биологии и медицины. 2000. Т. 130. № 10. С. 437–441.
21. Borcea V., Nourooz-Zadeh J., Wolff S.P. et al. Alpha-lipoic acid decreases oxidative stress in patients with diabetes mellitus // Free Radic. Biol. Med. 1999. Vol. 22. P. 1495–1500.
22. Haak E.S., Usadel K.H., Kohleisen M. et al. The effect of alpha-lipoic acid on the neurovascular reflex arc in patients with diabetic neuropathy assessed by capillary microscopy // Microvasc. Res. 1999. Vol. 58. P. 28–34.
23. Hofmann M.A., Schiekofer S., Kanitz M. et al. Insufficient glycemic control increases nuclear factor-kappa B binding activity in peripheral blood mononuclear cells isolated from patients with type I diabetes // Diabetes Care. 1998. Vol. 21. № 8. P. 1310–1316.
24. Sola S., Mir M.Q., Cheema F.A. et al. Irbesartan and lipoic acid improve endothelial function and reduce markers of inflammation in the metabolic syndrome: results of the Irbesartan and Lipoic Acid in Endothelial Dysfunction (ISLAND) study // Circulation. 2005. Vol. 111. № 3. P. 343–348.
25. Ziegler D., Reljanovic M., Mehnert H. et al. Alpha-lipoic acid in the treatment of diabetic polyneuropathy in Germany: current evidence from clinical trials // Exp. Clin. Endocrinol. Diabetes. 1999. Vol. 107. № 7. P. 421–430.
26. Ziegler D., Hanefeld M., Ruhnau K.J. et al. Treatment of symptomatic diabetic peripheral neuropathy with the antioxidant alpha-lipoic acid. A 3-week multicentre randomized controlled trial (ALADIN Study) // Diabetologia. 1995. Vol. 38. № 12. P. 1425–1433.
27. Аметов А.С., Лаврова И.Н., Строков И.А. и др. Альфа-липоевая кислота в лечении симптомной диабетической полиневропатии: symptomatic diabetic neuropathy (SYDNEY) trial // Фарматека. 2004. Т. 11. № 88. С. 69–73.
28. Ametov A.S., Barinov A., Dyck P.J. et al. The sensory symptoms of diabetic polyneuropathy are improved with alpha-lipoic acid // Diabetes Care. 2003. Vol. 26. № 3. P. 770–776.
29. Ziegler D., Nowak H., Kempler P. et al. Treatment of symptomatic diabetic polyneuropathy with antioxidant alpha-lipoic acid: a meta-analysis // Diabet. Med. 2004. Vol. 21. № 2. P. 114–121.
30. Методические рекомендации по диагностике и лечению невропатической боли / под ред. Н.Н. Яхно. М.: Изд-во РАМН, 2008. 32 с.
31. Attal N., Cruccu G., Haampää M. et al. EFNS guidelines on pharmacological treatment of neuropathic pain // Eur. J. Neurol. 2006. Vol. 13. № 11. P. 1153–1169.
32. Kingery W.S. A critical review of controlled clinical trials for peripheral neuropathic pain and complex regional pain syndromes // Pain. 1997. Vol. 73. № 2. P. 123–139.
33. Barbano R.L., Herrmann D.N., Hart-Gouleau S. et al. Effectiveness, tolerability, and impact on quality of life of the 5% lidocaine patch in diabetic polyneuropathy // Arch. Neurol. 2004. Vol. 61. № 6. P. 914–918.
34. Jann M.W., Slade J.H. Antidepressant agents for the treatment of chronic pain and depression // Pharmacotherapy. 2007. Vol. 27. № 11. P. 1571–1587.
35. Cohen H.W., Gibson G., Alderman M.H. Excess risk of myocardial infarction in patients treated with antidepressant medication: association with use of tricyclic agents // Am. J. Med. 2000. Vol. 108. № 1. P. 2–8.
36. Borouierdi A., Zeng J., Sharp K. et al. Calcium channel alpha-2-delta-1 protein upregulation in dorsal spinal cord mediates spinal cord injury-induced neuropathic pain states // Pain. 2011. Vol. 152. № 3. P. 649–655.
37. Takemura Y., Yamashita A., Horiuchi H. et al. Effect of gabapentin on brain hyperactivity related to pain and sleep disturbance under a neuropathic pain-like state using fMRI and brain wave analysis // Synapse. 2011. Vol. 65. № 7. P. 668–676.
38. Perez H.E., Sanchez G.F. Gabapentin therapy for diabetic neuropathic pain // Am. J. Med. 2000. Vol. 108. № 8. P. 689–693.
39. Backonja M., Beydoun A., Edvards K.R. et al. Gabapentin for the symptomatic treatment of painful neuropathy in patients with diabetes mellitus: a randomized controlled trial // JAMA. 1998. Vol. 280. № 21. P. 1831–1836.
40. Данилов А.Б., Жаркова Т.Р. Фармакотерапия габапентином болевого синдрома при диабетической полиневропатии // Consilium medicum. 2009. № 2. С. 3–6.
41. Attal N., Cruccu G., Baron R. et al. EFNS guidelines on the pharmacological treatment of neuropathic pain: 2010 revision // Eur. J. Neurol. 2010. Vol. 17. № 9. P. 1113–1188.
42. Dworkin R.H., O’Connor A.B., Audette J. et al. Recommendations for the pharmacological management of neuropathic pain: an overview and literature update // Mayo Clin. Proc. 2010. Vol. 85. № 3. Suppl. P. 3–14.
Pharmacological therapy of painful diabetic polyneuropathy
I.A. Strokov, I.M. Sechenov First Moscow State Medical University, Department of Nervous Diseases
I.A. Strokov, I.M. Sechenov First Moscow State Medical University, Department of Nervous Diseases
A.S. Fokina, I.M. Sechenov First Moscow State Medical University, Department of Endocrinology
O.O. Drokonova, I.M. Sechenov First Moscow State Medical University, Department of Nervous Diseases
Contact person: Igor Alekseyevich Strokov, strigoral@mail.ru
Therapeutic approaches used for treatment of patients having diabetic polyneuropathy (DPN) with pain syndrome based on pathophysiological mechanisms of its development are discussed. There are two possible options: pathogenetic therapy aimed at improving functional state of peripheral nerves, and symptomatic therapy focused on direct eradication of painful syndrome. It was proved that alpha-lipoic acid as a powerful lipophilic antioxidant was effective in substantially ameliorating pain sensations under DPN. Anticonvulsants, antidepressants and topical anesthetics, were used to carry out symptomatic therapy. According to the international and European recommendations for treatment of neuropathic pain symptoms a new generation anticonvulsant gabapentin is considered as a first-line drug used in therapy of pain syndromes associated with DPN. It is specially emphasized a need to use both highly effective and safe as well as affordable medicinal products.
Key words: diabetic polyneuropathy, pain syndrome, antioxidant therapy, alpha-lipoic acid, analgetics, anticonvulsants, antidepressants, gabapentin
Contact person: Igor Alekseyevich Strokov, strigoral@mail.ru
Therapeutic approaches used for treatment of patients having diabetic polyneuropathy (DPN) with pain syndrome based on pathophysiological mechanisms of its development are discussed. There are two possible options: pathogenetic therapy aimed at improving functional state of peripheral nerves, and symptomatic therapy focused on direct eradication of painful syndrome. It was proved that alpha-lipoic acid as a powerful lipophilic antioxidant was effective in substantially ameliorating pain sensations under DPN. Anticonvulsants, antidepressants and topical anesthetics, were used to carry out symptomatic therapy. According to the international and European recommendations for treatment of neuropathic pain symptoms a new generation anticonvulsant gabapentin is considered as a first-line drug used in therapy of pain syndromes associated with DPN. It is specially emphasized a need to use both highly effective and safe as well as affordable medicinal products.
Key words: diabetic polyneuropathy, pain syndrome, antioxidant therapy, alpha-lipoic acid, analgetics, anticonvulsants, antidepressants, gabapentin
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
В статье обсуждаются методы лечения пациентов с болевым синдромом при диабетической полиневропатии (ДПН) с учетом патофизиологических механизмов ее развития. Существует два возможных подхода: патогенетическая терапия с целью улучшения функционального состояния периферических нервов и симптоматическое лечение, направленное на непосредственное устранение болевого синдрома.
Доказана эффективность применения альфа-липоевой кислоты, которая является мощным липофильным антиоксидантом и способна значительно уменьшить болевые ощущения при ДПН. Для симптоматического лечения ДПН используются антиконвульсанты, антидепрессанты и местные анестетики. Международные и европейские рекомендации по лечению невропатической боли относят антиконвульсант нового поколения габапентин к препаратам первой линии терапии болевых синдромов при ДПН. Подчеркивается необходимость назначения не только высокоэффективных и безопасных, но и доступных по цене лекарственных средств.
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
