количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Нарушение равновесия у больных сахарным диабетом
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №4 (35)
- Аннотация
- Статья
- Ссылки
- English
У 85 больных в возрасте 46–64 лет с сахарным диабетом (СД) 1 и 2 типа проведено исследование по изучению состояния равновесия. Показано, что важным независимым фактором риска нарушения равновесия у больных СД является наличие диабетической полинейропатии (ДПН), особенно с поражением толстых нервных волокон. К значимым факторам риска развития нарушений равновесия у больных СД отнесен вестибулярный синдром. У пациентов с СД и ДПН проведен комплекс мероприятий медицинской реабилитации. Трехмесячный курс применения Актовегина в сочетании с лечебной физкультурой способствовал коррекции нарушений равновесия и ДПН, что выразилось в статистически значимом снижении общего счета симптомов полинейропатии, снижении суммарной латенции автоматических постуральных двигательных реакций в тесте моторного контроля, двукратном уменьшении количества пациентов с жалобами на нарушение равновесия, улучшении качества жизни, уменьшении количества баллов по шкале оценки функции толстых нервных волокон и шкале оценки функции тонких нервных волокон.
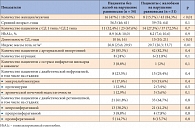
Таблица 1. Клиническая характеристика пациентов
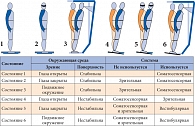
Рисунок. Тест сенсорной организации
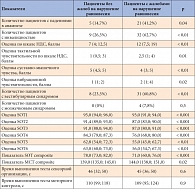
Таблица 2. Результаты динамической постурографии
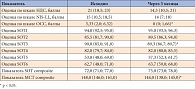
Таблица 3. Динамика клинических и инструментальных показателей через 3 месяца в группе применения Актовегина и лечебной физкультуры
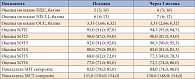
Таблица 4. Динамика клинических и инструментальных показателей через 3 месяца в контрольной группе
Известно, что частой причиной падения больных сахарным диабетом (СД) являются липотимические состояния и обмороки, обусловленные автономной нейропатией с развитием ортостатической гипотонии. Гораздо меньше при СД изучены нарушения равновесия, не связанные с ортостатической гипотонией. Состояние равновесия (устойчивое положение тела в пространстве) зависит от афферентации в различных сенсорных системах – вестибулярной, зрительной, проприоцептивной и слуховой. Большое значение для поддержания равновесия при ходьбе имеет состояние эфферентных двигательных систем центральной нервной системы (ЦНС), в первую очередь лобных долей головного мозга, вестибулярной системы и мозжечка. На развитие изменений походки с нарушением равновесия и падениями могут также влиять патологические изменения двигательных волокон периферических нервов.
Пациенты с СД и диабетической дистальной симметричной сенсорно-моторной полинейропатией (ДПН) в 15 раз чаще получают повреждения при ходьбе (переломы, вывихи лодыжки, порезы и ушибы вследствие падения), чем больные СД без ДПН [1]. Нарушению равновесия у пациентов с СД могут способствовать сенсорный дефицит, снижение силы мышц ног и поражение ЦНС [2]. С 90-х гг. прошлого века проводились исследования, в которых изучали взаимосвязь между нарушением равновесия, риском падений и наличием ДПН [3, 4]. Так, J.K. Richardson и E.A. Hurvitz при обследовании 20 пациентов с СД и подтвержденной данными электромиографии ДПН и 20 испытуемых контрольной группы, сопоставимых по возрасту, полу и сопутствующим заболеваниям, установили, что ДПН является независимым фактором риска падений. У больных с ДПН и падениями в анамнезе обнаружено достоверное снижение вибрационной чувствительности на дистальной фаланге большого пальца стопы и голеностопном суставе по сравнению с пациентами, страдающими ДПН, но без падений в анамнезе (p < 0,05) [5].
Одним из основных объективных методов оценки состояния равновесия у больных является стабилометрия, или динамическая постурография, что было, в частности, показано T. Ledin и соавт. при обследовании 28 больных с полинейропатией. Обследование включало тесты сенсорной организации (шесть состояний, в которых испытуемые пытаются поддерживать вертикальное положение тела при минимальном его отклонении) и моторного контроля (неожиданные смещения платформы под ногами вперед и назад). У пациентов с ДПН отмечены более низкие показатели в тестах сенсорной организации, а также было увеличено время автоматических постуральных реакций по сравнению с контрольной группой [6]. G. Simoneau и соавт. выявили у пациентов с ДПН увеличение порога вибрационной чувствительности, чувства давления, а также снижение суставно-мышечного чувства и корреляцию конкретных сенсорных нарушений с состоянием равновесия [7].
Однако G. Yavuzer и соавт. отметили более медленную походку, более короткие шаги, ограничение подвижности коленных и голеностопных суставов и снижение силы мышц при сгибании стоп у 26 пациентов с СД, но без ДПН по сравнению с 20 здоровыми добровольцами. Полученные данные указывают на то, что ДПН может быть не единственной причиной изменений походки и нарушения равновесия у пациентов с СД. Определенную роль, возможно, играет сила мышц ног [8]. Кроме того, по мнению ряда исследователей, первостепенное значение в нарушении равновесия у пациентов с СД может иметь дисфункция вестибулярной и автономной нервной системы [9].
Многофакторность формирования нарушений равновесия у больных СД и неполнота знаний о роли изменений периферической нервной системы в развитии этого клинического феномена предопределили целесообразность проведения данного исследования. Целью исследования являлось изучение состояния равновесия у пациентов с СД и определение значимости различных факторов, ассоциированных с нарушениями равновесия, в первую очередь ДПН.
Материалы и методы
В исследовании приняли участие 85 больных в возрасте 46–64 лет с СД 1 и 2 типа, проходивших стационарное или амбулаторное лечение в Федеральном бюро медико-социальной экспертизы.
Пациенты были разделены на группы: без жалоб на нарушения равновесия (неустойчивость, «шаткость» при ходьбе) и с жалобами на нарушения равновесия. Пациенты обеих групп были сопоставимы по возрасту и типу СД (табл. 1).
Для выявления и определения выраженности ДПН пациентам проводилось клинико-неврологическое обследование с использованием шкал симптомов невропатии нижних конечностей (Neuropathy Impairment Score – Lower Limbs, NIS-LL), нейропатического дисфункционального счета (НДС), а также общего счета симптомов нейропатии (ОСС). Вибрационную чувствительность оценивали градуированным камертоном с частотой 128 Гц, тактильную чувствительность – монофиламентом, сгибающимся при действии предмета массой 10 г. Суставно-мышечное чувство определяли следующим образом: в положении больного лежа совершали нерезкие сгибательные и разгибательные движения большого пальца стопы 5 раз. Каждому правильному ответу присваивался 1 балл. Таким образом, 0 баллов соответствовало отсутствию правильных ответов и грубому нарушению суставно-мышечного чувства, 5 баллов – отсутствию ошибочных ответов. Для объективного подтверждения ДПН 18 пациентам выполнена стимуляционная электромиография (ЭМГ), включающая определение амплитуды M-ответа, скорости распространения возбуждения (СРВ) и резидуальной латенции при стимуляции малоберцового и большеберцового нервов, а также исследование амплитуды S-ответа и СРВ при стимуляции икроножного нерва с одной стороны.
Функциональное состояние мозжечка оценивали стандартно: проба Ромберга, тандемная ходьба, пальце-носовая и пяточно-коленная пробы, пробы на дисметрию, «обратного толчка», диадохокинез. Наличие вестибулярных нарушений выявляли при опросе (выясняли наличие и характер головокружений, их связь с нарушением равновесия), а также при исследовании спонтанного и установочного нистагма в условиях устранения фиксации взора (размещение перед глазами пациента листа белой бумаги, ограничивающего возможность зрительной фиксации) и исследовании позиционного нистагма с помощью пробы Холпайка.
Для оценки нарушения функции лобных долей (лобной дисфункции) 22 пациентам проведен тест на последовательное соединение чисел и букв (Trail Making Test). На первом этапе теста задача больного заключалась в соединении между собой чисел от 1 до 25. На втором этапе нужно было соединить числа от 1 до 13, чередуя их с буквами от «А» до «М». Если на выполнение второго теста затрачивалось более 91 секунды, это указывало на наличие лобной дисфункции [10].
Всем пациентам выполнена компьютеризированная динамическая постурография на стабилометрическом комплексе NeuroCom SMART EquiTest (США). Для диагностики нарушения равновесия использовали:
а) тест сенсорной организации (Sensory organization test, SOT), включающий шесть состояний: исследование равновесия в условиях с открытыми глазами на стабильной платформе (SOT1), с закрытыми глазами на стабильной платформе (SOT2), с подвижным визуальным окружением (SOT3), с открытыми глазами на подвижной платформе (SOT4), с закрытыми глазами на подвижной платформе (SOT5) и на подвижной платформе с динамическим визуальным окружением (SOT6) (рисунок). Каждый тест выполнялся по три раза. Показатель равновесия в каждом тесте рассчитывался на основании сравнения максимального угла, на который смещается центр тяжести пациента в переднезаднем направлении, и угла в 12,5°, являющегося теоретической нормой. Расчет показателя равновесия производился по формуле:
(2,5° - (Θmax - Θmin))/12,5° × 100 , где
Θ – угол смещения центра тяжести. По результатам шести тестов вычислялся средний показатель равновесия (SOT composite) – среднее арифметическое всех тестов. Кроме того, при каждом SOT определялась стратегия поддержания равновесия (преимущественное использование тазобедренных или голеностопных суставов);
б) тест моторного контроля (Motor control test, MCT), заключающийся в измерении времени автоматических постуральных ответов (непроизвольных реакций на неожиданное смещение опоры под ногами). Определялся усредненный показатель латенции автоматических постуральных двигательных реакций (MCT composite). Для того чтобы исключить влияние зрительного анализатора на стабилометрические показатели, во всех случаях зрение было скорректировано.
После обследования пациентов применялся комплекс мероприятий медицинской реабилитации. Двадцать пациентов с СД и ДПН были рандомизированы на две группы по 10 человек. Все пациенты получали противодиабетическую терапию. Пациенты первой группы получали также Актовегин 2000 мг/сут внутривенно (14 инфузий) с последующим назначением внутрь 1200 мг/сут в течение 83 дней; кроме того, 3 раза в неделю они выполняли комплекс физических упражнений. Пациенты второй группы не получали дополнительного лечения, помимо компенсации СД.
Все пациенты подписали добровольное информированное согласие.
Для оценки качества жизни пациентов применялся комплексный Норфолкский опросник по качеству жизни у пациентов с диабетической нейропатией (Norfolk Quality of Life Questionnaire-Diabetic Neuropathy, Norfolk QOL-DN), который включает полный спектр вопросов на выявление поражения толстых, тонких и автономных нервных волокон.
Статистическую обработку проводили с помощью пакета программ Statistica 6.0 методами параметрической (t-критерий Стьюдента) и непараметрической (U-критерий Манна – Уитни и W-критерий Уилкоксона) статистики. Достоверными считали различия с уровнем значимости p < 0,05.
Результаты исследования
Пациенты в группах без жалоб и с жалобами на нарушения равновесия не различались по степени компенсации углеводного обмена, наличию артериальной гипертонии и диабетических микроангиопатий (ретинопатия и нефропатия) у больных (табл. 1). Однако у пациентов с жалобами на нарушения равновесия индекс массы тела был статистически значимо выше, чем в группе пациентов без жалоб на нарушения равновесия (29,7 против 26,7; p = 0,01), и отмечалась бóльшая длительность СД.
Показатель равновесия во всех условиях теста сенсорной организации, а также усредненный показатель латенции автоматических постуральных двигательных реакций в тесте моторного контроля были достоверно ниже в группе пациентов с жалобами на нарушения равновесия (табл. 2). Кроме того, эти пациенты набрали больше баллов по шкале НДС, что свидетельствует о более тяжелой степени ДПН, и имели более низкие показатели тактильной, вибрационной чувствительности и суставно-мышечного чувства по сравнению с больными в группе без жалоб на нарушения равновесия.
Это объясняется тем, что в группе пациентов с жалобами на нарушения равновесия было больше пациентов с падениями в анамнезе и наличием инвалидности по сравнению с группой пациентов без жалоб на нарушения равновесия (p = 0,04).
При анализе взаимосвязи показателей равновесия и ДПН выявлена корреляция снижения суставно-мышечного чувства и уменьшения оценки SOT1, SOT2, SOT3 в тесте сенсорной организации и усредненного показателя латенции автоматических постуральных двигательных реакций в тесте моторного контроля (r = 0,4; p < 0,01), что свидетельствует о снижении равновесия в условиях с открытыми и закрытыми глазами на стабильной платформе, а также при подвижном визуальном окружении и при неожиданных смещениях опоры под ногами. Обнаружена корреляция снижения вибрационной, тактильной чувствительности, суставно-мышечного чувства и общей оценки по шкале НДС со снижением показателей равновесия в тестах SOT1, SOT2, SOT3 и увеличением усредненного показателя латенции автоматических постуральных двигательных реакций (для всех r = 0,3–0,4; p < 0,05).
Выявлена корреляция снижения или отсутствия амплитуды S- и M-ответов, уменьшения СРВ по икроножному, малоберцовому и большеберцовому нервам со снижением вибрационной, тактильной и суставно-мышечной чувствительности (для всех r = 0,5–0,8; p < 0,05). Показана корреляция снижения амплитуды М-ответа при стимуляции малоберцового нерва и S-ответа при стимуляции икроножного нерва с увеличением латентных периодов автоматических постуральных реакций при малых смещениях платформы назад в тесте моторного контроля (r = 0,5; p = 0,04). Другие ЭМГ-показатели с нарушениями равновесия не коррелировали. Также отмечено, что в группе пациентов с жалобами на нарушение равновесия было статистически значимо больше пациентов с вестибулярным синдромом, чем в группе пациентов без жалоб на нарушение равновесия. Статистически значимой корреляции параметров динамической постурографии и времени выполнения теста на последовательное соединение чисел и букв не выявлено. Не установлено и достоверной корреляции параметров динамической постурографии с уровнем HbA1c и наличием артериальной гипертонии.
Выявлена корреляция наличия падений в анамнезе с увеличением возраста (r = 0,23; p = 0,03) и показателями теста сенсорной организации: SOT1 (r = 0,25; p = 0,02), SOT2 (r = 0,3; p < 0,01), SOT3 (r = 0,26; p = 0,02), SOT4 (r = 0,26; p = 0,02), SOT 6 (r = 0,25; p = 0,02), SOT composite (r = 0,3; p < 0,01).
В качестве методов коррекции нарушений равновесия и ДПН были использованы Актовегин, поскольку в литературе описаны его нейропротективные, антиоксидантные и антигипоксические свойства [11], а также комплекс физических упражнений для улучшения равновесия, так как ранее был выявлен их положительный эффект у пациентов с ДПН [12, 13]. Мужчин и женщин в обеих группах лечения было поровну (по 10 человек). Пациенты были сопоставимы по возрасту. Средний возраст пациентов в первой группе (применение Актовегина и лечебной физкультуры) составил 60 лет (55; 60), во второй – 57 лет (50; 62). В первой группе уровень гликозилированного гемоглобина (HbA1c) равнялся 8,0% (7,3; 11,9), количество пациентов с жалобами на нарушение равновесия составило 80%, число баллов по шкале НДС достигало 21 (18,5; 23), по шкале ОСС – 3,33 (2,0; 6,32). Во второй группе (контрольной) уровень HbA1c составил 8,0% (7,5; 10,3), количество пациентов с жалобами на нарушение равновесия также равнялось 80%, количество баллов по шкале НДС – 5 (5; 16), по шкале ОСС – 3,33 (1,66; 6,32).
Проведено обследование с использованием компьютеризированной динамической постурографии через 2 недели (группа приема Актовегина и лечебной физкультуры) и через 3 месяца лечения (обе группы).
На фоне применения Актовегина в дозе 2000 мг внутривенно в течение двух недель и выполнения комплекса физических упражнений выявлено незначительное снижение баллов по шкалам НДС, NIS-LL и ОСС, однако различия между группами не достигли уровня статистической значимости. Выявлено достоверное (p < 0,05) увеличение показателя равновесия в условиях SOT3 (улучшение равновесия при подвижном визуальном окружении на нестабильной платформе).
Через 3 месяца у пациентов первой группы было выявлено статистически значимое снижение баллов по шкале ОСС, а также снижение суммарной латенции автоматических постуральных двигательных реакций в тесте моторного контроля, что свидетельствует об улучшении равновесия в условиях неожиданного смещения опоры под ногами (табл. 3). Также наблюдалось незначительное, статистически не значимое снижение баллов по шкалам НДС и NIS-LL.
В группе лечения Актовегином и лечебной физкультуры количество пациентов с жалобами на нарушение равновесия сократилось до 40%. Выявлено статистически значимое улучшение качества жизни на фоне лечения: снижение суммарного показателя качества жизни по опроснику Norfolk QOL-DN с 40 (21; 62) до 19 (10; 32), уменьшение баллов по шкале оценки функции толстых нервных волокон с 23 (10; 33) до 9 (5; 26) и шкале оценки функции тонких нервных волокон с 4 (1; 9) до 2 (0; 6) (во всех случаях p < 0,05).
В контрольной группе не выявлено достоверного снижения баллов по шкалам НДС, NIS-LL, ОСС, динамики показателей равновесия в тестах сенсорной организации и моторного контроля, а также снижения числа пациентов с жалобами на нарушение равновесия (табл. 4).
Обсуждение
По данным разных авторов, нарушению равновесия при СД способствуют сенсорный дефицит, который формируется при наличии ДПН, вестибулярный синдром и поражение ЦНС. Сведения о влиянии СД без наличия ДПН на равновесие неоднородны. Это может быть обусловлено разнообразием методик, используемых для диагностики нарушения равновесия.
H. Centomo и соавт. оценивали стабилометрические параметры при достижении функционального предела (максимальный наклон туловища вперед с вытянутыми вперед руками, сохранение такого положения в течение 30 секунд) у 15 пациентов с СД 2 типа и 15 здоровых добровольцев. Отмечено ухудшение показателей (скорости перемещения центра давления, площади колебаний центра давления, амплитуды центра давления) в группе пациентов с СД в течение 30 секунд после достижения функционального предела [14].
Существуют данные, свидетельствующие о более низких показателях равновесия у пациентов без ДПН по сравнению с больными, у которых диагностирована ДПН. Так, G. Yavuzer и соавт. установили, что у 26 пациентов с СД без полинейропатии более медленная походка, более короткие шаги, ограничение подвижности коленных и голеностопных суставов и снижение силы мышц нижних конечностей по сравнению с 20 здоровыми добровольцами и 20 больными СД, осложненным ДПН [8].
Доказано, что с возрастом функциональное состояние систем поддержания равновесия ухудшается. D. Toledo и соавт., например, обнаружили различия в функционировании сенсорной и моторной систем молодых (21,9 ± 2,1 года) и пожилых (68,9 ± 3,7 года) людей по показателям тактильной и суставно-мышечной чувствительности, латенции постуральных моторных реакций, определенных с помощью стабилометрической платформы [15]. В настоящем исследовании группы пациентов были сопоставимы по возрасту, так что этот фактор не оказывал влияния на полученные результаты.
Во многих исследованиях неоднократно подтверждена взаимосвязь между ДПН и нарушением равновесия; во всех случаях было выявлено увеличение экскурсии центра давления у пациентов с ДПН [16–18]. H. Corriveau и соавт. сравнивали состояние равновесия у пациентов с ДПН и здоровых людей. Для этого оценивали параметр, который отражает расстояние между центром давления и центром масс у человека с открытыми и закрытыми глазами (COP-COM, center of pressure minus center of mass). Было отмечено, что COP-COM значительно выше в группе пациентов с СД [19].
G. Simoneau и соавт. выявили корреляцию нарушения равновесия и поражения толстых нервных волокон при ДПН (порог вибрационной и суставно-мышечной чувствительности, чувство давления и центр давления) [7]. В исследовании использовались методики, применение которых для оценки равновесия описано в литературе, – тесты сенсорной организации, моторного контроля, выполнена компьютеризированная динамическая стабилометрия, однако влияние ДПН на состояние равновесия оценивалось без учета степени поражения толстых нервных волокон.
A. Emam и соавт. использовали тест сенсорной организации при проведении компьютеризированной динамической постурографии для оценки равновесия. Проведено сравнение пациентов с СД, отягощенным ДПН, и без ДПН; все пациенты с вестибулярным синдромом из исследования были исключены. Отмечено снижение показателей тестов SOT1, SOT2, SOT3, а также среднего показателя равновесия в группе пациентов с наличием ДПН, не зависящее от компенсации углеводного обмена [20].
Нами также выявлена корреляция снижения вибрационной, тактильной чувствительности, суставно-мышечного чувства и оценки по шкале НДС с уменьшением показателей равновесия по тестам SOT1, SOT2, SOT3 и увеличением усредненного показателя латенции автоматических постуральных двигательных реакций. Это свидетельствует о взаимосвязи повреждения толстых нервных волокон и снижения равновесия в условиях с открытыми и закрытыми глазами на стабильных поверхностях, а также при неожиданных смещениях опоры под ногами. Взаимосвязи нарушения равновесия и компенсации углеводного обмена в данном исследовании не выявлено. Группы пациентов (с жалобами на нарушение равновесия и без них) статистически значимо различались в оценке по шкале НДС, а также по степени снижения вибрационной, тактильной чувствительности и суставно-мышечного чувства. Можно предположить, что ДПН с поражением толстых нервных волокон является независимым фактором нарушения равновесия.
У пациентов с жалобами на нарушение равновесия показатель равновесия во всех шести условиях теста сенсорной организации был ниже, чем у больных без жалоб, что свидетельствует о роли других факторов, кроме повреждения толстых нервных волокон, в нарушении равновесия у лиц с СД. В частности, в группе пациентов с жалобами на нарушение равновесия было статистически значимо больше пациентов с вестибулярным синдромом.
Вестибулярный синдром часто встречается у пациентов с СД и играет важную роль в нарушении равновесия. K. Klagenberg и соавт. выявили вестибулярный синдром у 60% из обследованных пациентов с СД 1 типа [21], в другом исследовании вестибулярный синдром обнаружен у 36,8% пациентов [22]. Многие авторы подтвердили, что вестибулярный синдром в популяции значительно чаще встречается у больных СД. Так, по данным J. Li и соавт., 68,4% больных СД имели вестибулярный синдром, в то время как у лиц без СД он встречался только в 8,3% случаев [23]. Y. Agrawal и соавт. продемонстрировали, что вестибулярный синдром повышает риск падений у больных СД, особенно в сочетании с ДПН [24]. Вместе с тем вопрос о патофизиологической связи вестибулярных нарушений, в частности доброкачественного позиционного головокружения, остается открытым.
W. Di Nardo и соавт. для оценки равновесия у больных СД с ДПН и без ДПН также использовали тесты сенсорной организации и моторного контроля. Выявлено снижение показателей равновесия в тестах SOT3 и SOT6, однако в отличие от настоящего исследования не оценивалось наличие вестибулярного синдрома и его влияние на полученные результаты. Кроме того, установлено увеличение латентных периодов автоматических постуральных моторных реакций при малых смещениях платформы вперед в группе пациентов с ДПН [25]. В настоящем исследовании не выявлено корреляции изменений показателей теста на последовательное соединение цифр и букв с нарушениями равновесия. В исследовании L. Uccioli и соавт. также не обнаружено связи характеристик вызванных соматосенсорных потенциалов и потенциалов при магнитной стимуляции головного мозга с показателями постурографии [26].
В качестве метода медицинской реабилитации нами использовано сочетанное применение Актовегина (при выборе препарата мы руководствовались тем, что в литературе описаны нейропротективные антиоксидантные и антигипоксические свойства Актовегина) с комплексом физических упражнений для улучшения равновесия, так как ранее был выявлен их положительный эффект у пациентов с ДПН. Лимитирующими факторами исследования являлись небольшая выборка пациентов и короткий период наблюдения, с чем может быть связано отсутствие динамики показателя равновесия в условиях теста сенсорной организации.
Таким образом, важным независимым фактором риска нарушения равновесия у больных СД является наличие ДПН, особенно с поражением толстых нервных волокон. Это указывает на важнейшую роль проприоцептивной афферентации в формировании нарушений равновесия у больных СД. Кроме того, к значимым факторам риска развития нарушений равновесия у больных СД следует отнести вестибулярный синдром. Данные, полученные в группах лечения, позволяют считать Актовегин потенциально эффективным препаратом для лечения больных СД с нарушениями равновесия.
1. Cavanagh P.R., Derr J.A., Ulbrecht J.S. et al. Problems with gait and posture in neuropathic patients with insulin-dependent diabetes mellitus // Diabet. Med. 1992. Vol. 9. № 5. P. 469–474.
2. Brach J.S., Talkowski J.B., Strotmeyer E.S., Newman A.B. Diabetes mellitus and gait dysfunction: possible explanatory factors // Phys. Тher. 2008. Vol. 88. № 11. P. 1365–1374.
3. Bergin P.S., Bronstein A.M., Murray N.M. et al. Body sway and vibration perception thresholds in normal aging and in patients with polyneuropathy // J. Neurol. Neurosurg. Psychiatry. 1995. Vol. 58. № 3. P. 335–340.
4. Nardone A., Grasso M., Schieppati M. Balance control in peripheral neuropathy: are patients equally unstable under static and dynamic conditions? // Gait Posture. 2006. Vol. 23. № 3. P. 364–373.
5. Richardson J.K., Hurvitz E.A. Peripheral neuropathy: a true risk factor for falls // J. Gerontol. A Biol. Sci Med. Sci. 1995. Vol. 50. № 4. P. 211–215.
6. Ledin T., Odkvist L.M., Vrethem M., Möller C. Dynamic posturography in assessment of polyneuropathic disease // J. Vestib. Res. 1990–1991. Vol. 1. № 2. P. 123–128.
7. Simoneau G.G., Ulbrecht J.S., Derr J.A. et al. Postural instability in patients with diabetic sensory neuropathy // Diabetes Care. 1994. Vol. 17. № 12. P. 1411–1421.
8. Yavuzer G., Yetkin I., Toruner F.B. et al. Gait deviations of patients with diabetes mellitus: looking beyond peripheral neuropathy // Eura Medicophys. 2006. Vol. 42. № 2. P. 127–133.
9. Sacco I.C., Amadio A.C. A study of biomechanical parameters in gait analysis and sensitive cronaxie of diabetic neuropathic patients // Clin. Biomech. (Bristol, Avon). 2000. Vol. 15. № 3. P. 196–202.
10. Захаров В.В., Вознесенская Т.Г. Нервно-психические нарушения: диагностические тесты. 2-е изд. М.: МЕДпресс-информ, 2013. 320 с.
11. Ziegler D., Movsesyan L., Mankovsky B. et al. Treatment of symptomatic polyneuropathy with actovegin in type 2 diabetic patients // Diabetes Care. 2009. Vol. 32. № 8. P. 1479–1484.
12. Herriott M.T., Colberg S.R., Parson H.K. et al. Effects of 8 weeks of flexibility and resistance training in older adults with type 2 diabetes // Diabetes Care. 2004. Vol. 27. № 12. P. 2988–2989.
13. Morrison S., Colberg S.R., Mariano M. et al. Balance training reduces falls risk in older individuals with type 2 diabetes // Diabetes Care. 2010. Vol. 33. № 4. P. 748–750.
14. Centomo H., Termoz N., Savoie S. et al. Postural control following a self-intiated reaching task in type 2 diabetic patients and age-matched controls // Gait Posture. 2007. Vol. 25. № 4. P. 509–514.
15. Toledo D.R., Barela J.A. Sensory and motor differences between young and older adults: somatosensory contribution to postural control // Rev. Bras. Fisioter. 2010. Vol. 14. № 3. P. 267–275.
16. Uccioli L., Giacomini P.G., Monticone G. et al. Body sway in diabetic neuropathy // Diabetes Care. 1995. Vol. 18. № 3. P. 339–344.
17. Boucher P., Teasdale N., Courtemanche R. et al. Postural stability in diabetic neuropathy // Diabetes Care. 1995. Vol. 18. № 5. P. 638–645.
18. Katoulis E.C., Ebdon-Parry M., Hollis S. et al. Postural instability in diabetic neuropathic patients at risk of foot ulceration // Diabet. Med. 1997. Vol. 14. № 4. P. 296–300.
19. Corriveau H., Prince F., Hébert R. et al. Evaluation of postural stability in elderly with diabetic neuropathy // Diabetes Care. 2000. Vol. 23. № 8. P. 1187–1191.
20. Emam A.A., Gad A.M., Ahmed M.M. et al. Quantitative assessment of posture stability using computerised dynamic posturography in type 2 diabetic patients with neuropathy and its relation to glycaemic control // Singapore Med. J. 2009. Vol. 50. № 6. P. 614–618.
21. Klagenberg K.F., Zeigelboim B.S., Jurkiewicz A.L., Martins-Bassetto J. Vestibulocochlear manifestations in patients with type I diabetes mellitus // Braz. J. Otorhinolaryngol. 2007. Vol. 73. № 3. P. 353–358.
22. Rigon R., Rossi A.G., Cóser P.L. Otoneurologic findings in Type 1 Diabetes mellitus patients // Braz. J. Otorhinolaryngol. 2007. Vol. 73. № 1. P. 100–105.
23. Li J., Zhang T., Shen J. et al. The changes in vestibular function in patients with diabetes mellitus and its clinical significance // Lin Chung Er Bi Yan Hou Tou Jing Wai Ke Za Zhi. 2008. Vol. 22. № 1. P. 10–13.
24. Agrawal Y., Carey J.P., Della Santina C.C. et al. Diabetes, vestibular dysfunction, and falls: analyses from the National Health and Nutrition Examination Survey // Otol. Neurotol. 2010. Vol. 31. № 9. P. 1445–1450.
25. Di Nardo W., Ghirlanda G., Cercone S. et al. The use of dynamic posturography to detect neurosensorial disorder in IDDM without clinical neuropathy // J. Diabetes Complications. 1999. Vol. 13. № 2. P. 79–85.
26. Uccioli L., Giacomini P.G., Pasqualetti P. et al. Contribution of central neuropathy to postural instability in IDDM patients with peripheral neuropathy // Diabetes Care. 1997. Vol. 20. № 6. P. 929–934.
Impaired balance in diabetic patients
O.S. Fedorova, I.V. Guryeva
Federal State Budgetary Institution ‘State Medical and Social Assessment Bureau’ of Ministry of Labour and Social Protection of the Russian Federation, Moscow
I.A. Strokov, L.T. Akhmedzhanova
Federal State Budgetary Institution ‘State Medical and Social Assessment Bureau’ of Ministry of Labour and Social Protection of the Russian Federation, Moscow
I.A. Strokov, L.T. Akhmedzhanova
State Budgetary Educational Institution for Higher Professional Education ‘I.M. Sechenov First Moscow State Medical University’, Neurology Department
Contact person: Igor Alekseyevich Strokov, strigoral@mail.ru
The authors assessed balance disturbances in 85 types I and II diabetes patients (age 46 64 years). Diabetic neuropathy (DN), especially DN with large nerve fibers involvement, was an important independent risk factor for impaired balance. Vestibular syndrome was also found to be a significant risk factor for impaired balance in diabetes. The results of medical rehabilitation of diabetic patients with DN were assessed. Three-month treatment with Actovegin and exercise therapy resulted in significantly improved total Neuropathy Symptom Score, decreased total latency of automatic postural motor reactions in the motor control test, twofold decrease of number of patients with imbalance-related complaints, improved quality of life and decreased large nerve fibers and small nerve fibers functional scores.
Новости на тему
02.02.2024
01.02.2023
23.08.2022 01:00:00
01.07.2022 11:00:00
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.