Эффективность применения препарата Мексидол® при констриктивно-стенотической артериопатии
- Аннотация
- Статья
- Ссылки
Хроническая ишемия мозга – особая форма сосудистой церебральной патологии, обусловленная медленно прогрессирующей диффузной недостаточностью кровоснабжения мозговой ткани, приводящая к прогрессирующему ухудшению функционирования головного мозга. В отечественной литературе принято выделять три стадии хронической сосудистой мозговой недостаточности. В клинической практике мы, как правило, сталкиваемся со II-III стадиями болезни (2, 3, 4).
При наличии хронической ишемии головного мозга особое внимание в настоящее время уделяется контролируемым и неконтролируемым факторам риска. Существенное значение имеют и те и другие факторы, особенно возраст и наследственность (неконтролируемые факторы). Контролируемые факторы риска – это артериальная гипертензия, болезни сердца, сахарный диабет, курение, метаболический синдром, прием оральных контрацептивов (5). Терапевтическая стратегия при лечении хронической ишемии мозга должна учитывать как наличие неконтролируемых факторов, так и значение, и структуру контролируемых факторов риска. Выбор препаратов для лечения хронической ишемии мозга прежде всего должен быть ориентирован на определенные звенья патогенеза формирования ишемических изменений в головном мозге.
Большой арсенал медикаментов, которыми в настоящее время располагает врач-невролог, приводит к сложностям выбора именно тех, применение которых будет необходимо и достаточно для каждого конкретного пациента с учетом пола, возраста, стадии заболевания, а также наличия и выраженности контролируемых факторов риска (5, 6, 7, 8).
Ишемия головного мозга также гетерогенна по своей природе, как и ишемический инсульт. Но если механизмы формирования и перспективы лечения хронической ишемии мозга в достаточной степени изучены, то особенности развития и методы профилактики и борьбы с одной из форм острой ишемии, обусловленной констрикторно-стенотической артериопатией (КСА) при разрыве аневризмы головного мозга, требуют дальнейшего совершенствования.
Очаговая ишемия, которая развивается при внутричерепных кровоизлияниях из аневризм головного мозга, имеет свои закономерности развития и чаще всего возникает в бассейне «донорского» сосуда, т.е. сосуда, несущего аневризму. В дальнейшем вазоспазм КСА распространяется при полушарной локализации процесса на противоположный сосудистый бассейн, а затем – на вертебробазилярный.
Не существует прямых корреляций между степенью вазоспазма КСА и размерами очага церебральной ишемии, но чем более выражен вазоспазм, тем больше риск развития инфаркта мозга, хотя во многих случаях даже при III степени вазоспазма допплерографически и ангиографически верифицированной очаговой ишемии по данным КТ и МРТ не определяется.
В лечении нарушений мозгового кровообращения целесообразно использовать препараты, имеющие многофункциональные свойства, так как они должны воздействовать на различные этапы и звенья ишемического каскада. При развитии ишемии мозга происходит нарушение энергетического баланса нейронов, развивается отек мозга, ацидоз, нарушаются процессы перекисного окисления липидов, в связи с чем развивается избыток свободных радикалов, происходит нарушение биомембраны клеток, ухудшается синоптическая передача и взаимосвязь структур мозга (9, 10, 11, 12, 13).
В связи с вышеизложенным, одним из оптимальных препаратов, воздействующих на разные звенья ишемического каскада, является российский препарат Мексидол® (2-этил-6-метил-3-гидроксипиридина сукцинат). Мексидол® относится к группе антигипоксантов и антиоксидантов. Он улучшает метаболические процессы и микроциркуляцию, улучшает энергетический обмен, активируя энергосинтезирующие функции митохондрий, является мембраностабилизатором, подавляет агрегацию тромбоцитов, улучшает реологические свойства крови и уменьшает уровень не только общего холестерина, но и липопротеинов низкой плотности. Мексидол® повышает устойчивость мозга к гипоксии и ишемии, улучшает кровоснабжение и метаболизм нейрональной ткани. С учетом многофункциональных свойств препарата, он широко применяется как при острой, так и при хронической ишемии мозга.
В НИИ нейрохирургии им. проф. А.Л. Поленова накоплен большой опыт применения препарата Мексидол® при разных формах нейрохирургической патологии, начиная с 2002 года.
В рамках настоящей работы мы представляем опыт применения препарата Мексидол® у 58 пациентов с очаговой ишемией мозга вследствие констрикторно-стенотической артериопатии в остром периоде разрыва аневризм головного мозга и у 125 пациентов с хронической ишемией мозга при стенозирующих процессах прецеребральных артерий. В связи с разнородностью групп анализ по каждой группе проводился раздельно.
Методы исследования были традиционны и одинаковы: диагностический нейрохирургический комплекс, включающий общеклиническое обследование, неврологическое с использованием шкальных оценок по шкале MMSE, индекса Бартеля, а также ЭЭГ, КТ, МРТ и допплерографию (ТКДГ, дуплексное сканирование).
I группа: 58 наблюдений; возраст больных − от 32 до 64 лет, средний возраст – 41,5 ± 3,3 года. Мужчин было 34, женщин – 24. Локализация аневризм: ПМА – ПСА (n = 21, 39,8%), развилка СМА (n = 14, 24,1%), М1 сегмент СМА (n = 6, 10,3%), супраклиноидный отдел ВСА (n = 13, 22,1%), а также в месте отхождения ЗСА (n = 4, 6,7%). Аневризм вертебробазилярного бассейна в данной серии не имелось. У всех пациентов на 7-15-е сутки после разрыва аневризмы развился вазоспазм (констрикторно-стенотическая артериопатия II–III степени), верифицированный по данным ТКДГ и ангиографии. В 42 наблюдениях, по данным КТ и МРТ, были визуализированы очаги церебральной ишемии, локализация которых совпадала с локализацией аневризмы и была преимущественно (n = 38, 69,2%) в лобных, височных и теменно-височных отделах полушарий головного мозга на стороне аневризмы.
Неврологическая симптоматика проявлялась общемозговыми симптомами в виде угнетения сознания до оглушения III степени и сопора (n = 18, 29,1%), нарушением функций глазодвигательных нервов (n = 22, 39,4 %), появлением асимметрии мимической мускулатуры (n = 58, 100%) и пирамидной недостаточностью в виде моно- (n = 9, 17,6%) и гемипарезов (n = 49, 72,4%) до 3-3,5 баллов с изменением мышечного тонуса по типу гипотонии (n = 42, 72,3%), реже имелось повышение тонуса по пирамидному типу (n = 9, 17,6%), а также наличием патологических стопных знаков как сгибательных (n = 58, 100%) , так и разгибательных (n = 54, 80,5%). Наличие и динамика оболочечного синдрома коррелировали со степенью выраженности субарахноидального кровоизлияния (коэффициент корреляции 3,76%). Степень выраженности когнитивных нарушений по шкале ММSЕ колебалась в пределах 23-26 баллов у всех больных.
Контрольная группа состояла из 15 наблюдений с той же патологией, сопоставимой по оцениваемым критериям.
II группа: 125 пациентов с хронической ишемией мозга вследствие стенозирующих процессов прецеребральных артерий. Возраст больных – от 42 до 68 лет, средний возраст – 54,6 ± 3,5 года. Мужчин было 69, женщин – 56. У всех пациентов имелась хроническая ишемия мозга II-III степени, в 84 наблюдениях у пациентов в анамнезе имелся ишемический инсульт в анамнезе (4-5 лет до поступления в стационар). В большинстве наблюдений (89 человек) имелся стенозирующий процесс в бассейне внутренних сонных артерий (ВСА) в виде гладких и гетерогенных бляшек с сужением просвета сосуда менее 75% диаметра. В остальных наблюдениях (36 больных) имелась патология сосудов вертебробазилярного бассейна в виде сочетания стенозирующего процесса (степень стеноза − у 49 пациентов < 50% диаметра сосуда и у 76 < 75%) с патологической извитостью и гипоплазией позвоночных артерий. Следует отметить, что именно в группе пациентов с патологией вертебробазилярного бассейна отмечались дополнительные факторы риска в виде разомкнутости большого артериального круга мозга как в передних (n = 15, 12%), так и в задних отделах (n= 6, 4,9%), а также наличие аномалии Киммерли (n = 6, 4,9%).
По данным КТ и МРТ у 84 пациентов, имевших инсульт в анамнезе, отмечались рубцово-атрофические изменения в зоне, соответству-ющей перенесенному инсульту. У остальных пациентов (36 человек) выявлялись признаки умеренной заместительной гидроцефалии, множественные точечные очаги демиелинизации и нерезко выраженные кистозно-спаечные изменения субарахноидальных пространств головного мозга (у этих 36 больных). По данным ЭЭГ, имелись нерезко выраженная полушарная асимметрия (n = 88, 79,6%), ирритация диэнцефальных структур (n = 76, 60,8%) и заостренные формы биопотенциалов (n = 44, 35,7%). Грубых изменений биоэлектрической активности мозга не выявлялось.
Неврологическая симптоматика была представлена у пациентов с постинсультными нарушениями моно- и гемипарезами в пределах 3-4 баллов (n = 84, 100%), нарушением функций черепных нервов в виде асимметрии мимической мускулатуры по центральному типу (n = 84, 100%), в 15 наблюдениях имелось гомонимная гемианопсия и в 32 наблюдениях – умеренно выраженная смешанная форма афазии. Выявлялись также цефалгический и вестибуло-атаксический синдромы у 42 и 29 пациентов, соответственно. Во всех наблюдениях отмечалось умеренное снижение когнитивных функций на уровне 24-27 баллов по шкале ММSЕ.
В контрольной группе было 29 наблюдений с последствиями перенесенного инсульта и хронической недостаточностью мозгового кровообращения. Основная и контрольная группы были сопоставимы по полу и возрасту, стадии и тяжести заболевания и характеру неврологической симптоматики, что позволило в дальнейшем проводить сравнительную оценку результатов лечения.
Препарат Мексидол® применяли в I группе пациентов внутривенно капельно 1 раз в день по 500 мг (10 мл 5%-раствора) в течение 7-10 дней, затем препарат вводили внутримышечно по 250 мг 2 раза в день в течение 15 дней, после чего пациентов переводили на пероральный прием препарата Мексидол® по 125 мг 3 раза в день в течение месяца. Лечение проводили на фоне стандартизованной терапии (в том числе Нимодипин для лечения и профилактики вазоспазма) для пациентов с субарахноидальными кровоизлияниями.
Контрольная группа пациентов (15 наблюдений) получала только стандартизированную терапию.
Во II группе пациентов с хронической ишемией головного мозга на фоне стандартной ноотропной и сердечно-сосудистой терапии Мексидол® вводили внутривенно капельно в дозе 250 мг (5 мл 5%-раствора) в течение 7 дней, затем осуществлялся переход на внутримышечное введение препарата в дозе 100 мг (2 мл 5%-раствора) 1 раз в сутки в течение 15 дней. Далее переходили на длительный пероральный прием препарата: 125 мг 3 раза в день в течение 2-х месяцев с перерывом на 1 месяц и повторным двухмесячным курсом.
Эффективность применения препарата оценивали с помощью шкалы MMSE и индекса Бартеля.
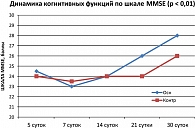
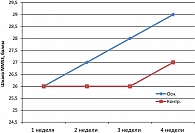
Как следует из рисунка 1, при оценке динамики когнитивных нарушений в 1 группе больных с отсроченной церебральной ишемией вследствие КСА в остром периоде разрыва аневризм головного мозга отмечена существенная динамика по сравнению с контрольной группой (p < 0,01) не только по степени регресса когнитивных нарушений, но и по темпу регресса.
Регресс когнитивных нарушений начинался в части наблюдений (n = 25,43 %) с 9-10 суток, но достоверная разница по сравнению с контрольной группой появлялась только к 15-16 суткам после кровоизлияния и к 9-10 суткам от начала развития констрикторно-стенотической артериопатии. С последующих суток в группе пациентов, получавших препарат Мексидол®, отмечен значительно более быстрый темп восстановления когнитивных нарушений. Следует также отметить, что и после контрольной точки графика «4 неделя» в последующий месяц уже после выписки из стационара сохранялась та же стойкая тенденция к восстановлению когнитивного дефицита, более выраженная в основной группе.
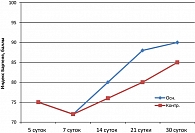
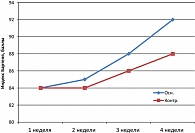
При оценке динамики неврологических нарушений и навыков самообслуживания с использованием индекса Бартеля (рисунок 2) установлено, что при практически одинаковой степени выраженности неврологических нарушений в основной и контрольной группах к началу применения препарата Мексидол® получены практически те же данные, что и по шкале MMSE как по степени регресса неврологического дефицита, так и по темпу восстановления неврологических нарушений.
Как следует из графика на рисунке 2, к 7 суткам отмечалось нарастание неврологического дефицита с уменьшением величины индекса Бартеля, что связано с появлением вазоспазма (КСА) и развитием отсроченной церебральной ишемии. В дальнейшем параллельно с регрессом вазоспазма происходило и восстановление неврологических нарушений. В последующие дни наблюдения увеличился темп и степень восстановления неврологических нарушений.
Таким образом, применение препарата Мексидол® при острой церебральной ишемии (в качестве модели острой церебральной ишемии исследовалась острая ишемия, развивающаяся вследствие КСА в остром периоде разрыва церебральных аневризм) показало его высокую эффективность.
Во II группе – хроническая ишемия мозга – как было упомянуто ранее, проводился раздельный анализ эффективности препарата в двух подгруппах: при постинсультных нарушениях и при хронической недостаточности мозгового кровообращения в каротидном и вертебробазилярном бассейнах.
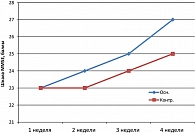
Как следует из рисунка 3, степень выраженности когнитивных нарушений у постинсультных больных была достаточно выраженной. Однако с началом применения препарата Мексидол®, так же как и при острой церебральной ишемии, начинался более быстрый и полноценный регресс когнитивных нарушений по сравнению с контрольной группой. С учетом тяжести состояния больных и длительного анамнеза полного восстановления когнитивных нарушений естественно произойти не могло.
Когнитивные нарушения являются одной из составных частей в структуре неврологических нарушений, поэтому неудивительно, что темп и степень регресса неврологических нарушений в целом имеют те же закономерности, которые наблюдались и при оценке динамики когнитивных нарушений.
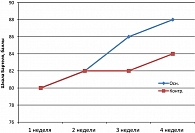
Динамика неврологических нарушений с оценкой по индексу Бартеля начиналась достаточно рано (с 5-7 суток) при применении инфузионной терапии и была значительно более выражена у пациентов основной группы (рисунок 4).
Во 2-й подгруппе наблюдений при хронической недостаточности мозгового кровообращения у пациентов изначально не было резко выраженных неврологических нарушений, и когнитивный дефицит также был умеренный. Однако, как показывает динамика когнитивных нарушений в частности (рисунок 5), и неврологических нарушений в целом (рисунок 6), лечебный эффект был значительно выше в группе пациентов, получавших в комплексной терапии препарат Мексидол®.
При ретроспективном анализе представленного материала следует отметить, что для пациентов с хронической ишемией мозга одним из важных условий стойкого лечебного эффекта является систематичность курсов медикаментозной терапии, которая никак не должна ограничиваться одним курсом инфузионной терапии и столь же кратковременным – не более одного месяца курса внутримышечного введения препарата.
Необходимо построение долгосрочной лечебной программы, включающей весь спектр препаратов, воздействующих на разные звенья ишемического каскада, обязательной составляющей которого должны являться антигипоксанты.
Заключение
Анализ нашего материала показывает, что российский антигипоксант и антиоксидант Мексидол® является эффективным препаратом в лечении острой и хронической ишемии мозга благодаря его многофункциональным возможностям с одновременным воздействием на разные звенья ишемического каскада. Тема установления оптимальных дозировок для инфузионной терапии требует дальнейшего дополнительного обсуждения. Также требует обсуждения продолжительность и повторность курса препарата Мексидол® в профилактике и лечении хронической недостаточности мозгового кровообращения.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.