Эффективность шестимесячной терапии ребамипидом при хроническом атрофическом гастрите: результаты исследования «ОПЛОТ»
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследовании «Оптимизация лечебно-диагностических подходов у пациентов с хроническим атрофическим гастритом» на базе СЗГМУ им. И.И. Мечникова приняли участие 178 пациентов в возрасте от 20 до 74 лет с морфологически подтвержденным ХАГ различной этиологии, средний возраст – 57 (48–65) лет. В зависимости от этиологии ХАГ все пациенты были разделены на три группы: первая (n = 99) – аутоиммунный ХАГ, вторая (n = 33) – пациенты с постэрадикационным ХАГ, третья (n = 46) – смешанная этиология (постэрадикационный + аутоиммунный ХАГ). В дальнейшем каждую группу случайным образом делили на подгруппы: основную (прием ребамипида в течение 12 месяцев в дозе 300 мг/сут) и контрольную (без терапии ребамипидом). Через шесть месяцев (промежуточные результаты) проводили клинико-лабораторное обследование с оценкой уровня пепсиногена-I (П-I), пепсиногена-II (П-II), гастрина-17 (Г-17), соотношения П-I/П-II в крови.
Результаты. Среди пациентов с аутоиммунным ХАГ в основной подгруппе отмечалось статистически значимое повышение соотношения П-I/П-II (р < 0,001), указывающее на регресс атрофии, снижение Г-17 (р < 0,001), при снижении П-I в обеих подгруппах (р < 0,001; р = 0,003 соответственно). В группе с постэрадикационным ХАГ выявлена положительная динамика в подгруппе ребамипида по показателям П-I и П-II (р < 0,05). Однако при оценке соотношения П-I/П-II в обеих подгруппах динамики выявлено не было (р = 0,451). У пациентов с ХАГ смешанного генеза определялась положительная динамика в подгруппе ребамипида по уровню П-I и П-II (p < 0,001). При анализе динамики соотношения П-I/П-II и уровня гастрина-17 статистически значимых различий в подгруппах не отмечалось (р > 0,05).
Заключение. Применение ребамипида в течение шести месяцев приводит к положительной динамике серологических маркеров атрофии и воспаления у пациентов с аутоиммунным ХАГ. У пациентов с постэрадикационным ХАГ и ХАГ смешанного генеза в обеих подгруппах (пациенты, получавшие лечение ребамипидом, и без терапии) выявлены серологические признаки снижения воспаления без признаков регресса атрофии.
Материал и методы. В исследовании «Оптимизация лечебно-диагностических подходов у пациентов с хроническим атрофическим гастритом» на базе СЗГМУ им. И.И. Мечникова приняли участие 178 пациентов в возрасте от 20 до 74 лет с морфологически подтвержденным ХАГ различной этиологии, средний возраст – 57 (48–65) лет. В зависимости от этиологии ХАГ все пациенты были разделены на три группы: первая (n = 99) – аутоиммунный ХАГ, вторая (n = 33) – пациенты с постэрадикационным ХАГ, третья (n = 46) – смешанная этиология (постэрадикационный + аутоиммунный ХАГ). В дальнейшем каждую группу случайным образом делили на подгруппы: основную (прием ребамипида в течение 12 месяцев в дозе 300 мг/сут) и контрольную (без терапии ребамипидом). Через шесть месяцев (промежуточные результаты) проводили клинико-лабораторное обследование с оценкой уровня пепсиногена-I (П-I), пепсиногена-II (П-II), гастрина-17 (Г-17), соотношения П-I/П-II в крови.
Результаты. Среди пациентов с аутоиммунным ХАГ в основной подгруппе отмечалось статистически значимое повышение соотношения П-I/П-II (р < 0,001), указывающее на регресс атрофии, снижение Г-17 (р < 0,001), при снижении П-I в обеих подгруппах (р < 0,001; р = 0,003 соответственно). В группе с постэрадикационным ХАГ выявлена положительная динамика в подгруппе ребамипида по показателям П-I и П-II (р < 0,05). Однако при оценке соотношения П-I/П-II в обеих подгруппах динамики выявлено не было (р = 0,451). У пациентов с ХАГ смешанного генеза определялась положительная динамика в подгруппе ребамипида по уровню П-I и П-II (p < 0,001). При анализе динамики соотношения П-I/П-II и уровня гастрина-17 статистически значимых различий в подгруппах не отмечалось (р > 0,05).
Заключение. Применение ребамипида в течение шести месяцев приводит к положительной динамике серологических маркеров атрофии и воспаления у пациентов с аутоиммунным ХАГ. У пациентов с постэрадикационным ХАГ и ХАГ смешанного генеза в обеих подгруппах (пациенты, получавшие лечение ребамипидом, и без терапии) выявлены серологические признаки снижения воспаления без признаков регресса атрофии.





Введение
Эпителиальный барьер в норме обеспечивает гомеостаз многоклеточного организма с помощью двунаправленных трансцеллюлярных и парацеллюлярных потоков ионов и субстратов [1]. Нарушенные межклеточные взаимодействия при синдроме повышенной эпителиальной проницаемости (СПЭП) ранее наиболее подробно изучались при функциональных заболеваниях пищеварительной системы [2]. Но вскоре стало появляться все больше подтверждений связи СПЭП с патогенезом органических заболеваний всех отделов пищеварительной системы и расстройств других систем. Было показано, что активность воспалительного процесса в слизистой оболочке желудка (СОЖ) прямо коррелирует с выраженностью СПЭП [3].
Ребамипид, являющийся производным α-аминокислоты 2(1H)-хинолинона, был описан в литературе с 1985 г. как препарат для лечения язвенной болезни желудка [1]. Но в ходе дальнейших исследований зарекомендовал себя как единственный универсальный эпителиопротектор или корректор СПЭП [1]. Механизмы действия ребамипида складываются из многих компонентов, таких как снижение выработки активных форм кислорода [1], снижение активности нейтрофилов и снижение продукции провоспалительных цитокинов [4, 5]. Ребамипид влияет на изменение проницаемости слизистой оболочки желудочно-кишечного тракта (ЖКТ) вследствие увеличения экспрессии белков плотных контактов zonula occludens (ZO-1) и клаудинов [5]. Продемонстрировано, что ребамипид повышает экспрессию клаудина-3 и клаудина-4 при совместном назначении с ингибиторами протонной помпы (ИПП) [1]. Следующий механизм связан с Sonic hedgehog (Shh) – сигнальным белком, синтезирующимся в ряде тканей, в т.ч. в слизистой оболочки желудка (СОЖ) [6]. Shh участвует в дифференцировке и пролиферации эпителиальных клеток, тканевом гомеостазе, в регуляции иммунного ответа на Helicobacter pylori – индуцированное воспаление вследствие хемотаксиса макрофагов [6, 7]. Накоплены данные о реализации цитопротективных эффектов ребамипида через индукцию сигнальных путей, стимулирующих выработку ЦОГ-2 и, как следствие, повышение концентрации простагландина Е2 [8]. Несколько позднее на клеточных культурах тонкой кишки человека было доказано, что ребамипид увеличивал секрецию муцина посредством активации p-Akt (сигнального пути, связанного с подавлением апоптоза, способствующего пролиферации клеток) [9]. Ребамипид индуцировал экспрессию белков, связанных с аутофагией (p-ERK и p-p38) [10].
Терапия препаратом оказалась эффективной при различных гастроэнтерологических заболеваниях: гастроэзофагеальной рефлюксной болезни [11], язвенной болезни желудка [1], поражениях ЖКТ, ассоциированных с приемом нестероидных противовоспалительных препаратов (НПВП) [12, 13], язвенном колите [14], послеоперационных язвах у лиц, перенесших эндоскопическую подслизистую диссекцию по поводу неоплазий желудка (в комбинации с ИПП) [15]. Ребамипид показал себя как средство для повышения эффективности эрадикационной терапии H. pylori [3, 16, 17]. На сегодняшний день рассматриваются три наиболее распространенных вида хронического атрофического гастрита (ХАГ): H. pylori-ассоциированный (или постэрадикационный), аутоиммунный и ХАГ смешанного генеза (H. pylori-ассоциированный и аутоиммунный). Подробно диагностические критерии описаны в консенсусе RE.GA.IN. [18].
Обращает на себя внимание признание в научном сообществе роли неинвазивных маркеров в диагностике ХАГ, так называемой функциональной серологии, к которой относят уровни пепсиногена-I (П-I), пепсиногена-II (П-II), гастрина-17 (Г-17), соотношение П-I/П-II в крови, наличие антител IgG к H. pylori [18, 19]. Если П-II в литературе описан как маркер, универсальный для воспаления во всех отделах желудка, независимо от этиологии прямо коррелирующий со степенью воспаления, то П-I вследствие выработки только в теле желудка указывает на топографию процесса [20, 21]. Показано снижение уровня П-I и П-I/П-II по мере увеличения атрофии в теле желудка, а также снижение Г-17 по мере нарастания антральной атрофии [22]. В то же время при ХАГ, ассоциированном с H. pylori, через два месяца после успешной эрадикационной терапии отмечалось снижение П-I с последующим его ростом через 12 месяцев наблюдения, а также снижение П-II, что коррелирует со снижением выраженности атрофии и воспалительных процессов и в отдаленном периоде через 12 месяцев морфологически [23, 24].
Первое описание терапии ребамипидом в течение одного года при ХАГ представлено в многоцентровом рандомизированном контролируемом клиническом исследовании, проведенном в Японии [25]. Было включено 103 пациента с H. pylori-ассоциированным ХАГ, которым на первом этапе проводилась эрадикационная терапия с последующим разделением на группу ребамипида и контроля (без терапии) [25]. Показатели воспаления и атрофии по классификации OLGA улучшились в обеих группах, статистически значимых межгрупповых различий не отмечалось [25]. При локальной оценке отмечалось снижение хронического воспаления по малой кривизне в области тела при терапии ребамипидом по сравнению с группой, не получавшей лечения (1,12 ± 0,08 в сравнении с 1,35 ± 0,08; р = 0,043) [25]. Преимуществом данного исследования является оценка серологических показателей атрофии наряду с морфологическими данными. Уровни сывороточного гастрина и пепсиногена улучшились в обеих группах, но статистически значимых межгрупповых различий не наблюдалось (p > 0,05) [25].
В более позднем исследовании 2022 г. пациенты (n = 64), перенесшие эндоскопическую подслизистую резекцию (ЭПР) по поводу аденомы или аденокарциномы желудка, также принимали ребамипид в течение одного года, при этом часть пациентов принимала плацебо [26]. Участвовали пациенты с активной инфекцией H. pylori (с обязательной эрадикацией перед включением в исследование) и без нее (в группе H. pylori-неинфицированных пациентов не уточняется, определялся ли аутоиммунный статус либо наличие признаков рефлюкс-гастрита). В группе ребамипида через один год лечения у неинфицированных пациентов наблюдались статистически значимые изменения в антральном отделе: снижение выраженности атрофии (до терапии ребамипидом – 1,880 ± 1,04, через один год терапии – 1,25 ± 0,894; р = 0,028) и выраженности кишечной метаплазии (КМ) (до терапии ребамипидом 1,84 ± 1,012, через один год терапии – 1,18 ± 0,912; р = 0,02) [26]. У пациентов, инфицированных H. pylori, через один год терапии не было выявлено существенных различий в тяжести атрофии и КМ между образцами (р > 0,05) [26]. Важно отметить, что в данном исследовании межгрупповые различия не оценивали (между пациентами, получавшими ребамипид и плацебо) [26]. Статистически значимых отличий при оценке атрофии и КМ в теле желудка в обеих группах (H. pylori-ассоциированный и H. pylori-интактный) выявлено не было [26]. Продемонстрирована безопасность длительной терапии ребамипидом, а среди побочных эффектов отмечались лишь запор и крапивница (два случая) [26]. Серологические показатели атрофии (уровень П-I и П-II, Г-17 не определяли).
В нашем сообщении представлен промежуточный этап рандомизированного исследования «ОПЛОТ» по оценке эффективности применения ребамипида в течение шести месяцев у пациентов с ХАГ.
Цель исследования – оценить результаты эффективности применения ребамипида в течение шести месяцев у пациентов с хроническим атрофическим гастритом различной этиологии.
Задачи исследования:
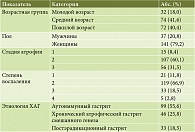
- представить характеристику пациентов с ХАГ, включенных в исследование, в зависимости от пола, возраста, а также в зависимости от стадии атрофии, степени воспаления и этиологии;
- проанализировать динамику серологических показателей атрофии и воспаления (П-I, П-II, П-I/П-II, Г-17) при проведении терапии ребамипидом у пациентов с ХАГ.
Материал и методы
В исследование «Оптимизация лечебно-диагностических подходов у пациентов с хроническим атрофическим гастритом» (ОПЛОТ) на базе СЗГМУ им. И.И. Мечникова включено 178 пациентов с морфологически подтвержденным (биопсии по OLGA) ХАГ различной этиологии, средний возраст – 57,0 (48–65) лет; все пациенты – жители г. Санкт-Петербурга и Ленинградской области, которые обратились за амбулаторной медицинской помощью по поводу патологии органов пищеварения.
В зависимости от этиологии ХАГ все пациенты были разделены на три группы: первая (n = 99) – аутоиммунный ХАГ, вторая (n = 33) – пациенты с постэрадикационным ХАГ, третья группа (n = 46) – смешанная этиология (постэрадикационный + аутоиммунный ХАГ). Критериями невключения были первая стадия постэрадикационного ХАГ, неэффективная эрадикационная терапия у пациентов с положительным H. pylori-статусом, наличие дисплазии слизистой оболочки желудка, резекция желудка в анамнезе, постоянный прием НПВП, ИПП, возраст старше 74 лет и младше 18, хронические заболевания в стадии декомпенсации, беременность, психические заболевания, отказ от участия в исследовании. У всех пациентов определяли уровень П-I, П-II, Г-17, соотношение П-I/П-II в крови, антител IgG к H. pylori. Для верификации АИГ проводили анализ крови на антитела к париетальным клеткам и внутреннему фактору Касла. Уточнение статуса H. pylori осуществлялось посредством оценки наличия антигена бактерии в кале. В дальнейшем каждую группу случайным образом делили на основную (прием ребамипида в течение 12 месяцев в дозе 300 мг/сутки) и контрольную подгруппы (без терапии ребамипидом). Через шесть месяцев (промежуточные результаты) проводили клинико-лабораторное обследование в динамике с оценкой уровня П-I, П-II, Г-17, соотношения П-I/П-II в крови.
Статистический анализ данных выполняли с использованием программы StatTech v. 3.0.9 (ООО «Статтех», Россия). Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Шапиро – Уилка (при числе исследуемых менее 50) или критерия Колмогорова – Смирнова (при числе исследуемых более 50). Количественные показатели, имеющие нормальное распределение, описывали с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95%-ного доверительного интервала (95% ДИ). В случае отсутствия нормального распределения количественные данные описывали посредством медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Категориальные данные представлены с указанием абсолютных значений и процентных долей. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, проводили с применением U-критерия Манна – Уитни. Сравнение процентных долей при анализе многопольных таблиц сопряженности выполняли с использованием критерия хи-квадрат Пирсона. Сравнение трех и более групп по количественному показателю, распределение которого отличалось от нормального, производили при помощи критерия Краскела – Уоллиса. При сравнении нормально распределенных количественных показателей, рассчитанных для двух связанных выборок, использовали парный t-критерий Стьюдента.
При сравнении количественных показателей, распределение которых отличалось от нормального, в двух связанных группах использовали критерий Уилкоксона. Различия считались статистически значимыми при p < 0,05.
Результаты
Наибольшую часть пациентов составили женщины (79,2%), преобладающими возрастными группами были средний и пожилой возраст (41,6 и 40,4% соответственно). Наиболее часто у участников исследования выявляли атрофию второй и третьей стадий (56 и 31,9% соответственно), при оценке локализации атрофии в основном наблюдалось поражение тела желудка (53,6%). Распределение пациентов в зависимости от стадии атрофии и степени воспаления представлено в табл. 1.
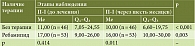
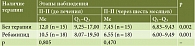
В группе ХАГ аутоиммунной этиологии в обеих подгруппах (контрольная и основная) отмечалось статистически значимое снижение уровня П-I через шесть месяцев наблюдения (табл. 2), что может указывать как на прогрессирование атрофии, так и на физиологическое колебание показателя.
В подгруппе терапии ребамипидом была выявлена тенденция к снижению уровня П-II, в контрольной подгруппе отмечался некоторый рост П-II, что указывает на снижение выраженности воспаления в основной подгруппе в отличие от контрольной, хотя статистически значимых межгрупповых отличий выявлено не было (р = 0,075) (табл. 3).
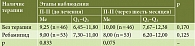
При анализе динамики соотношения уровней П-I/П-II выявлен статистически значимый рост показателя у пациентов, получавших шестимесячную терапию ребамипидом (р < 0,001), при снижении П-I/П-II в подгруппе контроля (р < 0,001) (табл. 4), что указывает на обратное развитие атрофии в основной подгруппе и прогрессирование атрофии в контрольной группе.
Анализ уровня Г-17 при ХАГ аутоиммунной этиологии представлен в табл. 5. Однако корректно оценить данный показатель и его динамику с учетом референсных значений лабораторных наборов не представляется возможным.
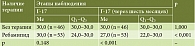
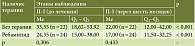
Анализ серологических маркеров атрофии и воспаления у пациентов с постэрадикационным ХАГ показал, что через шесть месяцев наблюдения в обеих подгруппах (основная и контрольная) выявлено статистически значимое снижение уровня П-I (p = 0,002 и р = 0,01 соответственно); при этом статистически значимых межгрупповых различий в динамике показателей выявлено не было (р = 0,777), что может указывать на регресс воспалительных изменений в обеих подгруппах (табл. 6).
Аналогичные данные получены при анализе уровня П-II: выявлено снижение данного показателя в подгруппе терапии ребамипидом (р = 0,001) и без терапии (р = 0,002), без статистически значимых межгрупповых отличий (р = 0,47) (табл. 7).
Проведенный анализ показал, что в обеих подгруппах отмечается статистически незначимое повышение соотношения П-I/П-II без статистически значимых межгрупповых отличий (р = 0,451), что указывает на отсутствие динамики основного серологического маркера атрофии в указанной подгруппе пациентов (табл. 8).
При анализе динамики уровня Г-17 при постэрадикационном ХАГ статистически значимых различий (р > 0,05) в обеих подгруппах не выявлено (табл. 9).
Анализ серологических маркеров атрофии и воспаления у пациентов ХАГ смешанного генеза выявил статистически значимое снижение уровня П-I через шесть месяцев наблюдения в обеих подгруппах (р < 0,001) без межгрупповых статистически значимых различий (р = 0,433), что указывает на снижение воспалительного процесса в обеих подгруппах (табл. 10).
Аналогичная динамика отмечалась при анализе уровня П-II – в обеих подгруппах (р < 0,001) выявлено статистически значимое снижение без межгрупповых статистически значимых различий (р = 0,436) (табл. 11).
При анализе динамики соотношения П-I/П-II и уровня Г-17 в обеих подгруппах у пациентов ХАГ смешанной этиологии статистически значимых отличий выявлено не было (р > 0,05).
Обсуждение
В данной публикации мы привели промежуточные результаты исследования «ОПЛОТ». Анализ динамики серологических показателей атрофии и воспаления в целом показал, что наиболее корректная их оценка возможна только при разделении выборки в зависимости от этиологии гастрита. Данное исследование позволило оценить динамику П-I, П-II, Г-17, П-I/П-II при естественном течении и при проведении терапии ребамипидом у пациентов с ХАГ различной этиологии. При анализе литературы нами не было найдено публикаций, демонстрирующих динамику серологических маркеров атрофии и воспаления при аутоиммунном ХАГ. Нами получены результаты, указывающие, что в группе пациентов с ХАГ аутоиммунной этиологии, получавших ребамипид в течение шести месяцев, имела место положительная динамика маркеров, отражающих регресс атрофии (П-I/П-II) при снижении П-II, отражающем воспаление, в то время как снижение П-I может отражать физиологические колебания показателя. C другой стороны, в контрольной подгруппе получены данные, свидетельствующие о нарастании атрофии (снижение П-I и снижение П-I/П-II) и воспаления (повышение П-II). Полученные результаты свидетельствуют об обратном развитии атрофии при ХАГ аутоиммунной этиологии только при применении ребамипида. Тем не менее необходим более длительный период наблюдения для исключения «физиологических» колебаний маркеров атрофии.
Успешная эрадикация H. pylori позволяет увидеть положительную динамику уровня пепсиногенов как маркеров атрофии (П-I), так и воспаления (П-II), что было показано в литературе ранее [25]. В нашем исследовании мы также получили результаты, указывающие на положительную динамику указанных маркеров у пациентов без терапии и после терапии ребамипидом, что могло быть связано с эрадикацией хеликобактерной инфекции. По-видимому, в будущем будет интересно сравнить динамику серологических показателей атрофии и воспаления в различные сроки после эрадикации, а также скорость и динамику регресса воспаления. Те же причины не могли позволить корректно оценить динамику серологических маркеров у пациентов с ХАГ смешанной этиологии: недавняя эрадикационная терапия могла способствовать снижению уровней П-I и П-II в обеих подгруппах.
Заключение
Среди пациентов с аутоиммунным ХАГ получены обнадеживающие результаты, указывающие на регресс атрофии и снижение воспаления в подгруппе пациентов, получавших терапию ребамипидом в течение шести месяцев.
У пациентов с постэрадикационным и смешанным ХАГ выявлены изменения, указывающие на регресс воспаления без признаков обратного развития атрофии.
Авторы заявляют об отсутствии конфликта интересов.
I.G. Bakulin, PhD, Prof., A.G. Sushilova, A.V. Zharkov, PhD, V.A. Malkov
Mechnikov North-Western State Medical University, Saint Petersburg
Healthcare Committee of the Leningrad Region, Saint Petersburg
Saint-Petersburg State University (SPSU) N.I. Pirogov Clinic of High Medical Technologies, Saint Petersburg
Contact person: Anastasia G. Sushilova, Anastasiya.s1311@gmail.com
The aim is to evaluate the results of effectiveness of rebamipide use for 6 months in patients with chronic atrophic gastritis (CAG) of various etiologies.
Material and methods. The OPLOT study at the North-Western State Medical University named after I.I. Mechnikov included 178 patients aged 20 to 74 years with morphologically confirmed CAG of various etiologies, average age 57 (48–65) years. Depending on the etiology of CAG, all patients were divided into 3 groups: group 1 (n = 99) – autoimmune CAG, group 2 (n = 33) – patients with post-eradication CAG, group 3 (n = 46) – mixed etiology (post-eradication + autoimmune CAG). Each group was then randomly divided into the main (rebamipide intake for 12 months at a dose of 300 mg/day) and control subgroups (without rebamipide therapy). After 6 months (intermediate results), a clinical and laboratory examination was carried out to assess the level of pepsinogen-I (P-I), pepsinogen-II (P-II), gastrin-17 (G-17), the ratio of pepsinogen-I to pepsinogen-II (P-I/P-II) in the blood.
Results. Among patients with autoimmune CAG in the main subgroup, a statistically significant increase
in the P-I/P-II ratio was observed (p < 0.001), indicating regression of atrophy, decrease in G-17 (p < 0.001), with a decrease in P-I in both subgroups (p < 0.001, p = 0.003, respectively). In the group with post-eradication CAG, positive dynamics were found in the rebamipide subgroup for the P-I and P-II indices (p < 0.05). However, the assessment of the P-I/P-II ratio in both subgroups didn’t show any dynamics (p = 0.451).In patients with CAG of mixed genesis, positive dynamics were determined in the rebamipide subgroup in terms of the P-I and P-II levels (p < 0.001). When analyzing the dynamics of the P-I/P-II ratio and the G-17 level, no statistically significant differences were noted in the subgroups (p > 0.05).
Conclusion. The use of rebamipide for 6 months leads to positive dynamics of serological markers of atrophy in patients with autoimmune CAG. There were no differences found between the dynamics of the P-I/P-II index in the rebamipide subgroup and the control in patients with post-eradication CAG and CAG of mixed etiology.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.