Влияние резистентности H. pylori к кларитромицину на эффективность эрадикационной терапии первой линии: предварительные результаты проспективного исследования
- Аннотация
- Статья
- Ссылки
- English

Введение
Выявление этиологической роли Нelicobacter pylori (H. pylori) в развитии заболеваний желудка произвело революцию в подходах к их лечению и профилактике [1, 2]. Всемирная организация здравоохранения (ВОЗ) признала данный патоген канцерогеном I класса [3]. Согласно обобщенным данным, до 89% случаев дистального рака желудка связаны с инфекцией H. pylori [4]. Согласно консенсусу Маастрихт VI, H. pylori является основным этиологическим фактором аденокарциномы желудка, включая проксимальный рак желудка. При этом воздействие факторов внешней среды второстепенно по отношению к роли инфекции H. pylori. H. pylori всегда вызывает хронический гастрит, который может прогрессировать до тяжелых осложнений, таких как язвенная болезнь, аденокарцинома желудка и MALT-лимфома [5–7]. Данное положение нашло отражение в рекомендациях Российской гастроэнтерологической ассоциации (РГА) [8]. Эрадикация H. pylori рассматривается в качестве стратегии первичной профилактики рака желудка [9].
В России распространенность инфекции H. pylori в 2017 г. составила 41,8%, в 2019 г. – 36,4% [10]. По данным недавно опубликованного метаанализа, в Москве до 2015 г. распространенность инфекции H. pylori была 81,294% (95%-ный доверительный интервал (95% ДИ) 67,202–92,109), в 2015–2020 гг. – 68,028% (95% ДИ 29,383–95,895), а после 2020 г. снизилась до 39,860% (95% ДИ 33,993–45,877). Метарегрессионный анализ показал коэффициент регрессии -4,22% в год (95% ДИ -6,27–(-2,17), p < 0,0099) [11].
С момента открытия H. pylori были изучены различные антибактериальные препараты для эрадикации, при этом амоксициллин и кларитромицин остаются препаратами схем первой линии. Вместе с тем в последние годы отмечается снижение эффективности стандартной тройной терапии (ИПП, кларитромицин, амоксициллин) [12]. По данным Европейского регистра по ведению инфекции H. pylori (Hp-EuReg), еще в период до пандемии COVID-19 тройную терапию с кларитромицином и амоксициллином в России прописывали 56% больных, при этом ее эффективность составляла 80% [13]. Одной из ведущих причин неэффективности терапии является растущая резистентность бактерии к кларитромицину [14]. По данным метаанализа, в России отмечен значимый рост резистентности H. pylori к кларитромицину – с 11,903% в 2015 г. до 21,024% в 2020–2024 гг. (р = 0,0049) [15]. При молекулярно-генетическом исследовании 112 биоптатов от H. pylori-позитивных пациентов в Москве (2022–2023) мутации гена 23S рРНК устойчивости к кларитромицину были обнаружены в 27 (24%) образцах (2143G – в 74%, 2142G – в 22%, 2142C – в 4%) [16].
Основными точечными мутациями, связанными с устойчивостью к кларитромицину, являются мутации A2142G, A2143G (переход аденина в гуанин в позиции 2142 или 2143), A2142C (трансверсия аденина в цитозин в позиции 2142), A2115G, A2144T, G2141A, G2144T, T2289C, T2717C и C2694A [17]. Информация об устойчивости H. pylori может способствовать более эффективному лечению, в том числе путем индивидуализированной терапии [18]. Это особенно важно, поскольку ВОЗ отнесла H. pylori к 12 наиболее устойчивым бактериям в мире [19].
В регионах с уровнем резистентности H. pylori к кларитромицину ≥ 15% рекомендуется использование четырехкомпонентных схем лечения [20]. В России доказана эффективность 14-дневных схем с двумя антибиотиками с использованием высоких доз ингибиторов протонной помпы (ИПП) – эзомепразола или рабепразола, включением висмута трикалия дицитрата (ВТД), а, кроме того, в качестве адъюванта рекомендовано применение ребамипида, определенных штаммов пробиотиков и обеспечение высокой приверженности больных лечению [8, 21].
Доказательная база применения адъювантных препаратов расширяется. Было показано, что добавление ВТД к 14-дневной стандартной тройной терапии позволяет обеспечить уровень эффективности эрадикации, превышающий 90% [22–24]. При анализе данных 3001 пациента Европейского регистра Hp-EuReg, получавших стандартную тройную терапию с кларитромицином, усиленную ВТД в течение 14 дней, эрадикация достигнута в 92,4% случаев [25]. Кроме того, по материалам Hp-EuReg показано, что при наличии резистентности к кларитромицину эффективность тройной терапии снижается до 75% (9 из 12 пациентов), в то время как добавление ВТД позволяет обеспечить эрадикацию у 90% (9 из 10) пациентов [26].
Преимущества ребамипида при включении его в состав эрадикационной терапии доказаны в ряде метаанализов. Так, метаанализ шести рандомизированных контролируемых исследований (РКИ) с участием 611 пациентов в 2014 г. впервые показал, что отношение шансов (ОШ) успешной эрадикации при добавлении ребамипида составляет 1,74 (95% ДИ 1,19–2,53), при этом частота развития побочных эффектов не нарастает – ОШ 0,69 (95% ДИ 0,376–1,300; р = 0,329) [27]. Эти данные были подтверждены в метаанализе 11 РКИ, опубликованном в 2019 г.: ОШ успешной эрадикации 1,753 (95% ДИ 1,312–2,343; p < 0,001) [28]. Метаанализ отечественных исследований с выборкой 531 пациента (в группах с ребамипидом (Ребагит) – 273, в группах без ребамипида – 258). Обобщенная эффективность схем эрадикации с Ребагитом составила 90,4% (95% ДИ 86,3–93,6), в то время как без ребамипида – 81,6% (95% ДИ 76,5–86,1). Добавление ребамипида в схемы эрадикации повышает эффективность лечения – ОШ 2,162 (95% ДИ 1,268–3,685; p = 0,005) и приводит к снижению частоты побочных явлений – ОШ 0,569 (95% ДИ 0,333–0,970; p = 0,038) [29].
Таким образом, ранее опубликованные исследования демонстрируют, что добавление ВТД и ребамипида повышает эффективность эрадикации H. pylori. При этом данные о роли указанных препаратов в преодолении резистентности H. pylori к кларитромицину ограничены. Это определяет актуальность оценки эффективности рекомендуемых режимов эрадикационной терапии с учетом информации о резистентности H. pylori к кларитромицину.
Цель исследования – оценка эффективности стандартной тройной терапии при добавлении ВТД или комбинации ВТД с ребамипидом с учетом молекулярно-генетических маркеров резистентности H. pylori к кларитромицину.
Материал и методы
В Московском клиническом научном центре им. А.С. Логинова проводится проспективное исследование, в которое планируется включить 120 H. pylori-позитивных пациентов, ранее не получавших эрадикационную терапию. Выборка формируется из когорты респондентов «Эпидемиологического исследования распространенности инфекции Helicobacter pylori в г. Москве» (соглашение № 0903-1/22 от 21.03.2022). К настоящему времени проанализированы результаты лечения 85 больных.
Для выявления H. pylori используется 13C-уреазный дыхательный тест (13С-УДТ). В биоптате из антрального отдела желудка определены молекулярно-генетические маркеры резистентности к кларитромицину в 23S рРНК методом полимеразно-цепной реакции. Пациенты в зависимости от наличия резистентности к кларитромицину были рандомизированы на четыре группы и получали четырехкомпонентную (эзомепразол 80 мг в сутки, кларитромицин 1000 мг в сутки, амоксициллин 2000 мг в сутки, ВТД 480 мг в сутки) или пятикомпонентную терапию (те же препараты с добавлением ребамипида (Ребагит) 300 мг в сутки) в течение 14 дней. Контроль эффективности лечения проведен с помощью 13С-УДТ не ранее чем через 30 дней после завершения терапии.
Результаты
Все пациенты, включенные в это предварительное исследование, приняли более 90% препаратов и прошли контрольный 13С-УДТ, поэтому представленные данные являются анализом per protocol. Эффективность эрадикации в первой и второй группах, включавших пациентов с H. pylori, чувствительной к кларитромицину, составила 96 и 90% соответственно. В третьей и четвертой группах у H. pylori были выявлены мутации, отражающие резистентность к кларитромицину. При этом в третьей группе (пятикомпонентная терапия с Ребагитом) отмечена эрадикация в 95%, а в четвертой группе (четырехкомпонентная терапия) – в 66% случаев (таблица).
Обсуждение
Представленные предварительные данные свидетельствуют о том, что добавление комбинации ВТД и ребамипида к стандартной тройной терапии обеспечивает должный уровень эрадикации H. pylori (95%) при применении схемы с кларитромицином, несмотря на выявление молекулярно-генетических маркеров резистентности к этому антибиотику. Это является дополнительным подтверждением возможности применения схем с кларитромицином и адъювантными препаратами как одной из стратегий повышения эффективности терапии. Достижение успеха эмпирической терапии первой линии имеет важное значение для предотвращения развития вторичной лекарственной устойчивости H. pylori [30].
Полученные нами сведения о низкой эффективности тройной терапии с кларитромицином, усиленной ВТД при наличии резистентности к кларитромицину (66%), мы считаем предварительными и не исключаем возможность переоценки после завершения набора пациентов. Наши результаты не соотносятся с данными, полученным в Европейском регистре Hp-EuReg, где добавление к стандартной тройной терапии с кларитромицином ВТД обеспечило эрадикацию у 9 из 10 пациентов с подтвержденной резистентностью к этому антибиотику [24].
В Китае было проведено исследование с участием 160 пациентов с выявленной H. pylori и оцененной резистентностью H. pylori к кларитромицину. Больные были рандомизированы в две группы по 80 человек, которые получали омепразол 20 мг, амоксициллин 1000 мг, кларитромицин 500 мг и ВТД 220 мг два раза в день семь или 14 дней. Через шесть недель после лечения была оценена эффективность терапии с помощью 13C-УДТ. Показана большая эффективность 14-дневной терапии по сравнению с семидневной – в анализе intention-to-treat (93,7% в сравнении с 80,0%; p = 0,01) и анализе per protocol (97,4% в сравнении с 82,0%; p = 0,0016). Показатели резистентности H. pylori к метронидазолу, кларитромицину и амоксициллину составили 42,1; 18,0 и 0% соответственно. У пациентов с резистентными к кларитромицину штаммами H. pylori семидневный режим обеспечил эрадикацию в 36,3% (4 из 11 человек), 14-дневный – в 84,6% (11 из 13 человек) [31].
Добавление ВТД в схемы эрадикационной терапии первой линии оказывает выраженное влияние на снижение риска развития устойчивости H. pylori к кларитромицину. В отличие от антибиотиков, воздействующих на определенные мишени в бактериальной клетке (например, рибосомы или ферменты синтеза ДНК), висмут оказывает неспецифическое токсическое действие на множество структур бактерии, не провоцируя мутагенез и не индуцируя экспрессию генов устойчивости [32].
Одним из механизмов эффективности ВТД является способность разрушать биопленки, формируемые H. pylori. Биопленки снижают проницаемость клеточной массы для антибиотиков и формируют микроэкологию с низким уровнем метаболизма, в которой бактерии становятся менее чувствительными к воздействию макролидов [33]. Разрушение биопленок висмутом способствует повышению концентрации кларитромицина в непосредственной зоне действия и усиливает его антимикробный эффект. Кроме того, опубликованы данные о способности висмута ингибировать активность бактериальных эффлюксных насосов, таких как hefABC и hefEFG, которые участвуют в выведении кларитромицина из бактериальной клетки [34].
Опубликованные метаанализы свидетельствуют, что ребамипид значительно повышает эффективность эрадикации H. pylori [27–29]. Антагонистические эффекты препарата на H. pylori включают ингибирование бактериальной адгезии и колонизации слизистой оболочки желудка и подавление эффектов, вызванных H. pylori, таких как продукция фактора некроза опухоли альфа (ФНО-α), индукция β-катенина, активация NF-кB, продукция интерлейкина 8 (ИЛ-8) и окислительные эффекты нейтрофилов. Ребамипид ингибирует уреазу, которая оказывает цитотоксический эффект на слизистую оболочку желудка. Препарат восстанавливает экспрессию sonic hedgehog (сигнального белка, который играет решающую роль в дифференцировке эпителиальных клеток) в слизистой оболочке желудка монгольских песчанок с инфекцией H. pylori. Это привело к омоложению атрофированной слизистой оболочки желудка в модели животных [35].
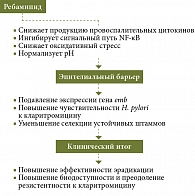
Ребамипид представляет собой производное хинолона, обладающее доказанными гастропротективными, противовоспалительными и антиоксидантными свойствами. Изначально разработанный как цитопротектор, препарат в последние годы привлекает внимание как адъювант при лечении H. pylori. На молекулярном уровне одним из ключевых механизмов, обусловливающих его эффективность, является способность ребамипида ингибировать адгезию H. pylori к эпителию желудка. Этот процесс реализуется посредством подавления экспрессии рецепторов Lewis-антигенов и мембранных белков бактерии, таких как BabA и SabA, ответственных за прикрепление к слизистой оболочке. Снижение бактериальной адгезии не только ограничивает возможность персистенции возбудителя, но и уменьшает вероятность формирования биопленок, обладающих высокой толерантностью к антибактериальной терапии. Кроме того, установлено, что ребамипид снижает продукцию провоспалительных цитокинов (в частности, ИЛ-8, ФНО-α) и ингибирует активацию сигнального пути NF-κB, что способствует стабилизации воспалительного микроокружения слизистой оболочки желудка. Такая стабилизация снижает локальную кислотность и окислительный стресс, обеспечивая более благоприятные условия для действия антибиотиков, включая кларитромицин (рисунок). Имеются данные, свидетельствующие о способности ребамипида опосредованно модулировать экспрессию генов H. pylori, связанных с механизмами устойчивости к макролидам, в том числе гена erm(B), кодирующего метилтрансферазу, участвующую в модификации рибосомной мишени антибиотика. В ряде исследований продемонстрировано снижение транскрипции этих генов под действием ребамипида, что, вероятно, снижает порог устойчивости H. pylori к кларитромицину. Ребамипид также оказывает стабилизирующее влияние на барьерную функцию слизистой, улучшая межклеточные контакты и способствуя равномерному распределению антибиотика в слизистом слое. Это уменьшает вероятность формирования микросред с субтерапевтическими концентрациями антибиотика, которые могут способствовать селекции устойчивых штаммов [36, 37].
Клиническая значимость описанных механизмов подтверждается данными проспективных и ретроспективных исследований. Включение ребамипида в стандартные схемы терапии демонстрирует достоверное повышение частоты эрадикации, особенно у пациентов с исходной сниженной чувствительностью H. pylori к кларитромицину.
Таким образом, ребамипид, не обладая собственной антимикробной активностью, способен модулировать биологические и физиологические процессы, способствующие повышению эффективности антихеликобактерной терапии и снижению риска формирования устойчивости H. pylori к кларитромицину. Это обосновывает его потенциальное включение в состав комбинированных схем терапии, особенно в условиях растущей антибиотикорезистентности. Ребамипид повышает эффективность схем эрадикации H. pylori при его использовании в качестве средства адъювантной (дополнительной) терапии. Ребамипид не обладает собственным прямым антихеликобактерным действием, однако в экспериментальных работах показано, что он ингибирует адгезию H. pylori к эпителиальным клеткам слизистой оболочки желудка, а также снижает активацию NF-κB и продукцию ИЛ-8, индуцированную микроорганизмом [38].
Данные, полученные в международных и отечественных клинических исследованиях, позволяют рекомендовать ребамипид для включения в схемы эрадикационной терапии H. pylori [39].
Заключение
Резистентность H. pylori к кларитромицину остается одним из ключевых факторов неудач эрадикационной терапии первой линии и представляет серьезный вызов для клинической практики. Представленные данные демонстрируют, что добавление ВТД и ребамипида к препаратам стандартной тройной терапии (ИПП, кларитромицин, амоксициллин) достоверно повышает эффективность эрадикации H. pylori даже при наличии подтвержденной резистентности к кларитромицину.
Статья подготовлена в рамках реализации научно-практического проекта в сфере медицины «Эпидемиологическое исследование распространенности инфекции Helicobacter pylori в г. Москве» (соглашение №0903-1/22 от 21.03.2022).
V.V. Polyakova, N.A. Bodunova, PhD, L.A. Tsapkova, PhD, V.V. Serebryakov, K.A. Nikolskaya, PhD, M.V. Chebotareva, I.N. Voinovan, PhD, E.A. Sabelnikova, PhD, Prof., D.S. Bordin, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
Russian University of Medicine, Moscow
Tver State Medical University
Contact person: Vera V. Polyakova, verapolykova@mail.ru
H. pylori resistance to clarithromycin remains a key factor in the failure of eradication therapy. One option to improve the effectiveness is to add additional drugs to the treatment regimens. Previously, studies were conducted on the effectiveness of such a strategy with the addition of bismuth or rebamipide drugs. However, data on the use of these drugs to overcome the resistance of H. pylori to clarithromycin are limited. A prospective study is being conducted at the A.S. Loginov Moscow Clinical Scientific Center, which includes patients with confirmed H. pylori infection and assessed molecular genetic resistance of bacteria to clarithromycin. All patients receive 14-day eradication therapy: esomeprazole 80 mg / day, amoxicillin, clarithromycin, bismuth tripotassium dicitrate in standard doses. Two groups of patients (with sensitive and resistant H. pylori strains) additionally included rebamipide 100 mg 3 times a day for 14 days. Preliminary data indicate high efficiency of 5-component therapy in patients with confirmed resistance of H. pylori to clarithromycin (95%).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.