Энтеральное питание «Модуленом IBD» как метод патогенетической терапии воспалительных заболеваний кишечника
- Аннотация
- Статья
- Ссылки

Поскольку клиническая картина данных заболеваний характеризуется наличием выраженных в той или иной степени синдромов диареи, мальабсорбции, в ряде случаев – стенозов и кровотечений, у большинства пациентов отмечаются нарушения питания. Это выражается в снижении массы тела, уменьшении содержания в крови общего белка, альбумина, гемоглобина. У этих пациентов, особенно в период обострения, определяется отрицательный баланс азота, дефициты белка, железа, кальция, магния, фолиевой кислоты [2, 5].
В лечении пациентов с язвенным колитом и болезнью Крона традиционно используют противовоспалительные препараты группы 5‑аминосалициловой кислоты (салофальк, сульфасалазин), кортикостероиды (будесонид, преднизолон), иммуносупрессанты (азатиоприн), ингибиторы фактора некроза опухоли (инфликсимаб). Данные препараты влияют на патогенез заболевания и уменьшают острые признаки воспалительного синдрома, но практически не оказывают действия на статус питания этих больных, симптомы недостаточности питания, гипо- или авитаминозов, анемии, в ряде случаев – признаки остеопороза, алопеции и гипогонадизма сохраняются [3].
Ещё в 70‑е годы прошлого века господствовала концепция о необходимости «отдыха кишечника», а пациентам с болезнью Крона и язвенной болезнью в острой фазе назначалось полное парентеральное питание. Начиная с середины 80‑х годов прошлого века, эта концепция сменилась представлением о целесообразности назначения раннего энтерального питания этим больным в связи с тем, что поступление питательных веществ из просвета улучшает репарацию поврежденной слизистой оболочки тонкой и толстой кишки [11, 13].
Для этих целей могут быть назначены полностью сбалансированные питательные смеси для энтерального питания. Одной из таких современных питательных смесей является «Модулен IBD» («Нестле», Швейцария), специально предназначенный для питания пациентов с воспалительными заболеваниями кишечника. В 100 г сухой смеси «Модулен IBD» содержится 18 г молочного белка, 23 г жиров, 54 г углеводов, 14 макро- и микроэлементов и 13 витаминов. Энергетическая ценность 100 г смеси составляет 500 ккал, осмолярность – 270 мосм/л.
Особенностью состава смеси «Модулен IBD», которая обеспечивает ее лечебные свойства, является наличие противовоспалительного фактора роста слизистой оболочки (TGF-b2), который снижает исходно повышенные уровни интерлейкина-1, интерлейкина-8 и гамма-интерферона в слизистой оболочке кишечника этих больных.
Смесь «Модулен IBD» предназначена для перорального приема или для зондового энтерального питания. Она может назначаться как дополнение к основному рациону питания в количестве 1–3 стаканов в день или в качестве единственного источника питания.
Применение «Модулена IBD» у пациентов с воспалительными заболеваниями кишечника позволяет:
- обеспечить адекватное поступление нутриентов и энергии;
- компенсировать дефицит белков, железа, кальция, других макро- и микроэлементов и витаминов;
- ускорить наступление ремиссии заболевания за счет снижения активности воспаления и усиления репарации поврежденной слизистой оболочки.
У взрослых с болезнью Крона энтеральное питание в качестве монотерапии применяется, только в тех случаях, когда лечение кортикостероидами неэффективно или привело к возникновению осложнений (сахарный диабет, остеопороз, синдром Кушинга, и др.) [9].
В составе комплексной медикаментозной терапии энтеральное питание этим больным назначается при тотальном и субтотальном поражении толстой кишки, при вовлечении в процесс тонкой кишки, а также после хирургических вмешательств (резекций кишечника). При наличии выраженного синдрома мальабсорбции предпочтительнее не пероральное, а зондовое энтеральное питание.
У детей до 12 лет с болезнью Крона энтеральное питание является терапией первого выбора (в качестве монотерапии) и оно эффективно для достижения ремиссии вне зависимости от активности процесса и локализации поражения [6, 7, 10].
У больных язвенным колитом энтеральное питание назначается при наличии признаков недостаточности питания, дефицита макро- и микронутриентов. В качестве монотерапии ни парентеральное, ни энтеральное питание в настоящее время не используются [8].
Нами проведено проспективное открытое контролируемое клиническое исследование, целью которого было оценить эффективность нутриционной поддержки сбалансированной энтеральной питательной смесью «Модулен IBD» у пациентов с воспалительными заболеваниями кишечника на фоне комплексной терапии.
Материал и методы исследования
Исследование проводилось в клинике пропедевтики внутренних болезней с курсом нутрициологии и клинического питания Санкт-Петербургской государственной медицинской академии имени И. И. Мечникова. В исследование участвовали 24 пациента с болезнью Крона и язвенным колитом и, госпитализированные в связи с обострением заболевания. Средний возраст больных составил 36,8 ± 10,4 лет.
Для выявления недостаточности питания у данной группы пациентов в соответствии с требованиями приказа Министерства здравоохранения РФ № 330 (2006 г.) использовали следующие показатели: индекс массы тела (ИМТ) < 19 кг/м 2, окружность плеча < 26 см (для мужчин) и < 25 см (для женщин), толщина кожно-жировой складки над трицепсом (ТКСТ) < 9,5 мм (для мужчин) и < 13 мм (для женщин), общий белок крови < 65 г/л, альбумин сыворотки крови < 35 г/л.
Все пациенты получали базисную медикаментозную терапию, включающую препараты 5‑аминосалициловой кислоты (сульфасалазин, салофальк) и кортикостероиды (преднизолон).
Все пациенты были разделены на две группы:
- Основная группа (14 человек): 5 пациентов с болезнью Крона и 9 пациентов с язвенным колитом. Эти пациенты получали в дополнение к базисной терапии и обычному диетическому питанию смесь «Модулен IBD» в объеме 400–600 мл в день в течение 12–14 дней. Смесь назначалась в 2–3 приема между основными приемами пищи небольшими порциями (методом «сипинга»).
- Контрольная группа (10 человек): 3 пациентов с болезнью Крона и 7 пациентов с язвенным колитом. В эту группу вошли пациенты, получали только базисную медикаментозную терапию и диетическое питание. Нутриционная поддержка смесью «Модулен IBD» не проводилась.
При обследовании исходного нутриционного статуса (состояния питания) у 17 пациентов были выявлены признаки недостаточности питания по типу «маразма» (истощение мышечного белка), у 7 пациентов – по типу «маразм-квашиоркор» (истощение как мышечного, так и сывороточного белка).
Значимых различий по полу, возрасту, локализации поражения в кишечнике, тяжести течения заболевания и типу имеющейся недостаточности питания в основной и контрольной группах не было.
Оценка статуса питания и эффективности проводимой нутриционной поддержки оценивалась по следующим показателям:
- индекс массы тела и динамика массы тела;
- компонентный анализ состава тела (биоимпедансный анализ с помощью прибора «Диамант-АСТ») с определением массы жировой ткани (абсолютное количество жира) и тощей массы тела (обезжиренная масса тела);
- окружность плеча и мышц плеча (соматический белок);
- толщина кожно-жировых складок в стандартных точках на бицепсе, под лопаткой и в паховой области (с помощью калипера);
- содержание общего белка и альбумина крови (висцеральный белок).
Статистическую обработку данных проводили с помощью пакета прикладных программ SPSS Statistics 17.0 (США). Для статистического сравнения основной и контрольной групп был использован критерий χ‑квадрат (критерий согласия Пирсона). В том случае, если ожидаемое число наблюдений в некоторых ячейках четырехпольной таблицы было менее 5, для определения уровня статистической значимости использовался точный критерий Фишера. Для статистического сравнения основной и контрольной групп с помощью критерия χ‑квадрат использовался следующий алгоритм:
- Для каждого из изучаемых показателей нутриционного статуса были построена четырехпольная таблица, фактором воздействия рассматривалось дополнительное энтеральное питание смесью «Модулен IBD», отсутствием фактора воздействия считалась обычная диета. За положительный эффект принимали увеличение значения изучаемого показателя нутриционного статуса в динамике, за отрицательный (табл. 1).
- Построенные для каждого из показателей нутриционного статуса четырехпольные таблицы были проанализированы с помощью критерия χ‑квадрат, в результате чего были получены данные о достигнутом уровне статистической значимости (p).
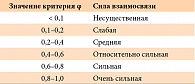
- Помимо статистической проверки гипотез, был проведен анализ «величины эффекта», то есть силы взаимосвязи между фактором (проведение нутриционной поддержки смесью «Модулен IBD») и полученным эффектом (повышение значения показателя нутриционного статуса). Для этой цели был использован критерий φ, оценка полученного значения критерия проводилась согласно рекомендациям Rea и Parker [1]. Интерпретация значения критерия φ представлена в таблице 2.
Результаты исследования и их обсуждение
Учитывая статистически выраженное отклонение распределения вариационного ряда значений изучаемых показателей от нормального и небольшого объема выборки, для корректного отображения данных описательной статистики выбрано представление медианы, максимума и минимума значений показателей нутриционного статуса в основной и в контрольной группах до и после курса лечения.
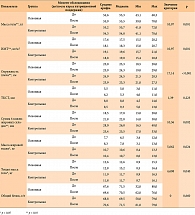
Динамика показателей нутриционного статуса в основной и контрольной группах, значение критерия χ‑квадрат (либо критерия Фишера) и достигнутые уровни статистической значимости представлены в таблице 3.
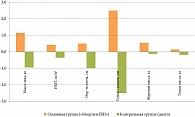
Статистически значимая динамика показателей нутриционного статуса представлена на рисунке 1.
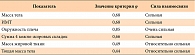
Сила взаимосвязи между фактором проведения нутриционной поддержки (дополнительного энтерального питания) и повышением значения показателей нутриционного статуса представлена в таблице 4.
Анализ клинических показателей свидетельствует о том, что следствием недостаточности питания и связанного с ней дефицита нутриентов и энергии в результате повышенных потерь белка через кишечник и активного воспалительного процесса является замедление репаративных процессов в слизистой оболочке тонкой и толстой кишки и, в конечном итоге, удлинение сроков ремиссии заболевания.
После курса нутриционной поддержки в виде дополнительного энтерального питания отмечалось статистически значимое увеличение массы тела (p < 0,01) и индекса массы тела (p < 0,01). Но наиболее важным клиническим эффектом нутриционной поддержки следует считать изменение компонентного состава организма за счет увеличения мышечной массы и белков крови, т. е. увеличение как соматического, так и висцерального пула белка. Данный факт подтверждается статистически значимым увеличением тощей массы тела (p < 0,05) и окружности плеча (p < 0,001), при этом наблюдается относительно сильная (для тощей массы тела) и очень сильная (для окружности плеча) взаимосвязь нутриционной поддержки и увеличения данных показателей нутриционного статуса. Не отмечено статистически значимого изменения уровня общего белка, что может объясняться тем, что у подавляющего большинства, участвовавших в исследовании пациентов наблюдалась недостаточность питания по типу «маразма», не сопровождающаяся значимым снижением уровня белков в крови.
Помимо увеличения мышечного белка и тощей массы тела, после курса нутриционной поддержки отмечено статистически значимое увеличение жировой массы (p < 0,05, относительно сильная взаимосвязь) и суммарной толщины 4 кожно-жировых складок (p < 0,01, сильная взаимосвязь).
Полученные результаты позволяют сделать вывод о том, что после курса нутриционной поддержки увеличивается масса соматической жировой ткани, при этом неизвестно, изменилось ли количество висцерального жира. Необходимо отметить, что толщина кожно-жировой складки трицепса достоверно не изменялась, что позволяет сделать предположение о перераспределении жира в организме в сторону увеличения жировых запасов на туловище, при этом количество жировой ткани на конечностях не увеличивается. Данное предположение можно подтвердить только исследованиями с использованием двухэнергетической рентгеновской абсорбциометрии, которая позволяет оценить не только жировую массу в целом, но количество жировой ткани на каждой из конечностей, однако использование данного метода ограничено высокой стоимостью исследования.
Таким образом, после проведенного курса нутриционной поддержки с помощью дополнительного энтерального питания смесью «Модулен IBD» у пациентов с обострением воспалительных заболеваний кишечника отмечено улучшение показателей нутриционного статуса, свидетельствующее об увеличении пластических и энергетических запасов организма. Наше исследование позволяет сделать вывод о том, что назначение дополнительного энтерального питания смесью «Модулен IBD» в составе комплексной терапии воспалительных заболеваний кишечника в фазе обострения существенно улучшает нутриционный статус пациента, способствует лечению недостаточности питания и повышает энергетические и пластические резервы организма.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.