Выбор режима дозирования устекинумаба у бионаивных пациентов с язвенным колитом при наличии факторов неблагоприятного прогноза (реальная клиническая практика)
- Аннотация
- Статья
- Ссылки
- English
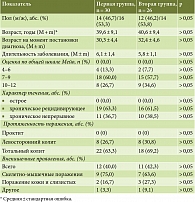
Материал и методы. В исследовании приняли участие 56 бионаивных пациентов, которые получали препарат УСТ после индукционного введения в режиме 90 мг один раз в 12 недель (первая группа, n = 30) и 90 мг один раз в восемь недель (вторая группа, n = 26). Проанализированы пол, возраст пациентов, возраст на момент постановки диагноза, тяжесть и длительность заболевания ЯК, наличие кишечных осложнений, наличие и локализация внекишечных проявлений, предшествующее лечение, а также исходные клинико-лабораторные показатели перед началом терапии УСТ.
Результаты. Клинический ответ и клиническая ремиссия по индексу Мейо (ИМ) были достигнуты у 29 (96,7%) пациентов первой и у 25 (96,2%) пациентов второй группы (p > 0,05). При анализе общей когорты клинической ремиссии достигли и сохраняли (без потребности в оптимизации терапии) к 52-й неделе наблюдения 29 (96,7%) пациентов первой и 25 (96,2%) пациентов второй группы, что не имело статистической значимости (p = 0,537; χ2 – 0,051; отношение шансов (ОШ) – 0,862; 95%-ный доверительный интервал (95% ДИ) 0,051–14,506). Эти показатели свидетельствуют о клинической эффективности препарата УСТ у бионаивных пациентов вне зависимости от режима поддерживающей терапии.
Эндоскопическая ремиссия (ИМ – 0) зарегистрирована у 16 (53,3%) пациентов первой и у 21 (80,8%) пациента второй группы. При статистическом анализе достигли и сохраняли к 52-й неделе наблюдения эндоскопическую ремиссию 16 (53,3%) пациентов первой и 21 (80,8%) пациент второй группы, что имело статистическую значимость (p = 0,04731; χ2 – 4,677; ОШ – 0,272; 95% ДИ 0,081–0,913).
За год наблюдения у 16 (53,3%) пациентов первой группы сохранялась клинико-эндоскопическая ремиссия ЯК, у 11 (36,3%) пациентов сохранялись клинический ответ и клиническая ремиссия, 3 (10,0%) пациента имели первичную неэффективность или ускользание ответа на терапию УСТ; у 21 (80,8%) пациента второй группы сохранялась клинико-эндоскопическая ремиссия ЯК, у 4 (15,4%) пациентов сохранялись клинический ответ и клиническая ремиссия и 1 (3,8%) пациент имел первичную неэффективность УСТ в течение года наблюдения.
Бесстероидная ремиссия констатирована у 17 (56,7%) пациентов первой и 23 (88,5%) пациентов второй группы (p = 0,01619; χ2 – 5,429; ОШ – 5,863; 95% ДИ 1,441–23,851).
Заключение. Результаты проведенного исследования 56 пациентов с ЯК подтвердили данные предшествующих исследований, проведенных в мире, и продемонстрировали высокую эффективность препарата в поддерживающей терапии УСТ при режиме дозирования 90 мг каждые восемь недель у бионаивных пациентов с наличием факторов неблагоприятного прогноза.
Материал и методы. В исследовании приняли участие 56 бионаивных пациентов, которые получали препарат УСТ после индукционного введения в режиме 90 мг один раз в 12 недель (первая группа, n = 30) и 90 мг один раз в восемь недель (вторая группа, n = 26). Проанализированы пол, возраст пациентов, возраст на момент постановки диагноза, тяжесть и длительность заболевания ЯК, наличие кишечных осложнений, наличие и локализация внекишечных проявлений, предшествующее лечение, а также исходные клинико-лабораторные показатели перед началом терапии УСТ.
Результаты. Клинический ответ и клиническая ремиссия по индексу Мейо (ИМ) были достигнуты у 29 (96,7%) пациентов первой и у 25 (96,2%) пациентов второй группы (p > 0,05). При анализе общей когорты клинической ремиссии достигли и сохраняли (без потребности в оптимизации терапии) к 52-й неделе наблюдения 29 (96,7%) пациентов первой и 25 (96,2%) пациентов второй группы, что не имело статистической значимости (p = 0,537; χ2 – 0,051; отношение шансов (ОШ) – 0,862; 95%-ный доверительный интервал (95% ДИ) 0,051–14,506). Эти показатели свидетельствуют о клинической эффективности препарата УСТ у бионаивных пациентов вне зависимости от режима поддерживающей терапии.
Эндоскопическая ремиссия (ИМ – 0) зарегистрирована у 16 (53,3%) пациентов первой и у 21 (80,8%) пациента второй группы. При статистическом анализе достигли и сохраняли к 52-й неделе наблюдения эндоскопическую ремиссию 16 (53,3%) пациентов первой и 21 (80,8%) пациент второй группы, что имело статистическую значимость (p = 0,04731; χ2 – 4,677; ОШ – 0,272; 95% ДИ 0,081–0,913).
За год наблюдения у 16 (53,3%) пациентов первой группы сохранялась клинико-эндоскопическая ремиссия ЯК, у 11 (36,3%) пациентов сохранялись клинический ответ и клиническая ремиссия, 3 (10,0%) пациента имели первичную неэффективность или ускользание ответа на терапию УСТ; у 21 (80,8%) пациента второй группы сохранялась клинико-эндоскопическая ремиссия ЯК, у 4 (15,4%) пациентов сохранялись клинический ответ и клиническая ремиссия и 1 (3,8%) пациент имел первичную неэффективность УСТ в течение года наблюдения.
Бесстероидная ремиссия констатирована у 17 (56,7%) пациентов первой и 23 (88,5%) пациентов второй группы (p = 0,01619; χ2 – 5,429; ОШ – 5,863; 95% ДИ 1,441–23,851).
Заключение. Результаты проведенного исследования 56 пациентов с ЯК подтвердили данные предшествующих исследований, проведенных в мире, и продемонстрировали высокую эффективность препарата в поддерживающей терапии УСТ при режиме дозирования 90 мг каждые восемь недель у бионаивных пациентов с наличием факторов неблагоприятного прогноза.





Введение
Язвенный колит (ЯК) является хроническим иммуновоспалительным заболеванием кишечника, которое поражает слизистую оболочку толстой кишки и имеет в своем течении периоды обострения и ремиссии.
Патогенез ЯК является многофакторным и зависит как от генетической предрасположенности, дефектов слизистого барьера, нарушений регуляции иммунных реакций, микробиоты кишечника, так и от влияния факторов окружающей среды [1]. Среди пациентов с ЯК средней и тяжелой степени в последние годы наблюдается рост заболеваемости, числа госпитализаций и потребности в хирургических вмешательствах [2, 3].
Целью краткосрочного лечения обострения ЯК является контроль симптомов заболевания и достижение клинического ответа/клинической ремиссии заболевания. При достижении симптомного ответа целью долгосрочного лечения является предотвращение рецидивов заболевания [4]. Общая цель на обоих этапах лечения – воздействие на процесс заболевания с целью уменьшения степени воспаления слизистой оболочки толстой кишки (СОТК).
Таким образом, цели терапии ЯК соответствуют стратегии trеat to target, что согласуется с понятием «лечение до достижения цели» [4]. Концепция направлена на достижение долгосрочного эффекта лечения, включая быстрое достижение клинической ремиссии и ее долгосрочное поддержание без глюкокортикоидов (ГК); заживление СОТК; профилактика осложнений (например, стриктур кишки или рака толстой кишки); предупреждение оперативных вмешательств, возникающих в результате неконтролируемого, но бессимптомного воспаления; улучшение качества жизни и снижение частоты инвалидизации у пациентов с ЯК.
Для лечения ЯК средней и тяжелой степени активности доступны различные генно-инженерные биологические препараты (ГИБП) и таргетные иммуносупрессоры. Имеются определенные ограничения, связанные с риском активации оппортунистической инфекции, а также потеря ответа, которая достигает 52–79%, согласно данным ряда исследований по оценке эффективности и безопасности блокаторов фактора некроза опухоли альфа (ФНО-α) [5–10]. Кроме того, у большой доли пациентов, которые изначально отвечают на терапию, со временем теряется ответ [11–13].
Потребность в новых подходах к терапии воспалительных заболеваний кишечника (ВЗК) и поиск инновационных препаратов для лечения пациентов с болезнью Крона (БК) и ЯК остаются весьма актуальными проблемами современной гастроэнтерологии.
Устекинумаб, человеческое моноклональное антитело, воздействующее на субъединицу p40 интерлейкина (ИЛ) 12 и ИЛ-23, зарегистрированное изначально для терапии псориаза, было одобрено FDA для лечения болезни Крона в сентябре 2016 г. и ЯК средней и тяжелой степени тяжести в октябре 2019 г. [14, 15]. В РФ препарат был зарегистрирован для лечения пациентов с ЯК в августе 2019 г. Основное исследование UNIFI (устекинумаб в качестве индукционной и поддерживающей терапии язвенного колита) продемонстрировало эффективность и безопасность препарата, при этом показатели клинической ремиссии составили 15% на восьмой и 40% на 44-й неделе, что было статистически значимо выше, чем у пациентов группы плацебо (24%) [16].
Однако общепризнанным считается, что результаты рандомизированных клинических исследований (РКИ) не всегда в полной мере коррелируют с реальной клинической практикой по причине ограниченности полученных данных и не в полной мере их можно экстраполировать на общую популяцию пациентов с ВЗК, в частности с ЯК [17].
Оценка эффективности и безопасности препарата устекинумаб в реальной клинической практике проведена нами на группе пациентов с БК в 2020–2024 гг. [18, 19].
В реальной клинической практике пациенты с ЯК, начинающие лечение устекинумабом (УСТ), могут демонстрировать не столь быстрый ответ или даже резистентность к проводимой терапии, чем пациенты, включенные в РКИ. В первую очередь это связано с тем, что пациенты ранее получали блокаторы ФНО-α, которые достаточно часто применяются в качестве первой линии терапии ЯК, а также несколько ГИБП, назначаемых из-за первичной или вторичной потери ответа или развития нежелательных явлений [20]. Помимо учета предшествующей терапии ГИБП, при назначении УСТ необходимо учитывать факторы неблагоприятного прогноза в дебюте заболевания (факторы высокого риска развития осложнений). Такими факторами являются: возраст установления диагноза менее 40 лет (ассоциирован с более тяжелым течением заболевания, коротким периодом ремиссий и более высоким риском колэктомии), возраст более 65 лет на момент установления диагноза (ассоциирован с риском ранней колэктомии), тотальное поражение кишки, высокая активность по данным эндоскопии (большие и/или глубокие язвы), ранняя потребность в системных стероидах (назначение в дебюте заболевания) или потребность хотя бы в одном курсе ГК, высокие концентрации маркеров воспаления, некурящие и бывшие курильщики (имеют тенденцию к большей протяженности воспаления и к более медленному заживлению СОТК), наличие внекишечных проявлений и аутоиммунных заболеваний [21, 22]. Согласно проведенным исследованиям, более 50% пациентов имеют два фактора неблагоприятного прогноза и около 17% пациентов – три фактора неблагоприятного прогноза.
Однако данных реальной клинической практики об эффективности и безопасности УСТ среди пациентов с ЯК, имеющих факторы неблагоприятного прогноза, недостаточно.
Цель исследования – изучить в реальной клинической практике эффективность и безопасность индукционной и поддерживающей терапии устекинумабом в зависимости от режима дозирования у бионаивных пациентов с язвенным колитом и наличием у них в дебюте заболевания одного или нескольких факторов неблагоприятного прогноза.
Материал и методы
Данное исследование является ретро- и проспективным, открытым. Для оценки эффективности препарата УСТ в зависимости от режима введения мы включили в исследование 56 бионаивных пациентов с ЯК и наличием у них в дебюте заболевания факторов неблагоприятного прогноза [22]. Исследование проводили в отделении патологии кишечника Московского клинического научно-практического центра (МКНЦ) им. А.С. Логинова с оценкой эффективности терапии не менее 12 месяцев от начала лечения. Сбор данных для анализа осуществляли с января 2023 по декабрь 2024 г.
Диагноз ЯК устанавливали на основании клинических, эндоскопических, рентгенологических и гистологических методов исследования. Исключали активный и латентный туберкулез.
56 бионаивных пациентов с обострением язвенного колита были разделены на две группы: первая (n = 30) – индукционное введение препарата УСТ в режиме 90 мг один раз в 12 недель; вторая (n = 26) – 90 мг один раз в восемь недель.
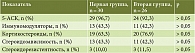
Проанализированы следующие характеристики пациентов обеих групп: пол; возраст пациента; возраст на момент постановки диагноза; длительность заболевания; тяжесть и протяженность поражения толстой кишки; наличие и локализация внекишечных проявлений (ВКП) на момент начала терапии УСТ – артрит, артралгия, гангренозная пиодермия, узловатая эритема, псориаз, первичный склерозирующий холангит (ПСХ), аутоиммунный гепатит (табл. 1); предшествующее лечение – терапия препаратами 5-аминосалициловой кислоты (5-АСК), иммуносупрессорами, ГК (табл. 2), а также исходные лабораторные показатели перед началом терапии УСТ (табл. 3).
Обе группы пациентов были сопоставимы по всем анализируемым клиническим, демографическим и лабораторным показателям. Большинство пациентов, включенных в исследование, имели длительный анамнез ЯК (около шести лет); 60,0% пациентов первой и 57,7% пациентов второй группы имели среднетяжелое течение заболевания; 26,7% и 34,6% – тяжелое течение заболевания соответственно; более 60% пациентов обеих групп имели тотальное поражение толстой кишки; у 40,0% пациентов первой и у 42,3% пациентов второй группы имелись внекишечные проявления.
Показанием для назначения УСТ было наличие у пациента нескольких факторов неблагоприятного прогноза: возраст < 40 лет при установлении диагноза, тотальное поражение кишки, высокая активность по данным эндоскопии (глубокие язвенные дефекты СОТК), ранняя потребность в системных стероидах (назначение в дебюте заболевания) или потребность хотя бы в одном курсе ГК, высокие концентрации маркеров воспаления, наличие внекишечных проявлений и аутоиммунных заболеваний [22].
До начала исследования больные обеих групп получали препараты 5-АСК (96,7 и 92,3%), иммуносупрессоры (43,3 и 42,3%) и глюкокортикоиды (63,3 и 76,9%) соответственно, ГИБП не получал ни один пациент.
Оценивали динамику клинических симптомов и показателей активности воспалительного процесса на восьмой неделе лечения, через 24 и 52 недели от начала терапии УСТ.
Ответ на лечение оценивали как уменьшение индекса по шкале Мейо не менее чем на 30% от исходного, а ремиссия была определена как оценка по шкале Мейо 0–2 балла (табл. 4, 5) [21]. Эндоскопическую ремиссию оценивали по шкале оценки состояния слизистой оболочки по Schroeder [23].
Степень тяжести ЯК оценивали по индексу Мейо (ИМ) (табл. 4). Отсутствие значительного улучшения симптомов (снижение частичного ИМ менее 30%), отсутствие нормализации лабораторных показателей (СОЭ, СРБ, гемоглобин, фекальный кальпротектин (ФКП)), прекращение лечения УСТ или перевод на ГК/ГИБП расценивали как неудачу терапии.
Эндоскопический ответ оценивали по шкале Schroeder по результатам оценки выраженности эндоскопических признаков: гиперемия, смазанный сосудистый рисунок, контактная ранимость, наличие эрозий, язвенных дефектов (табл. 6) [23].
Согласно инструкции по медицинскому применению, через восемь недель после введения инициирующей (индукционной) дозы препарат УСТ вводится подкожно в дозе 90 мг (первое подкожное введение). Для подкожного введения используется препарат УСТ в лекарственной форме раствор для подкожного введения. Пациенты, которые теряют ответ на лечение при введении препарата каждые 12 недель, могут воспользоваться возможностью увеличить частоту введения – каждые восемь недель.
Критерии оценки лечения:
- быстрый клинический ответ – уменьшение частоты стула и/или уменьшение интенсивности клинических симптомов в течение недели;
- ранний клинический ответ – положительная динамика клинических симптомов и эндоскопической картины и внекишечных проявлений после индукционного курса на восьмой неделе лечения;
- клиническая ремиссия – констатируется при исчезновении примеси крови в стуле и снижении частоты дефекаций до трех раз в сутки и менее;
- достижение и поддержание клинической ремиссии (стойкая ремиссия) на протяжении 12 недель после начала терапии;
- эндоскопическая ремиссия – ИМ – 0 баллов;
- бесстероидная ремиссия – отмена терапии ГК без повторного назначения в течение четырех недель у пациентов, исходно получавших ГК.
Настоящее исследование было согласовано с локальным этическим комитетом МКНЦ им. А.С. Логинова. Все пациенты подписали письменное информированное согласие на участие в исследовании.
Всем пациентам проводили клинико-лабораторный контроль для оценки динамики состояния с возможностью продолжения данной терапии. Лабораторные и инструментальное обследования проводили на современном специализированном лицензированном оборудовании, проходящем регулярную плановую поверку и находящемся в распоряжении соответствующих структурных подразделений МКНЦ им. А.С. Логинова.
Статистический анализ выполняли с использованием пакета прикладных программ IBM SPSS Statistics 24.0. Inc. Microsoft® Office Excel 2003; STASTICA 7.0, Primer of Biostatistics Version 4.03 by Stanton A. Glantz 1998. Для определения значимости различий между средними величинами при нормальном распределении совокупностей применяли t-критерий Стъюдента. Анализ качественных параметров проводили по частотам встречаемости. Для описания количественных переменных использовали методы описательной статистики: среднее (Mean), стандартное отклонение (Std. Deviation). Отношение шансов рассчитывали как события в одной группе к рискам события в другой группе с 95%-ным доверительным интервалом (95% ДИ) по таблицам сопряженности с использованием однофакторного логистического регрессионного анализа.
Результаты
Клинический ответ
Пациентам обеих групп УСТ назначали внутривенно капельно в индукционной дозе 260–520 мг в зависимости от массы тела. Ранний ответ на терапию УСТ оценивали в течение первой недели: он характеризовался урежением частоты стула и уменьшением количества патологических примесей, интенсивности абдоминального болевого синдрома и улучшением общего самочувствия. Был отмечен у 24 (80,0%) пациентов первой и у 19 (73,1%) пациентов второй группы. Скорость достижения клинического ответа в настоящем исследовании сопоставима с данными, полученными при анализе опросников пациентов, включенных в исследование UNIFI [16].
После индукционного введения УСТ у 29 (96,7%) пациентов первой и у 26 (100,0%) пациентов второй группы через две недели отмечена положительная динамика: улучшение общего самочувствия, уменьшение частоты стула, уменьшение интенсивности абдоминального болевого синдрома, уменьшение патологических примесей в кале, зарегистрировано снижение показателей активности воспалительного процесса (лейкоциты, СОЭ, СРБ, ФКП).
К концу 12-й недели терапии у 29 (96,7%) пациентов первой группы было отмечено достижение клинической ремиссия и показателей клинического ответа по ИМ, одному (3,3%) пациенту в связи с прогрессированием заболевания (сохраняющимися диареей, абдоминальным болевым синдромом, анемией, лейкоцитозом, высоким уровнем СРБ, СОЭ и прокальцитонина) была назначена терапия ГК и антибактериальная терапия. К концу 12-й недели терапии у 25 (96,2%) пациентов второй группы было отмечено достижение клинической ремиссия и показателей клинического ответа по ИМ. Одному (3,8%) пациенту в связи с сохраняющимися диареей, лейкоцитозом, высоким уровнем СРБ, СОЭ и прокальцитонина назначена терапия ГК, затем анти-ФНО-α и в последующем выполнено хирургическое вмешательство.
Клинический ответ и клиническая ремиссия по ИМ в течение 12 недель после индукционного курса УСТ внутривенно и одного подкожного введения были достигнуты у 29 (96,7%) пациентов первой и у 25 (96,2%) пациентов второй группы (p > 0,05).
Клиническая ремиссия
Вторичная конечная точка – через 52 недели. Через 52 недели от проведения индукционного курса УСТ у 2 (6,7%) пациентов первой группы развилось ускользание эффекта терапии УСТ. У пациента на фоне поддерживающей терапии с введением УСТ один раз в 12 недель, уже через девять недель после очередного введения отмечено ухудшение общего самочувствия, увеличение частоты стула с наличием патологических примесей (крови и слизи) с консистенцией стула 5–6-го типа по Бристольской шкале, в связи с чем было принято решение об изменении схемы поддерживающей терапии с интервала 12 недель до восьми недель.
У 25 (100,0%) пациентов второй группы, достигших клинического ответа и клинической ремиссии к 12-й неделе от момента введения УСТ, к 52-й неделе сохранялась клиническая ремиссия, отмечено значительное уменьшение или нормализация частоты стула с консистенцией стула 3–5-го типа по Бристольской шкале, ИМ составил менее 3 баллов (p > 0,05 между группами).
Проведено сравнение основных лабораторных показателей активности воспалительного процесса между группами через 52 недели от начала терапии УСТ – концентрации СРБ, гемоглобина, сывороточного железа, уровня лейкоцитов, тромбоцитов и ФКП.
Результаты сравнения основных лабораторных показателей представлены в табл. 7.
Однако не все лабораторные показатели активности воспалительного процесса зависели от схемы терапии УСТ. При сравнении лабораторных показателей между первой и второй группами пациентов через 52 недели от начала терапии УСТ не было достоверной разницы между концентрацией СРБ, сывороточного железа, уровнем гемоглобина, тромбоцитов, лейкоцитов, СОЭ. Однако статистическая разница между группами установлена для уровня ФКП. Для большей объективности выявления связи между режимом дозирования УСТ и лабораторными показателями необходимо продолжить динамическое наблюдение в случае отсутствия признаков ускользания ответа на проводимую терапию. Это необходимо для выявления предиктивной значимости тех или иных маркеров воспаления с целью своевременной оптимизации терапии до наступления клинических симптомов обострения заболевания.
При анализе общей когорты пациентов с ЯК в первой группе клинической ремиссии достигли и сохраняли (без потребности в оптимизации терапии) к 52-й неделе наблюдения 29 (96,7%) пациентов, во второй группе – 25 (96,2%) пациентов, что не имело статистической значимости (p = 0,537; c2 – 0,051; ОШ – 0,862; 95% ДИ 0,051–14,506), что свидетельствует о клинической эффективности препарата УСТ у бионаивных пациентов вне зависимости от режима поддерживающей терапии.
Эндоскопическая ремиссия
Большинство пациентов с клинической ремиссией на 52-й неделе достигли также улучшения эндоскопической картины СОТК. В интервале 44–52 недели от проведения индукционного курса УСТ эндоскопическое исследование было выполнено всем пациентам с ЯК в обеих группах.
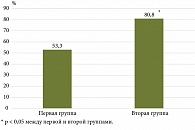
Эндоскопическая ремиссия, характеризующаяся заживлением СОТК, отсутствием гиперемии, смазанности сосудистого рисунка, контактной ранимости (ИМ – 0) зарегистрирована у 16 (53,3%) пациентов первой и у 21 (80,8%) пациента второй группы. При статистическом анализе пациентов на 52-й неделе с ЯК: в первой группе достигли и сохраняли к 52-й неделе наблюдения эндоскопическую ремиссию 16 (53,3%) пациентов, во второй – 21 пациент (80,8%), что было статистически значимо (p = 0,04731; c2 – 4,677; ОШ – 0,272; 95% ДИ 0,081–0,913) (рис. 1).
У пациентов с ЯК при наличии факторов неблагоприятного прогноза достижение эндоскопической ремиссии, характеризующейся заживлением слизистой оболочки (ИМ – 0), зависит от режима введения препарата УСТ. Эффективность препарата УСТ с режимом дозирования 90 мг один раз в восемь недель статистически достоверно выше, чем с режимом дозирования 90 мг один раз в 12 недель.
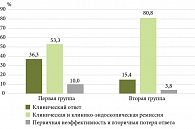
Таким образом, за год наблюдения у 16 (53,3%) пациентов первой группы сохранялась клинико-эндоскопическая ремиссия ЯК, у 11 (36,3%) пациентов сохранялись клинический ответ и клиническая ремиссия, 3 (10,0%) пациента имели первичную неэффективность или ускользание ответа на терапию УСТ; у 21 (80,8%) пациента второй группы сохранялась клинико-эндоскопическая ремиссия ЯК, у 4 (15,4%) пациентов сохранялись клинический ответ и клиническая ремиссия, 1 (3,8%) пациент из второй группы имел первичную неэффективность УСТ в течение года наблюдения (рис. 2).
Клинико-эндоскопическая ремиссия является прогностически благоприятным фактором течения заболевания у пациентов с ЯК, получающих препарат УСТ (p = 0,04731; c2 – 3,533).
Бесстероидная ремиссия
За весь период наблюдения из 56 (100%) бионаивных пациентов с ЯК, получавших УСТ, не ответили на терапию (первичная неэффективность) или имели ускользание ответа на терапию 3 (10,0%) пациента первой и 1 (3,8%) пациент второй группы. Все пациенты на момент инициации УСТ получали ГК в средней терапевтической дозе 38,4 ± 4,2 мг. После индукционного курса УСТ в течение восьми недель преднизолон был отменен у 21 (70,0%) пациента первой группы и у 23 (88,5%) пациентов второй группы, ответивших на лечение (p = 0,1409; c2 – 1,830; ОШ – 3,286; 95% ДИ 0,783–13,790).
В течение 12 месяцев среди ответивших на терапию УСТ 4 (13,3%) пациентам первой группы потребовалось дополнительное назначение ГК, пациентам второй группы дополнительное назначение ГК не потребовалось. Таким образом, бесстероидная ремиссия констатирована у 17 (56,7%) пациентов первой и 23 (88,5%) пациентов второй группы (p = 0,01619; c2 – 5,429; ОШ – 5,863; 95% ДИ 1,441–23,851). Таким образом, бесстероидная ремиссия достигается у бионаивных пациентов ЯК при наличии факторов неблагоприятного прогноза и сохраняется достоверно выше в группе пациентов с режимом дозирования УСТ один раз в восемь недель.
Внекишечные проявления
Внекишечные проявления ЯК до начала терапии УСТ были зарегистрированы у 12 (40,0%) пациентов первой и у 11 (42,3%) пациентов второй группы. У большинства пациентов с внекишечными проявлениями – 9 (75,0%) пациентов первой и 7 (63,6%) пациентов второй группы – имелись скелетно-мышечные проявления (артралгии, периферические артриты, аксиальные поражения); поражения кожи и слизистых – у 2 (16,7%) пациентов первой и у 3 (27,3%) пациентов второй группы.
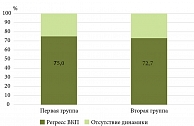
К 52-й неделе положительная динамика, характеризующаяся уменьшением кожных проявлений, болевого суставного синдрома и регрессом воспалительных изменений слизистых оболочек, наблюдалась у 9 (75,0%) пациентов первой и у 8 (72,7%) пациентов второй группы (рис. 3). Таким образом, статистически значимой разницы в купировании ВКП между группами не было (p > 0,05).
Утяжеления симптомов ВКП любой локализации не наблюдалось ни у одного пациента вне зависимости от режима дозирования.
Безопасность
На протяжении индукционного исследования и курса поддерживающей терапии УСТ ни в одном случае серьезных нежелательных явлений, в т.ч. туберкулеза, серьезных инфекций, обострения хронических заболеваний, не связанных с ЯК, злокачественных новообразований и смертельных исходов в группах пациентов не было.
Обсуждение
Повышение эффективности терапии ГИБП остается актуальной проблемой в реальной клинической практике, как у небионаивных, так и у бионаивных пациентов. Несмотря на наличие общепринятых схем назначения УСТ согласно инструкции к применению, необходим адаптированный к конкретной ситуации персонализированный подход ведения пациентов с учетом линии терапии, неблагоприятных факторов прогноза, предикторов эффективности/неэффективности терапии [22]. От этого зависит конечный результат проводимой терапии, лечение до достижения цели, а именно – уменьшения интенсивности абдоминальной боли, частоты стула и ректального кровотечения как минимум на 50%, эндоскопическое заживление СОТК (ИМ – 0 баллов), нормализация уровня СРБ до значений ниже верхней границы нормы и ФКП до 100–250 мг/г, улучшение качества жизни и психоэмоционального состояния пациента [4].
Полученные нами данные по достижении эндоскопической ремиссии ЯК к 52-й неделе наблюдения соответствовали данным субанализа международного исследования III фазы индукционной и поддерживающей терапии (UNIFI) по оценке эффективности и безопасности УСТ у пациентов со среднетяжелым и тяжелым активным ЯК в российской популяции на протяжении трех лет, по результатам которого эндоскопическая ремиссия к 44-й неделе наблюдения была достигнута у 46,2% пациентов в группе устекинумаба с введением один раз в 12 недель и у 75,0% пациентов в группе устекинумаба с введением один раз в восемь недель [24].
Клиническая ремиссия на 52-й неделе наблюдения отмечена у 83,3% пациентов, получавших УСТ в режиме один раз в 12 недель, и у 81,8% пациентов, получавших УСТ один раз в восемь недель. Частота бесстероидной клинической ремиссии на 52-й неделе наблюдения соответствовала частоте клинической ремиссии. Профиль безопасности УСТ на протяжении всего периода исследования был сопоставим с таковым у пациентов группы плацебо [24].
Как было указано ранее, при выборе терапии важно оценить наличие у пациента факторов неблагоприятного прогноза заболевания на момент установления диагноза [18, 19, 22, 25]. Мировое гастроэнтерологическое сообщество единодушно в плане оптимально раннего назначения ГИБП с учетом лучшего прогноза течения заболевания, снижения рисков инвалидизации пациентов, повышения качества жизни больных ВЗК [4]. Позиция ECCO 2017 и 2022 гг. заключается в следующем: пациенты с клиническими признаками плохого прогноза являются наиболее подходящими для раннего назначения иммуносупрессивной терапии. Раннюю терапию ГИБП следует начинать у пациентов с высокой активностью заболевания и особенностями, указывающими на плохой прогноз, у пациентов с агрессивным течением заболевания или высоким риском плохого прогноза следует рассмотреть раннее назначение ГИБП (анти-ФНО-α, устекинумаб, ведолизумаб) [26].
Британская ассоциация гастроэнтерологов рекомендует пациентам с ЯК, получающим поддерживающую терапию высокими дозами месалазина, которым потребовалось два или более курсов КС в течение последнего года или у которых развилась стероидозависимость или стероидорезистность, необходимо усилить терапию ГИБП или ТИС. Выбор препарата должен определяться клиническими факторами, стоимостью препарата, потребностью и приверженностью пациента к лечению и способом введения препарата [27].
Американская гастроэнтерологическая ассоциация рекомендует учитывать следующие ключевые аспекты: активность заболевания и прогноз определяют потребность пациента в использовании биологической терапии; пациент с плохим прогнозом не должен проходить традиционный подход step-up. В новом подходе к лечению врач должен на раннем этапе заболевания сразу же использовать ГИБП, если это обусловлено активностью и/или прогнозом заболевания пациента [28]. У пациентов со среднетяжелым/тяжелым течением язвенного колита рекомендовано раннее применение ГИБП top down вместе с иммуномодуляторами или без них вместо последовательной терапии после неэффективности 5-АСК. Пациенты с легким и среднетяжелым течением заболевания и те, кто придает большее значение безопасности терапии 5-АСК, чем эффективности ГИБП, могут выбрать последовательную терапию step up [29].
Однако еще недостаточно исследований по раннему применению биологических препаратов (помимо поэтапного подхода) с фокусировкой на профилактику осложнений и исходов, модифицирующих течение болезни с учетом обоснования каждого фактора риска прогрессирования заболевания (возраст, эндоскопическая активность, статус курильщика, распространенность поражения и пр.) [30].
В 2013 г. М.А. Ливзан и соавт. провели исследования с целью выявления факторов неблагоприятного течения ЯК. Установлены прогностические факторы формирования потребности в системной иммуносупрессивной терапии в первые пять лет анамнеза у пациентов со средним и тяжелым течением ЯК. Определено влияние полиморфизмов генов интерлейкинов IL-17FT7488C и ФНО-α (G-308A) на возраст дебюта заболевания, на риск формирования воспалительных полипов, распространенность поражения патологического процесса в СОТК, потребность в ГК [31].
В 2016 г. Wanderas и соавт. опубликовали анализ результатов популяционных исследований, в котором были сформулированы прогностические факторы тяжелого клинического течения язвенного колита у пациентов молодого возраста и с наличием ПСХ на момент постановки диагноза, потребностью в назначении ГК в дебюте заболевания, высокого балла по шкале Мейо, уровнем СРБ > 10 мг/л и гемоглобина < 121/138 г/л (женщины/мужчины соответственно) и пр. [32].
Таким образом, необходим анализ влияния как каждого фактора, так и их различных комбинаций в оценке риска прогрессирования заболевания, таких как возраст пациента, распространенность поражения СОТК, ранняя потребность в назначении ГК, отсутствие заживления слизистой оболочки при достижении клинической ремиссии, статус курильщика, наличие сопутствующих аутоиммунных заболеваний и внекишечных проявлений. Но помимо учета факторов неблагоприятного прогноза течения ВЗК, которые предопределяют ранее назначение терапии, необходимо продолжить исследования по раннему назначению оптимизированных схем ГИБП [18].
Заключение
Представленное клиническое наблюдение пациентов с ЯК без предшествующей терапии ГИБП, как и другие многочисленные исследования, проводимые в мире, продемонстрировало высокую эффективность препарата УСТ в индукционной и поддерживающей терапии в когорте больных с тяжелым и среднетяжелым течением ЯК, резистентных к стандартной терапии [33–35]. Имеющиеся на сегодняшний день данные позволяют отнести УСТ к одному из препаратов выбора у бионаивных пациентов со средней и тяжелой степенью течения ЯК, имеющих факторы неблагоприятного прогноза. Для достижения наилучшего результата следует применять персонализированный подход к каждому пациенту в подборе не только дозировки, но и схемы введения препарата. Выбор режима 90 мг один раз в восемь недель является более предпочтительным у пациентов с ЯК при наличии факторов неблагоприятного прогноза [22]. Целесообразно дальнейшее проведение анализа результатов реальной клинической практики для установления связи между оптимальным режимом дозирования в начале лечения (90 мг подкожно один раз в 12 или восемь недель), факторами неблагоприятного прогноза течения ЯК, а также лабораторными показателями активности заболевания (высокий исходный уровень СРБ, ФКП, анемия, лейкоцитоз). Необходимо проведение многоцентровых исследований с целью установления предикторов выбора режима дозирования на раннем этапе лечения пациентов с ЯК.
Авторы заявляют об отсутствии конфликта интересов.
O.V. Knyazev, PhD, A.V. Kagramanova, PhD, A.A. Lishchinskaya, PhD, I.A. Li, PhD, N.A. Fadeeva, PhD, N.V. Lazuka, E.Y. Zhulina, A.I. Parfenov, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
Research Institute of Health Organization and Medical Management, Moscow
Russian Medical Academy of Continuous Professional Education, Moscow
Contact person: Knyazev Oleg Vladimirovich, o.knyazev@mknc.ru
Purpose – to assess the efficacy of Ustekinumab therapy (UST) depending on the dosage regimen in bio-naive patients with ulcerative colitis (UC) and with unfavorable prognostic factors at the onset of the disease.
Material and methods. The trial involved 56 bio-naive patients who had received UST in the regimen of 90 mg once every 12 weeks (Group 1, n = 30) and 90 mg once every eight weeks (Group 2, n = 26). The authors analyzed patients’ gender, age, their age at UC diagnosis, UC severity and duration, intestinal complications, presence and localization of extraintestinal manifestations, previous treatment, as well as baseline clinical and laboratory findings before UST therapy.
Results. Clinical response and clinical remission according to the Mayo index (MI) were achieved in 29 (96.7%) patients in Group 1 and in 25 (96.2%) patients in Group 2 (p > 0.05). When analyzing the overall cohort, clinical remission was achieved and maintained (without therapy optimization) by the 52nd week of observation in 29 (96.7%) patients in Group 1 and in 25 (96.2%) patients in Group 2 which was not statistically significant (p = 0.537; χ2 – 0.051; odds ratio (OR) – 0.862; 95% confidence interval (95% CI) 0.051–14.506). These indices indicate UST clinical efficacy in bionaive patients, regardless the regimen of maintenance therapy. Endoscopic remission (MI – 0) was registered in 16 (53.3%) patients of Group 1 and in 21 (80.8%) patients in Group 2. The statistical analysis has shown that endoscopic remission was achieved and maintained by the 52nd observation week in 16 (53.3%) patients in Group 1 and in 21 (80.8%) patients in Group 2 what is statistically significant (p = 0.04731; χ2 – 4.677; OR – 0.272; 95% CI 0.081–0.913). One year follow-up has shown that in Group 1, UC clinical and endoscopic remission was maintained in 16 (53.3%) patients, clinical response and clinical remission were maintained in 11 (36.3%) patients while 3 (10.0%) patients had initially an ineffective or escaping response to UST therapy. In Group 2, 21 (80.8%) patients maintained UC clinical and endoscopic remission, 4 (15.4%) patients maintained clinical response and clinical remission, while in one patient (3.8%) UST initially failed. Steroid-free remission was registered in 17 (56.7%) patients in Group 1 and in 23 (88.5%) patients in Group 2 (p = 0.01619; χ2 – 5.429; OR – 5.863; 95% CI 1.441–23.851).
Conclusion. The results obtained in 56 patients with UC have substantiated findings of the previous trials conducted worldwide and have demonstrated a high efficacy of the maintenance therapy with UST at dosage regimen of 90 mg every eight weeks in bionaive patients with unfavorable prognostic factors.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.