Опыт применения устекинумаба у бионаивных пациентов с болезнью Крона, имеющих факторы неблагоприятного прогноза: реальная клиническая практика
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Для оценки эффективности препарата УСТ включили в исследование 38 бионаивных пациентов с БК, имевших в дебюте заболевания факторы неблагоприятного прогноза, которые были рандомизированы в две группы пациентов, получавших препарат в режиме 90 мг подкожно один раз в 12 недель (первая группа, n = 20) и 90 мг подкожно один раз в 8 недель (вторая группа, n = 18). Проанализированы пол, возраст пациента, в том числе на момент постановки диагноза, тяжесть и протяженность БК; наличие кишечных осложнений; наличие и локализация внекишечных проявлений; предшествующее лечение.
Результаты. Клинический ответ и клиническая ремиссия были достигнуты у 19 (95,0%) пациентов первой группы и 18 (100,0%) пациентов второй группы (p > 0,05). В первой группе сохранили клиническую ремиссию (без потребности в оптимизации терапии) к 52-й неделе наблюдения 18 (90,0%) пациентов, во второй группе – 18 (100,0%) пациентов, что не имело статистической значимости (p = 0,516; χ2 = 1,9; отношение шансов (ОШ) 1,0). В первой группе достигли и сохраняли к 52-й неделе наблюдения эндоскопическую ремиссию 10 (50,0%) пациентов, во второй группе – 16 (88,9%) пациентов (p = 0,01492; χ2 = 6,631; ОШ 8,00; 95% ДИ 1,445–44,298). В течение одного года наблюдения у 10 (50,0%) пациентов первой группы сохранялась клинико-эндоскопическая ремиссия БК, у 8 (40,0%) пациентов сохранялись клинический ответ и клиническая ремиссия (снижение ≥ 100 баллов от исходного ИАБК), у 16 (88,9%) пациентов второй группы сохранялась клинико-эндоскопическая ремиссия БК, у 2 (11,1%) пациентов сохранялись клинический ответ и клиническая ремиссия. Клинико-эндоскопическая ремиссия у пациентов с БК, получавших препарат УСТ, достигнута во второй группе (p = 0,01492; χ2 = 6,631). Бесстероидная ремиссия у пациентов 1-й группы составила 65,0%, а у больных БК 2-й группы – около 95% (p = 0,04502).
Заключение. Данное клиническое наблюдение продемонстрировало статистически значимо более высокую терапевтическую эффективность (клинико-эндоскопическая, бесстероидная ремиссия) у бионаивных пациентов с БК с факторами неблагоприятного прогноза, получающих УСТ 90 мг подкожно каждые 8 недель.
Материал и методы. Для оценки эффективности препарата УСТ включили в исследование 38 бионаивных пациентов с БК, имевших в дебюте заболевания факторы неблагоприятного прогноза, которые были рандомизированы в две группы пациентов, получавших препарат в режиме 90 мг подкожно один раз в 12 недель (первая группа, n = 20) и 90 мг подкожно один раз в 8 недель (вторая группа, n = 18). Проанализированы пол, возраст пациента, в том числе на момент постановки диагноза, тяжесть и протяженность БК; наличие кишечных осложнений; наличие и локализация внекишечных проявлений; предшествующее лечение.
Результаты. Клинический ответ и клиническая ремиссия были достигнуты у 19 (95,0%) пациентов первой группы и 18 (100,0%) пациентов второй группы (p > 0,05). В первой группе сохранили клиническую ремиссию (без потребности в оптимизации терапии) к 52-й неделе наблюдения 18 (90,0%) пациентов, во второй группе – 18 (100,0%) пациентов, что не имело статистической значимости (p = 0,516; χ2 = 1,9; отношение шансов (ОШ) 1,0). В первой группе достигли и сохраняли к 52-й неделе наблюдения эндоскопическую ремиссию 10 (50,0%) пациентов, во второй группе – 16 (88,9%) пациентов (p = 0,01492; χ2 = 6,631; ОШ 8,00; 95% ДИ 1,445–44,298). В течение одного года наблюдения у 10 (50,0%) пациентов первой группы сохранялась клинико-эндоскопическая ремиссия БК, у 8 (40,0%) пациентов сохранялись клинический ответ и клиническая ремиссия (снижение ≥ 100 баллов от исходного ИАБК), у 16 (88,9%) пациентов второй группы сохранялась клинико-эндоскопическая ремиссия БК, у 2 (11,1%) пациентов сохранялись клинический ответ и клиническая ремиссия. Клинико-эндоскопическая ремиссия у пациентов с БК, получавших препарат УСТ, достигнута во второй группе (p = 0,01492; χ2 = 6,631). Бесстероидная ремиссия у пациентов 1-й группы составила 65,0%, а у больных БК 2-й группы – около 95% (p = 0,04502).
Заключение. Данное клиническое наблюдение продемонстрировало статистически значимо более высокую терапевтическую эффективность (клинико-эндоскопическая, бесстероидная ремиссия) у бионаивных пациентов с БК с факторами неблагоприятного прогноза, получающих УСТ 90 мг подкожно каждые 8 недель.





Болезнь Крона (БК) – хроническое рецидивирующее заболевание желудочно-кишечного тракта (ЖКТ) неясной этиологии, характеризующееся трансмуральным, сегментарным, гранулематозным воспалением с развитием местных и системных осложнений [1].
Цели терапии БК соответствуют стратегии «trеat to target», что согласуется с понятием «лечение до достижения цели» [2]. Концепция направлена на достижение долгосрочного эффекта лечения, клинической ремиссии и ее долгосрочного поддержания без глюкокортикоидов (ГК), заживление слизистой оболочки кишки, профилактику осложнений, предупреждение оперативных вмешательств, улучшение качества жизни и снижение частоты инвалидизации у пациентов с БК. Дополнительными критериями эффективности проводимой терапии БК являются трансмуральное заживление стенки кишки, гистологическая и иммунобиологическая ремиссия [2].
В настоящее время базисными препаратами для индукции и поддержания ремиссии у пациентов с БК являются иммуносупрессоры. Средствами для индукции ремиссии являются системные (преднизолон и метилпреднизолон) и топические (будесонид) ГК в комбинации с тиопуринами (азатиоприн (АЗА), меркаптопурин (МП)), метотрексат; средствами для поддержания ремиссии (противорецидивные средства) – тиопурины (АЗА, МП), метотрексат; препаратами, которые обеспечивают как индукцию ремиссии, так и профилактику рецидивов заболевания, – генно-инженерные биологические препараты (ГИБП) (инфликсимаб, адалимумаб и цертолизумаба пэгол), ингибиторы интерлейкинов (ИЛ) 12/23 (устекинумаб (УСТ)), селективные кишечные ингибиторы интегрина α4β7 (ведолизумаб), а также таргетные иммуносупрессоры (упадацитиниб) [1].
Несмотря на растущий выбор препаратов, у части пациентов с БК сохраняется персистирующее симптоматическое или бессимптомное воспаление, которое может привести к инвалидизации, снижению качества жизни и необходимости хирургических вмешательств [3].
Современный подход в здравоохранении, базирующийся на учете индивидуальных особенностей каждого пациента, определяется как персонализированный, предиктивный и партисипативный.
Для персонализированного подхода к совершенствованию лечения пациентов с БК необходимы разработка прогностических инструментов и рассмотрение всех существенных факторов для принятия оптимального клинического решения с учетом особенностей течения заболевания у конкретного пациента. Стратификация пациентов в зависимости от факторов неблагоприятного прогноза позволит определить оптимальную тактику и стратегию терапии БК.
Раннее начало биологической терапии у пациентов с БК ассоциировано с лучшими клиническими исходами по данным как рандомизированных клинических исследований (РКИ), так и реальной клинической практики. Раннее начало биологической терапии (в течение двух лет с момента постановки диагноза, или top-down подход) было ассоциировано с более высокой частотой клинической ремиссии (относительный риск (OР) 2,10; 95%-ный доверительный интервал (95% ДИ) 1,69–2,60; n = 2763; p < 0,00001), низкой частотой обострений (OР 0,31; 95% ДИ 0,14–0,68; n = 596; p = 0,003) и более высокой частотой заживления слизистой (OР 2,37; 95% ДИ 1,78–3,16; n = 994; p < 0,00001) по сравнению с поздним началом или стандартной терапией [4].
Определение факторов неблагоприятного прогноза позволяет выявить пациентов, нуждающихся в раннем начале терапии ГИБП для достижения целей терапии. В соответствии с резолюцией Совета экспертов (Санкт-Петербург, 2021 г.), пациентам с БК с факторами неблагоприятного прогноза рекомендован биологический препарат с системным действием. Такими факторами являются: возраст < 40 лет при установлении диагноза (раннее начало заболевания, начало в детском возрасте), вовлечение верхних отделов ЖКТ, наличие перианальных поражений БК (свищи прямой кишки и перианальной области), распространенное поражение кишечника > 100 см по сумме пораженных сегментов, глубокие язвы слизистой оболочки по данным эндоскопического исследования, стриктурирующая или пенетрирующая БК, наличие сопутствующих аутоиммунных заболеваний и внекишечных проявлений, потребность в назначении системных стероидов в дебюте болезни [5].
Факторы неблагоприятного прогноза течения БК определяют выбор эффективной терапии. Применение максимально эффективной противовоспалительной терапии (в период «окна возможности», который длится до 18 месяцев) – ключевой фактор, позволяющий достичь ремиссии либо минимальной активности БК путем подавления воспаления и предотвращения необратимых структурных повреждений стенки кишки и, как следствие, развития осложнений.
ГИБП имеют преимущества при назначении на ранней стадии БК, если у пациентов есть факторы неблагоприятного прогноза и неэффективность стандартной терапии в течение 3–6 месяцев. Высокая активность БК и наличие факторов неблагоприятного прогноза могут определять целесообразность раннего применения ГИБП независимо от периода заболевания [5].
Одним из ГИБП для лечения БК средней или тяжелой степени является УСТ, зарегистрированный в РФ для терапии БК в 2019 г., представляющий полностью человеческое моноклональное антитело, обладающее высокой специфичностью к субъединице р40 ИЛ-12 и ИЛ-23, провоспалительных цитокинов, играющих ключевую роль в дифференцировке и пролиферации Т-лимфоцитов по Th-1, -2, -17 путям и развитии воспалительных заболеваний кишечника (ВЗК). УСТ блокирует биологическую активность ИЛ-12 и ИЛ-23, предотвращая связывание р40 с рецептором ИЛ-12R-β1, экспрессируемым на поверхности иммунных клеток. РКИ по индукционной эффективности УСТ у пациентов с БК UNITI-1 и UNITI-2 продемонстрировали статистически значимо более высокие показатели клинического ответа и ремиссии у пациентов, получавших УСТ, по сравнению с пациентами, получавшими плацебо [6]. Пациенты, участвовавшие в исследованиях, были рандомизированы для участия в исследовании поддерживающей терапии IM-UNITI, которое также показало значимо более высокую эффективность у пациентов, получавших УСТ, по сравнению с группой плацебо на 44-й неделе с обоими интервалами подкожного введения: 90 мг каждые 8 или каждые 12 недель [6].
В реальной клинической практике пациенты с БК не имеют жесткой стратификации, как при включении пациентов в РКИ, они более гетерогенны по фенотипическим и внекишечным проявлениям, эндоскопической картине. Несмотря на то что клинические исследования, а также данные реальной клинической практики продемонстрировали клиническую эффективность и безопасность УСТ у пациентов с БК, данные о режимах дозирования и оптимизации дозы при назначении УСТ, а также установление возможных предикторов необходимости изменения режима дозирования остаются ограниченными [7–14]. Имеются данные, свидетельствующие, что высокий исходный уровень С-реактивного белка (СРБ) – показатель, который считается предиктором интенсификации режима дозирования УСТ [15]. Есть работы, демонстрирующие, что оптимальный режим дозирования УСТ 90 мг подкожно каждые 8 недель целесообразен в когорте больных с предшествующей терапией ГИБП [16].
Цель исследования – изучение эффективности препарата УСТ в зависимости от режима дозирования у бионаивных пациентов с БК, имеющих в дебюте заболевания факторы неблагоприятного прогноза.
Материал и методы
Данное исследование является ретро- и проспективным, открытым. Для оценки эффективности препарата УСТ в зависимости от режима введения мы включили в исследование бионаивных пациентов с БК, имеющих в дебюте заболевания факторы неблагоприятного прогноза [5]. Исследование проводили в отделении патологии кишечника Московского клинического научно-практического центра (МКНЦ) им. А.С. Логинова с оценкой эффективности терапии не менее 12 месяцев от начала лечения. Сбор данных для анализа осуществляли с января 2020 г. по сентябрь 2023 г.
Диагноз БК устанавливали на основании клинических, эндоскопических, рентгенологических и гистологических методов исследования. Исключали активный и латентный туберкулез.
В отделении патологии кишечника МКНЦ им. А.С. Логинова проведено рандомизированное исследование. 38 бионаивных пациентов с активной БК с факторами неблагоприятного прогноза были разделены на две группы, которые получали УСТ после индукционного введения в режиме 90 мг подкожно один раз в 12 недель (первая группа) и 90 мг один раз в восемь недель (вторая группа).
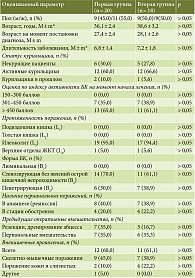
Нами проанализированы следующие характеристики пациентов обеих групп: пол; возраст пациента; возраст на момент постановки диагноза; длительность заболевания; тяжесть и протяженность БК; наличие кишечных осложнений – абсцесс, анальная трещина, свищи, стриктура прямой кишки, стриктура, острая кишечная непроходимость, перфорация, инфильтрат; наличие и локализация внекишечных проявлений (ВКП) на момент начала терапии УСТ – артрит, артралгия, иридоциклит, увеит, узловатая эритема, гангренозная пиодермия, афтозный стоматит, первичный склерозирующий холангит, аутоиммунный гепатит; наличие перианальных поражений и хирургических вмешательств (табл. 1), предшествующее лечение: терапия препаратами 5-аминосалициловой кислоты (5-АСК), иммуносупрессорами, ГК (табл. 2), а также исходные клинико-лабораторные показатели перед началом терапии УСТ (табл. 3).
Таким образом, обе группы пациентов были сопоставимы по всем анализируемым клиническим, демографическим и лабораторно-инструментальным показателям. Большинство пациентов, включенных в исследование, имели длительный анамнез БК (около семи лет), 35,0% пациентов первой группы и 38,9% пациентов второй группы имели среднетяжелое течение заболевания; 65,0 и 61,1% – тяжелое течение заболевания; преимущественно (около 95%) в обеих группах заболевание носило форму илеоколита, у 60,0% пациентов первой группы и у 61,1% пациентов второй группы были отмечены ВКП.
Показанием для назначения УСТ служили наличие у пациента двух и более факторов неблагоприятного прогноза – статус курильщика, возраст более 40 лет при установлении диагноза, вовлечение верхних отделов ЖКТ, наличие перианальных поражений БК, стриктурирующая или пенетрирующая БК, наличие ВКП и пр.
До начала исследования больные первой и второй групп получали иммуносупрессоры (90,0 и 94,4%) и ГК (95,0 и 100,0%) соответственно; часть пациентов получали месалазин с высвобождением в дистальных отделах тонкой кишки с этилцеллюлозным покрытием (30,0 и 44,4%); ГИБП не получал ни один пациент (0,0%).
Эффективность оценивали по клинической ремиссии и ответу в период индукции и на 52-й неделе, динамике эндоскопических показателей к 52-й неделе терапии. Клиническую ремиссию определяли как исчезновение клинических симптомов заболевания, снижение индекса активности БК (ИАБК) менее 150 баллов и лабораторных показателей воспалительного процесса (скорость оседания эритроцитов (СОЭ), СРБ). Клинический ответ характеризовался существенным уменьшением клинических симптомов и лабораторных показателей воспаления, снижением ИАБК не менее 100 баллов от исходного (табл. 4).
Эндоскопический ответ оценивали по простому индексу эндоскопической активности БК (ИЭАБК/SES-CD), который основан на оценке выраженности четырех эндоскопических признаков в баллах от 0 до 3 в 5 илео-толстокишечных сегментах (табл. 5) [1]. Подсчитывается сумма баллов в каждом из пяти обследованных сегментов кишечника (илеум, правая половина толстой кишки, поперечно-ободочная кишка, левые отделы и прямая кишка), и окончательный расчет производится по формуле: SES-CD = сумма всех баллов – 1,4 × количество пораженных участков.
Степень тяжести БК оценивали по ИАБК (табл. 4). Через восемь недель после введения инициирующей дозы УСТ вводили подкожно в дозе 90 мг (первое подкожное введение). Для подкожного введения использовали препарат УСТ в лекарственной форме «раствор для подкожного введения».
Согласно инструкции по медицинскому применению, пациенты, которые теряют ответ на лечение при применении УСТ 90 мг подкожно каждые 12 недель, могут воспользоваться увеличением частоты дозирования – каждые восемь недель.
Критерии оценки лечения:
- ранний клинический ответ (динамика клинических симптомов и эндоскопической картины и ВКП на первой, второй неделе терапии и после индукционного курса на восьмой неделе лечения) – снижение ≥ 100 баллов от исходного ИАБК;
- клиническая ремиссия отсутствие симптомов БК (соответствует значению ИАБК < 150);
- достижение и поддержание клинической ремиссии (стойкая ремиссия) на протяжении 52 недель после начала терапии;
- эндоскопическая ремиссия – соответствие значению простого эндоскопического индекса тяжести БК (SES-CD ≤ 3) через 52 недели от начала терапии;
- бесстероидная ремиссия – отмена терапии ГК без повторного назначения в течение 12 месяцев у пациентов, исходно получающих ГК.
Исследование «Опыт применения устекинумаба у пациентов с болезнью Крона с факторами неблагоприятного прогноза в реальной клинической практике» было согласовано с локальным этическим комитетом МКНЦ им. А.С. Логинова. Пациенты подписывали письменное информированное согласие на участие в настоящем исследовании.
Статистический анализ проводили с помощью компьютерной программы IBM SPSS Statistics 24.0 (StatSoft Inc, США). Анализ качественных параметров проводили по частотам встречаемости. Для описания количественных переменных использовали методы описательной статистики: среднее (Mean), стандартная ошибка среднего (Std. Error).
В качестве количественных показателей оценивали среднее и стандартное отклонение, или среднее и диапазон, или интерквартильный диапазон показателей без нормального распределения. Качественные показатели оценивали в процентах и с помощью 95% ДИ.
Результаты
Клинический ответ
Пациентам обеих групп УСТ назначали в индукционной дозе 260–520 мг в зависимости от массы тела внутривенно капельно. Ранний ответ на терапию УСТ в течение одной недели, характеризующийся уменьшением интенсивности абдоминального болевого синдрома, урежением частоты стула и улучшением общего самочувствия, был отмечен у 14 (70,0%) из 20 пациентов первой группы и у 16 (88,9%) из 18 пациентов второй группы, включенных исследование. Скорость достижения клинического ответа в нашем исследовании сопоставима с данными, полученными при анализе опросников пациентов, включенных в исследование UNITI-1 [17].
Через две недели после индукционного введения УСТ у 19 (95,0%) пациентов первой группы и у 18 (100,0%) пациентов второй группы отмечено снижение ИАБК более чем на 100 баллов (улучшение общего самочувствия, уменьшение частоты стула, интенсивности абдоминального болевого синдрома, патологических примесей в кале), зарегистрировано снижение лабораторных показателей активности воспалительного процесса (СОЭ, СРБ, лейкоциты, фекальный кальпротектин (ФКП)).
К концу восьмой недели терапии у 19 (95,0%) пациентов первой группы было отмечено достижение клинической ремиссии и показателей клинического ответа по ИАБК, у 1 (5,0%) пациента в связи прогрессированием заболевания (сохраняющейся диареей, абдоминальным болевым синдромом, анемией, лейкоцитозом, сохраняющимся высоким уровнем СРБ, СОЭ и прокальцитонина), характеризующегося нарастанием явлений кишечной непроходимости, были назначены терапия ГК, антибактериальная терапия, в последующем выполнено хирургическое вмешательство. К концу восьмой недели терапии у 18 (100,0%) пациентов второй группы было отмечено достижение клинической ремиссии и показателей клинического ответа по ИАБК.
Таким образом, клинический ответ и клиническая ремиссия по ИАБК у бионаивных пациентов с БК, получивших внутривенный индукционный курс УСТ и одно подкожное введение, в течение восьми недель достигнуты у 19 (95,0%) пациентов первой группы
и у 18 (100,0%) пациентов второй группы (p > 0,05).
Клиническая ремиссия
Вторичная конечная точка – через 52 недели. Через 52 недели от индукционного введения УСТ у 1 (5,0%) пациента первой группы развилось «ускользание» эффекта терапии УСТ. У пациента на фоне поддерживающей терапии УСТ 90 мг подкожно один раз в 12 недель было отмечено ухудшение общего самочувствия, увеличение частоты стула, консистенция стула 5–6-го типа по Бристольской шкале через девять недель после очередного введения УСТ, в связи с чем было принято решение об изменении схемы поддерживающей терапии с интервала один раз в 12 недель до одного раза в восемь недель.
У 18 (100,0%) пациентов второй группы, достигших клинического ответа и клинической ремиссии к восьмой неделе от момента введения УСТ, к 52-й неделе сохранялась клиническая ремиссия, отмечено значительное уменьшение или нормализация частоты стула, консистенция стула 3–5-го типа по Бристольской шкале, ИАБК составил менее 150 баллов (p > 0,05 между группами).
Однако лабораторные показатели активности воспалительного процесса зависели от схемы терапии УСТ.
Проведено сравнение основных лабораторных показателей воспалительного процесса между группами через 52 недели от начала терапии УСТ – концентрация СРБ, гемоглобина, сывороточного железа, уровень лейкоцитов, тромбоцитов и ФКП.
Сравнение основных лабораторных показателей представлено в табл. 6.
Таким образом, при сравнении лабораторных показателей между пациентами первой и второй групп через 52 недели от начала терапии УСТ не было достоверной разницы между концентрацией СРБ, сывороточного железа, уровнем гемоглобина, лейкоцитов, СОЭ. Однако статистическая разница между группами установлена для уровня тромбоцитов и ФКП. Для большей объективности выявления связи между режимом дозирования УСТ и лабораторными показателями необходимо продолжить динамическое наблюдение в случае отсутствия признаков «ускользания» ответа на проводимую терапию. Это необходимо для выявления предиктивной значимости тех или иных маркеров воспаления для своевременной оптимизации терапии до наступления клинических симптомов обострения заболевания.
При анализе общей когорты пациентов с БК в первой группе клинической ремиссии достигли и сохраняли ее (без потребности в оптимизации терапии) к 52-й неделе наблюдения 18 (90,0%) пациентов, во второй группе – 18 (100,0%) пациентов, что не имело статистической значимости (p = 0,516; χ2 = 1,9; отношение шансов (ОШ) 1,0). Это свидетельствует о клинической эффективности препарата УСТ у бионаивных пациентов вне зависимости от режима поддерживающей терапии.
Эндоскопическая ремиссия
Большинство пациентов с клинической ремиссией на 52-й неделе достигли также улучшения эндоскопической картины со стороны слизистой оболочки кишечника различной степени. Через 52 недель от индукционного курса УСТ эндоскопическое исследование было проведено всем (100,0%) пациентам с БК в обеих группах.
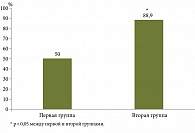
Клинически значимое эндоскопическое улучшение (SES-CD: уменьшение ≥ 3 от исходного уровня) зарегистрировано у 5 (25,0%) из 20 пациентов первой группы, у 1 (5,5%) из 18 пациентов второй группы. Клинически значимый эндоскопический ответ (SES-CD: уменьшение ≥ 50% от исходного уровня) – у 3 (15,0%) пациентов первой группы и у 1 (5,5%) пациента второй группы. Клинически значимая эндоскопическая ремиссия (SES-CD: общая сумма баллов ≤ 2) и заживление слизистой (полное отсутствие язв) достигнуты у 10 (50,3%) пациентов первой группы и у 16 (88,9%) пациентов второй группы.
При статистическом анализе полученных результатов у пациентов с БК в первой группе достигли и сохраняли к 52-й неделе наблюдения эндоскопическую ремиссию 10 (50,0%) пациентов, во второй группе – 16 (88,9%) пациентов, что имело статистически значимую разницу (p = 0,01492; χ2 = 6,631; ОШ 8,00; 95% ДИ 1,445–44,298) (рис. 1).
У пациентов с БК, имевших факторы неблагоприятного прогноза, достижение эндоскопической ремиссии, характеризующейся заживлением слизистой оболочки (полное отсутствие язв), зависело от режима введения УСТ. Эндоскопическая эффективность УСТ в режиме дозирования 90 мг один раз в восемь недель была статистически значимо выше, чем в группе пациентов с БК, получавших УСТ в режиме дозирования 90 мг один раз в 12 недель.
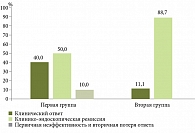
Таким образом, за год наблюдения у 10 (50,0%) пациентов первой группы сохранялась клинико-эндоскопическая ремиссия БК, у 8 (40,0%) пациентов сохранялись клинический ответ и клиническая ремиссия (снижение ≥ 100 баллов от исходного ИАБК), 2 (10,0%) пациента имели первичную неэффективность или «ускользание» ответа на терапию УСТ. Во второй группе
у 16 (88,9%) пациентов сохранялась клинико-эндоскопическая ремиссия БК, у 2 (11,1%) пациентов сохранялись клинический ответ и клиническая ремиссия (снижение ≥ 100 баллов от исходного ИАБК, но ИАБК > 150 баллов), ни один пациент не имел первичную неэффективность или вторичную потерю ответа на терапию УСТ в течение года наблюдения (рис. 2).
Максимальная терапевтическая эффективность (клинико-эндоскопическая ремиссия), являющаяся прогностически благоприятным фактором течения заболевания, у пациентов с БК, получавших препарат УСТ, была достигнута во второй группе (p = 0,01492; χ2 = 6,631).
Бесстероидная ремиссия
За весь период наблюдения из 38 (100%) бионаивных пациентов с БК, получавших УСТ, не ответили на терапию (первичная неэффективность) или отмечено «ускользание» ответа на терапию у 2 (10,0%) пациентов первой группы, во второй группе все пациенты ответили на проводимую терапию и сохраняли клиническую ремиссию за весь период наблюдения. Все пациенты на момент инициации получали ГК в средней терапевтической дозе 36,6 ± 6,2 мг. После индукционного курса УСТ преднизолон был отменен у 13 (65,0%) пациентов первой группы и у 17 (94,4%) пациентов второй группы, ответивших на лечение (p = 0,04502; χ2 = 4,942; ОШ 9,154; 95% ДИ 0,998–83,969).
Таким образом, бесстероидная ремиссия у бионаивных пациентов с БК, имеющих факторы неблагоприятного прогноза и получающих УСТ в течение 12 месяцев каждые 12 недель, составляет 65,0%, а у больных БК, получающих УСТ в течение 12 месяцев каждые восемь недель, – около 95% (p = 0,04502).
В последующем, через 52 недели наблюдения повторное назначение ГК по поводу обострения заболевания или «ускользания» ответа на УСТ потребовалось у 2 (10,0%) из 20 пациентов первой группы и у 1 (5,5%) из 18 пациентов второй группы.
Внекишечные проявления
Внекишечные проявления БК до начала терапии УСТ были зарегистрированы у 12 (60,0%) из 20 пациентов первой группы и у 11 (61,1%) из 18 пациентов с БК второй группы. У большинства пациентов с ВКП (9 (45,0%) пациентов первой группы и 7 (38,9%) – второй) имелись скелетно-мышечные проявления (артралгии, периферические артриты, аксиальные поражения), поражения кожи и слизистых – у 3 (15,0%) пациентов первой группы и у 4 (22,2%) пациентов второй группы.
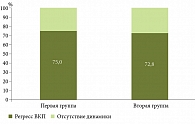
К 52-й неделе положительная динамика, характеризующаяся клинически значимым уменьшением или исчезновением кожных проявлений, болевого суставного синдрома и регрессом со стороны слизистых оболочек, наблюдалась у 75,0% пациентов (9 из 12) первой группы, имевших ВКП, и у 72,8% пациентов (8 из 11) второй группы (рис. 3). Таким образом, статистически значимой разницы в купировании ВКП между группами не было (p > 0,05).
Утяжеление симптомов и появление новых ВКП любой локализации не наблюдались ни у одного пациента вне зависимости от режима дозирования.
Обсуждение
Повышение эффективности терапии ГИБП остается актуальной проблемой в реальной клинической практике как у небионаивных, так и бионаивных пациентов с БК. Несмотря на наличие общепринятых схем назначения УСТ согласно инструкции к применению, необходим персонализированный подход к ведению пациентов, который должен учитывать линию терапии, наличие факторов неблагоприятного прогноза, предикторы эффективности/неэффективности терапии, которые адаптированы к конкретной ситуации [5].
Как мы указывали выше, при выборе терапии важно оценить наличие у пациента факторов неблагоприятного прогноза заболевания на момент установления диагноза [5, 18]. Мировое гастроэнтерологическое сообщество единодушно в плане оптимально раннего назначения ГИБП с учетом лучшего прогноза течения заболевания, снижения рисков инвалидизации пациентов, повышения качества жизни больных ВЗК [2]. Позиция ECCO 2017 и 2020 гг. заключается в следующем: пациенты с клиническими признаками плохого прогноза являются наиболее подходящими для раннего назначения иммуносупрессивной терапии. Раннюю терапию ГИБП следует начинать у пациентов с высокой активностью заболевания и особенностями, указывающими на плохой прогноз, у пациентов с агрессивным течением заболевания или высоким риском плохого прогноза [19, 20].
Британская ассоциация гастроэнтерологов также заключает, что у пациентов с агрессивным течением заболевания или высоким риском плохого прогноза следует рассмотреть раннее назначение ГИБП. Высокий риск включает наличие стриктурирующей или пенетрирующей БК, перианальные свищи, возраст начала заболевания до 40 лет, необходимость в ГК в дебюте. Выбор между ГИБП проводится с учетом индивидуальных особенностей пациента, также учитываются предпочтения пациента, комплаентность, безопасность и скорость развития ответа на препарат, стоимость лечения [21].
Мнение экспертов Американской гастроэнтерологической ассоциации содержит следующие ключевые аспекты: активность заболевания и прогноз определяют потребность пациента в использовании биологической терапии; пациент с плохим прогнозом не должен проходить традиционный step-up-подход. В новом подходе к лечению врач должен на раннем этапе заболевания сразу же использовать ГИБП, если этого требуют активность и/или прогноз заболевания у пациента [22]. У пациентов со среднетяжелым/тяжелым язвенным колитом рекомендовано раннее применение ГИБП вместе с иммуномодуляторами или без них, вместо последовательной step-up-терапии после неэффективности 5-аминосалицилатов. Пациенты, у которых наблюдается менее тяжелое течение заболевания и которые придают большее значение безопасности 5-АСК-терапии, чем эффективности ГИБП, могут выбрать последовательную терапию [23].
Таким образом, в настоящее время ни у кого не вызывает сомнения, что раннее назначение ГИБП в период «окна возможности» (до 18 месяцев от появления симптомов заболевания) является ключевым фактором, позволяющим достичь максимальной эффективности терапии – клинико-эндоскопической ремиссии заболевания, бесстероидной ремиссии, модификации заболевания путем подавления активного воспаления и предотвращения развития необратимых структурных повреждений стенки кишки и развития как кишечных осложнений, так и потенциальных ВКП.
Однако еще недостаточно исследований по раннему применению биологических препаратов (помимо поэтапного подхода) с фокусировкой на профилактику осложнений и исходов, модифицирующих течение болезни с учетом обоснования каждого фактора риска прогрессирования заболевания (возраст, распространенное поражение, поражение верхних отделов пищеварительного тракта и пр.) [20].
Е.В. Сосновской и соавт. представлено клиническое наблюдение пациента 34 лет с БК. В статье отражены особенности клинического течения заболевания, постановки клинического диагноза, тактики консервативного лечения и выбора биологического препарата с позиции долгосрочной эффективности и фактора молодого возраста пациента с БК [24].
Таким образом, необходим анализ влияния каждого фактора и их различных комбинаций в оценке риска прогрессирования заболевания – возраст пациента, распространенность поражения кишки, ранняя потребность в назначении ГК, перианальные поражения, фенотипический вариант, вовлечение верхних отделов ЖКТ, отсутствие заживления слизистой оболочки при достижении клинической ремиссии, статус курильщика, наличие эпителиоидных гранулем, сопутствующих аутоиммунных заболеваний и ВКП. Но помимо учета факторов неблагоприятного прогноза течения ВЗК, которые предопределяют ранее назначение ГИБП с целью достижения максимальной эффективности терапии заболевания, необходимо продолжить исследования по раннему назначению оптимизированных схем ГИБП.
Заключение
Наше клиническое наблюдение в группе бионаивных пациентов с БК, как и многочисленные исследования, проводимые в мире, продемонстрировало высокую эффективность УСТ в индукционной и поддерживающей терапии в когорте больных с тяжелым и среднетяжелым течением заболевания, резистентных к стандартной терапии [25–28]. Имеющиеся на сегодняшний день данные позволяют рассматривать УСТ как препарат выбора у бионаивных пациентов со средней и тяжелой степенью БК, имеющих факторы неблагоприятного прогноза. Для достижения наилучшего результата следует применять персонализированный подход к каждому пациенту в выборе режима введения препарата. Выбор режима 90 мг подкожно один раз в восемь недель может являться более предпочтительным у пациентов с БК, имеющих факторы неблагоприятного прогноза [5]. Целесообразно дальнейшее проведение анализа результатов реальной клинической практики для установления связи между оптимальным режимом дозирования в начале лечения и осложненным течением БК (оперативные вмешательства по поводу БК в анамнезе, свищевая и пенетрирующая формы и пр.), лабораторными показателями активности заболевания (высокий исходный уровень СРБ, ФКП, анемия, лейкоцитоз), а также установление предикторов необходимости изменения режима дозирования на раннем этапе лечения пациентов.
Авторы заявляют об отсутствии конфликта интересов.
O.V. Knyazev, PhD, Prof., O.B. Schukina, PhD, Prof., A.V. Kagramanova, PhD, A.A. Lischinskaya, PhD, I.A. Li, PhD, E.A. Sabelnikova, PhD, Prof., B.A. Nanaeva, PhD, N.A. Fadeeva, PhD, T.V. Shkurko, PhD, K.A. Nikolskaya, PhD, N.V. Lazuka, A.I. Parfenov, MD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
A.N. Ryzhikh National Medical Research Centre for Coloproctology
Pavlov University, St. Petersburg
Research Institute of Health Organization and Medical Management, Moscow
Russian University of Medicine, Moscow
Contact person: Oleg V. Knyazev, o.knyazev@mknc.ru
The purpose of this study was to study the effectiveness of ustekinumab (UST) depending on the dosage regimen (90 mg subcutaneously once every 8 or 12 weeks) in patients with Crohn's disease (CD) who have unfavorable prognosis factors.
Material and methods. To assess the effectiveness of the drug, we included in the study 38 patients with CD who had unfavorable prognosis factors, who were randomized into two groups of patients who received the drug in a 90 mg subcutaneous regimen once every 12 weeks (1-st group, n = 20) and 90 mg subcutaneously once every 8 weeks (2-nd group, n = 18). The gender and age of the patient were analyzed, including at the time of diagnosis, the severity and prevalence of CD; the presence of intestinal complications; the presence and localization of extra-intestinal manifestations; previous treatment was analyzed.
Results. Clinical response and clinical remission were achieved in 19 (95.0%) patients of the first group and 18 (100.0%) patients of the second group (p > 0.05). Clinical remission was maintained (without the need for optimization of therapy) by the 52 week of follow-up in 18 (90.0%) patients, in the second group – 18 (100.0%) patients (p = 0.516). In the 1-st group 10 (50.0%) patients achieved and maintained endoscopic remission by the 52 week of follow-up, in the 2-nd group – 16 (88.9%) patients (p = 0.01492). During one year of follow-up, 10 (50.0%) patients of the 1-st group maintained clinical and endoscopic remission of CD, 8 (40.0%) patients maintained clinical response and clinical remission (a decrease of ≥ 100 points from the initial CDAI), 16 (88.9%) patients in the 2-nd group maintained clinical and endoscopic remission of CD. Clinical response and clinical remission were maintained in 2 (11.1%) patients. Clinical and endoscopic remission in patients with CD receiving the drug was achieved in the 2-nd group (p = 0.01492). Without steroidal remission in patients in 1-st group was 65.0%, and in in 2-nd group about 95% (p = 0.04502).
Conclusion. This clinical observation demonstrated statistically significantly higher therapeutic efficacy (clinico-endoscopic, without steroidal remission) in CD patients with adverse prognosis factors receiving UST 90 mg subcutaneously every 8 weeks.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.