Эпидемиологические аспекты первично-множественного рака эндометрия на основе анализа выживаемости
- Аннотация
- Статья
- Ссылки
- English


Введение
В настоящее время в мире насчитывается свыше 1,2 млн женщин, страдающих раком органов репродуктивной системы [1]. Тенденции динамики заболеваемости данной патологией в отдельных географических регионах мира свидетельствуют об увеличении числа вновь заболевших раком эндометрия [1, 2]. По наблюдениям SEER (Surveillance, Epidemiology, and End Results Program) Национального института рака США, годовой прирост рака эндометрия в 2003–2012 гг. составил 1,1%, причем показатели заболеваемости более чем в два раза превысили российские [2].
В России также отмечается рост показателей заболеваемости раком эндометрия [3–5]. Высокие показатели заболеваемости определяют профилактику рака органов женской репродуктивной системы как приоритетное направление в здравоохранении всех стран мира. Рак эндометрия занимает второе место среди опухолей репродуктивной системы у женщин после рака молочной железы. Удельный вес рака эндометрия в России в 2017 г. составил 7,8% среди всех злокачественных новообразований у женщин [5].
Заболеваемость раком эндометрия ежегодно растет. В 2017 г. в Челябинской области этот показатель составил 37,66 на 100 тыс. женского населения. Грубый показатель заболеваемости раком эндометрия в 2017 г. по России составил 33,11 на 100 тыс. женского населения, среднегодовой темп прироста – 3,25%. Показатель одногодичной летальности остается высоким – 9,5% в 2017 г. (общероссийский – 8,2%). При этом в 2017 г. преобладали I и II стадии заболевания – 62,1 и 19,1% соответственно (по России – 84,1%). Показатель запущенности рака эндометрия в Челябинской области в 2017 г. был ниже общероссийского – 12,9 против 14,5% соответственно. Стандартизованный показатель смертности от рака эндометрия в Челябинской области в 2017 г. составил 4,36 на 100 тыс. населения (общероссийский – 4,00 на 100 тыс. населения) [4, 5].
Выделяют два патогенетических варианта рака эндометрия [6–11]. Ряд авторов указывают на преобладание первого патогенетического варианта, характеризующегося эндокринно-обменными нарушениями, что обусловливает большую гормонозависимость и гормоночувствительность рака эндометрия, его меньшую автономность и агрессивность, а следовательно, лучший прогноз [6–10].
Заболеваемость первично-множественным раком (ПМР) в России неуклонно растет. В 2017 г. данный показатель составил 34,1 на 100 тыс. населения (впервые выявлено 50 100 больных ПМР), или 8,1% от всех впервые выявленных больных злокачественными новообразованиями. В Челябинской области в 2017 г. выявлено 1526 больных ПМР (9,2% от всех впервые выявленных больных злокачественными новообразованиями в Челябинской области) [4].
Более высокие показатели заболеваемости злокачественными новообразованиями в Челябинской области по сравнению с РФ свидетельствуют о более высокой частоте ПМР в регионе. В официальных формах сведения о первично-множественных опухолях не классифицированы по нозологическим группам. Кроме того, такой информации недостаточно для анализа. Это делает проблему ПМР еще более актуальной.
Заболеваемость раком эндометрия в Челябинской области выше, чем в России в целом. Исходя из этого можно предположить, что частота ПМР (рак эндометрия может быть первой опухолью, второй и т.д.) в Челябинской области должна быть выше, чем в России.
Материал и методы
Объектом исследования стали больные первично-множественным раком эндометрия, получавшие лечение в Челябинском областном клиническом центре онкологии и ядерной медицины (ЧОКЦОиЯМ) с 1999 по 2013 г.
При обработке материала использовались рекомендации Международного агентства по изучению рака по определению ПМР: признание существования двух или более первичных злокачественных новообразований не зависит от времени их выявления. Новообразования считаются возникшими синхронно, если диагноз второго злокачественного новообразования был установлен менее чем через шесть месяцев после выявления первой опухоли. Опухоли, диагностированные с временным интервалом свыше шести месяцев, рассматриваются как метахронные. Последовательность возникновения опухолей устанавливали согласно классификации И.Ф. Зисмана и Г.Д. Кириченко (1978 г.): метахронные, синхронные, метахронно-синхронные и синхронно-метахронные.
Синхронные и метахронные опухоли делятся на мультицентрические множественные в одном органе, системные опухоли и опухоли парных органов, несистемные множественные опухоли различных органов [12]. К ПМР эндометрия относили сочетания двух и более опухолей, одна из которых локализовалась в эндометрии [7, 8, 12, 13].
При ведении популяционного ракового регистра в ЧОКЦОиЯМ используется компьютерная программа ООО «Новелл-СПб» и НМИЦ онкологии им. Н.Н. Петрова (научный разработчик). Показатели выживаемости онкологических больных Челябинской области рассчитывались в автоматизированном режиме. Использовалась компьютерная программа «Расчет показателей выживаемости» – приложение к ПРР ООО «Новелл-СПб» (свидетельство о госрегистрации № 2009610723 от 30 января 2009 г.), разработанное под руководством профессора В.М. Мерабишвили (ФГБУ «НИИ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург). Дата установления диагноза служила точкой отсчета на популяционном уровне. При расчете показателей выживаемости учитывались пол, состояние на конец года (жив, умер от злокачественных новообразований, от других заболеваний, в результате осложнений, связанных с лечением, выехал, диагноз не подтвердился), дата последнего контакта, причина и дата смерти, код диагноза, морфологический тип опухоли, стадия, дата выезда или снятия с учета. Для определения выживаемости в группе больных ПМР репродуктивной системы проводилась выборка по начальному и конечному годам установления диагноза, периоду наблюдения, нозологии, гистологии, диапазону гистологических опухолей, стадиям, диапазону стадий, полу, возрасту. Выбывшими считались больные с неподтвержденным диагнозом, выехавшие за пределы региона, те, у кого отсутствовала дата последнего контакта, и пациенты, информации о состоянии которых на конец года не было. Показатели скорректированной выживаемости рассчитывались актуриальным методом. Расчеты вероятной продолжительности жизни выполнялись с использованием таблиц смертности населения (Ni – число больных, оставшихся в живых через i лет после постановки диагноза и имевших риск умереть в интервале i,i + 1, где i = 0,..., j -1; Mi – число умерших в интервале i, i + 1; J – число лет наблюдения).
В настоящем исследовании проведен анализ скорректированной кумулятивной выживаемости женского населения Челябинской области с ПМР яичников за 2003–2012 гг. Показатель скорректированной выживаемости учитывает причины смерти больных только от злокачественных новообразований. Каждый отдельно взятый период расчета показателя отражает накопительный итог переживших указанные периоды (от исходного числа пациенток).
Методом сплошной выборки проведен ретроспективный анализ историй болезни больных ПМР эндометрия за 15 лет (1999–2013 гг.). Проанализированы сочетания, интервалы возникновения опухолей, возраст больных, а также скорректированная одногодичная, трех- и пятилетняя выживаемость больных полинеоплазией эндометрия в сравнении с солитарным раком эндометрия.
Результаты и их обсуждение
Проанализированы истории болезни 3115 больных раком эндометрия за 15-летний период. ПМР эндометрия зарегистрирован у 197 (6,3%) пациенток. Преобладали метахронные опухоли – 123 (62,43%) больные. Синхронные опухоли отмечались у 65 (32,9%) больных. У восьми (6,5%) пациенток имело место сочетание трех опухолей при метахронно-синхронном, синхронно-синхронном и синхронно-метахронном развитии. У одной (0,5%) больной наблюдалось сочетание четырех опухолей при метахронно-синхронном развитии. Рак правой молочной железы метахронно сочетался с карциносаркомой эндометрия с интервалом три года, раком шейки матки и базалиомой кожи лица с интервалом 24 года. Рак эндометрия был первой опухолью у 49 (39,8%) больных, второй опухолью – у 77 (62,6%), третьей – у шести (4,87%) пациенток при метахронном развитии. По гистологической структуре преобладали аденокарциномы высокой и умеренной степени дифференцировки (159 (80,7%) пациенток), что мы относили к первому патогенетическому варианту заболевания. Низкодифференцированные формы рака, а также саркомы матки были отнесены ко второму патогенетическому варианту рака эндометрия – 38 (19,2%) случаев.
Анализ сочетаний рака эндометрия показал, что чаще опухоль метахронно сочеталась со злокачественными новообразованиями яичников – 53 (43%) больных, раком молочной железы – 43 (35%) пациентки, реже – базальноклеточным раком кожи – 14 (11,4%), злокачественными новообразованиями шейки матки – три (2,4%) случая, раком щитовидной железы – шесть (4,87%), влагалища – два (1,6%), мочевого пузыря – три (2,4%), злокачественными новообразованиями толстой кишки – пять (4%) случаев (табл. 1). Интервал возникновения второй опухоли при метахронном развитии колебался от года до 29 лет при среднем интервале 9,0 ± 1,2 года. Интервал развития между второй и третьей опухолью составил 5,8 ± 0,5 года. Анализ возрастной структуры ПМР эндометрия показал, что средний возраст пациенток с первой опухолью – 58,4 ± 0,5 года, со второй опухолью – 67,6 ± 1,32 года. Отсутствие родов отмечалось у 11 (9%) больных ПМР эндометрия. Число родов варьировалось в пределах 1–12 (среднее значение – 2), абортов – в пределах 1–14 (среднее значение – 3). Выкидыши имели место у 12 (9%) больных, внематочная беременность – у двух (1,6%) пациенток.
Таким образом, ПМР эндометрия чаще протекал по первому патогенетическому варианту метахронно, был второй опухолью, чаще сочетался с гормонозависимыми опухолями других локализаций – раком яичников и молочной железы как при синхронном, так и метахронном развитии. Такие факторы риска, как бесплодие, отмечались у 9% больных ПМР эндометрия. Анализ сочетаний опухолей при синхронном раке эндометрия представлен в табл. 2.
Преобладал первый патогенетический вариант рака эндометрия – 48 (73,8%) больных. Как правило, рак эндометрия при синхронном развитии сочетался со злокачественными новообразованиями яичников – 25 (38,5%) и раком молочной железы (чаще левой) – десять (15,4%) случаев. У одной больной имела место тройная локализация опухоли при синхронном развитии (рак эндометрия синхронно сочетался с опухолью шейки матки и раком левой молочной железы).
Как показал расчет уровня скорректированной кумулятивной выживаемости в исследуемой группе пациенток с ПМР эндометрия, одногодичная выживаемость всей группы составила 97,9%, трехлетняя выживаемость – 76,9%. Пятилетний рубеж после установления диагноза перешагнули 65,5% больных.
Для сравнения были проведены расчеты скорректированной кумулятивной выживаемости больных всей популяции женского населения Челябинской области с установленным диагнозом рака эндометрия за тот же период. Один год пережили 86,9% больных, три года – 75,0%, свыше пяти лет – 70,4% пациенток с солитарным раком эндометрия.
Очевидно, что одногодичная и трехлетняя выживаемость в группе пациенток с ПМР эндометрия выше, чем во всей популяции больных раком эндометрия, во все указанные периоды. Показатель пятилетней выживаемости больных ПМР эндометрия оказался на 4,9% ниже, чем при солитарном раке эндометрия.
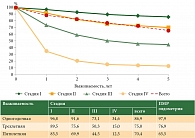
Кривая показателя скорректированной кумулятивной выживаемости в исследуемой группе расположилась между I и II стадией в общей популяции. По показателю одногодичной и двухлетней выживаемости кривая приблизилась к I стадии, а по показателю трех- и пятилетней выживаемости практически совпала с общей кривой показателя выживаемости в остальной популяции (рисунок).
Заключение
Частота ПМР эндометрия за 15 лет (1999–2013 гг.), по данным ГБУЗ «ЧОКЦОиЯМ», составила 6,3%. Преобладал первый патогенетический вариант заболевания (80,7%). Рак эндометрия чаще был второй опухолью, развивался метахронно (62,43%) при среднем интервале между первой и второй опухолью 9,0 ± 1,2 года, между второй и третьей – 5,8 ± 0,5 года. Средний возраст пациенток с первой опухолью составил 58,4 ± 0,5 года, со второй опухолью – 67,6 ± 1,2 года. Вторые опухоли развивались чаще в яичниках и молочной железе, то есть в гормонозависимых органах. Синхронные опухоли зарегистрированы у 32,9% больных. В большинстве случаев рак эндометрия синхронно сочетался со злокачественными новообразованиями яичников, молочной железы и ободочной кишки.
Анализ скорректированной общей кумулятивной выживаемости в исследуемой группе показал, что одногодичная и трехлетняя выживаемость у пациенток с ПМР эндометрия выше, чем во всей популяции больных раком эндометрия, во все указанные периоды. Показатель пятилетней выживаемости больных ПМР эндометрия на 4,9% ниже, чем при солитарном раке эндометрия. Улучшению показателей выживаемости в исследуемой группе способствовали радикальное лечение первой опухоли в силу преобладания локализованных стадий рака эндометрия и систематичность диспансерного наблюдения после лечения первой опухоли. Как метахронное, так и синхронное сочетание опухолей эндометрия не препятствует проведению радикального лечения каждой опухоли. Кроме того, преобладание первого патогенетического варианта, характеризующегося эндокринно-обменными нарушениями, обусловливает большую гормонозависимость и гормоночувствительность как солитарного, так и ПМР эндометрия, его меньшую автономность и агрессивность, а следовательно, лучший прогноз.
Проведенный анализ позволяет говорить о том, что больные, получившие лечение по поводу первичного рака эндометрия, находятся в группе риска по развитию гормонозависимых злокачественных новообразований других локализаций, вторых опухолей, имеющих общие этиопатогенетические факторы, такие как повышенная рецепция к прогестерону.
Первичная профилактика рака эндометрия (выявление и лечение предопухолевых поражений, таких как железистая и атипическая гиперплазия, а также полипы эндометрия) сегодня может проводиться и в отношении вторых и третьих опухолей. Система простых и доступных диагностических тестов, интегрированных в систему углубленного обследования больных раком эндометрия, злокачественных новообразований молочной железы и яичников, позволит своевременно выявлять гормонозависимую полинеоплазию. Оказание женщинам высококвалифицированной диагностической и лечебно-профилактической помощи, выявление предикторов, таких как рецепторы эстрогенов и прогестерона, которые предлагает активно развивающаяся медицинская наука, предотвратит впоследствии бурный рост рака эндометрия, в том числе первично-множественного.
S.A. Bekhtereva, PhD, A.S. Domozhirova, DM, Prof., A.V. Vazhenin, DM, Prof.
South Ural State Medical University
Chelyabinsk Regional Clinical Center of Oncology and Nuclear Medicine
Contact person: Svetlana Aleksandrovna Bekhtereva, Bekhterevasvetlana@gmail.com
The primary multiplicity of malignant tumors is the least studied area of oncology. The urgency of the problem is not in doubt due to the increase in the number of patients with polyneoplasia. This is especially pressing for the tumors of the female reproductive system. Based on the data of the Chelyabinsk Regional Clinical Oncological Dispensary for 15 years, the analysis was made of the frequency, combinations, intervals of tumors onset, age and survival of patients with polyneoplasia of the reproductive system on the example of primary multiple endometrial cancer.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.