количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
ЭПОХА: артериальная гипертония и ишемическая болезнь сердца как основные причины ХСН
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Кардиология и Ангиология" №1
- Аннотация
- Статья
- Ссылки
Ишемическая болезнь сердца (ИБС), артериальная гипертония (АГ) и сахарный диабет (СД) являются основными причинами формирования хронической сердечной недостаточности (ХСН) в современной медицине [1, 2].
Ишемическая болезнь сердца (ИБС), артериальная гипертония (АГ) и сахарный диабет (СД) являются основными причинами формирования хронической сердечной недостаточности (ХСН) в современной медицине [1, 2].
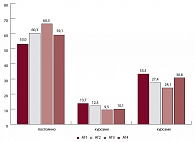
Рис. 1. Приверженность к терапии больных АГ в Европейской части РФ (ЭПОХА 2007)

Таблица 1. Распространенность гемодинамических факторов риска ССЗ среди больных ИБС в репрезентативной выборке Нижегородской области

Таблица 2. Средние уровни САД и ДАД среди больных ИБС и респондентов без ИБС в репрезентативной выборке Нижегородской области
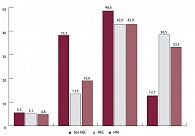
Рис. 2. Распространенность тахикардии среди больных ИБС в репрезентативной выборке Нижегородской области (ЭПОХА 2007)
В развитии ХСН также имеют большое значение клапанные пороки сердца, легочное сердце, кардиомиопатии [3–5] и нарушения ритма [6]. Однако основную роль, согласно данным эпидемиологических исследований, в развитии ХСН сегодня играет ИБС. Так, Teerlink J.R. [7] при анализе 31 эпидемиологического исследования по изучению распространенности ХСН определил как главную этиологическую причину заболевания в 50,3% случаев ИБС. В основных эпидемиологических исследованиях до 1990-х гг. по изучению ХСН конкурирующими этиологическими факторами были АГ и ИБС [8–10]. В эпидемиологических исследованиях после 1990-х гг. конкурирующими этиологическими факторами стали ИБС и кардиомиопатии [11].
По данным Framingham Heart Study [12] в 1971 году и New Zealand HF Study [13] в 1988 году, АГ оказалась основной этиологической причиной ХСН более чем у 70% и 60% больных соответственно. Через 20 лет в Framingham Heart Study в когорте пациентов с ХСН ИБС становится основной этиологической причиной среди 59% мужчин и 48% женщин. Но комбинация ИБС и АГ или присутствие одного из вышеназванных заболеваний встречалась в 90% случаев у больных ХСН. Изменение весомости этиологических причин формирования ХСН в Framingham Heart Study позволяет говорить о более эффективном лечении АГ в США, происшедшем за последние двадцать лет, и увеличении продолжительности жизни больных ИБС [14]. Этот факт подтверждает эпидемиологическое наблюдение NHANES I, II и III, проведенное в США в течение тридцати лет, которое указывает, что в настоящее время АГ уступила ИБС как основной этиологической причине развития ХСН [15, 16].
Высокая эффективность лечения АГ и ИБС приводит к минимизации риска развития ХСН при АГ и увеличения риска от ИБС: так называемый перекрест весомости этиологических причин формирования ХСН за счет повышения эффективности терапии. Оставаясь самым агрессивным этиологическим фактором, ИБС становится главенствующей причиной развития ХСН у пациентов. Было решено провести анализ весомости АГ и ИБС как двух основных этиологических причин (ИБС и АГ) в формировании ХСН и определить эффективность их лечения в репрезентативной выборке Европейской части РФ по данным исследования ЭПОХА 2007.
Материалы и методы
В 2007 году было проведено ЭПидемиологическое Обследование больныХ в Европейской чАсти России (ЭПОХА) (второй этап), позволившее выявить распространенность основных сердечно-сосудистых заболеваний в Европейской части РФ. Исследование охватило девять субъектов Европейской части России: Кировская, Нижегородская, Оренбургская, Рязанская и Саратовская области, Республики Татарстан и Чувашия, Пермский и Ставропольский края. В 2002 г. в исследовании приняли участие 286 врачей амбулаторно-поликлинического звена, которые обследовали 6780 семей. В исследование было включено 14548 респондентов. Данные, полученные в исследовании, можно экстраполировать на Европейскую часть РФ. Включение в репрезентативную выборку начиналось с возраста 10 лет.
Дизайн рандомизации представлен в журнале «Сердечная недостаточность» [17]. Для анализа выборки больных ХСН были определены мягкие и жесткие критерии постановки диагноза. К мягким критериям относились: наличие сердечно-сосудистого заболевания (ССЗ) (АГ, ИБС, перенесенные острый инфаркт миокарда (ОИМ), острое нарушение мозгового кровообращения (ОНМК), перемежающая хромота, пороки сердца) и более тяжелой степени одышка при обычной ходьбе. В сформированную группу респондентов включались пациенты с предположительным диагнозом ХСН I–IV функционального класса (ФК).
Для подтверждения диагноза ХСН был проведен госпитальный этап исследования. В ходе этого исследования респонденты, имеющие мягкие критерии ХСН, были госпитализированы в ЛПУ. Для верификации ФК ХСН у госпитализированных респондентов врачи стационаров кроме клинического осмотра проводили функциональное и инструментальное дообследование (ЭКГ, рентгенография грудной клетки, УЗИ сердца, тест 6-минутной ходьбы, вопросники клинического состояния). При наличии симптомов ХСН и хотя бы одного положительного инструментального исследования, и положительного теста 6-минутной ходьбы диагноз ХСН считался подтвержденным.
На догоспитальном этапе карты-вопросники, заполняемые исследователями, включали в себя не только паспортные данные, анамнез, но и клиническое состояние на момент осмотра, данные измерения артериального давления (АД) в положении сидя на обеих руках, указывалась принимаемая терапия с уточнением доз препаратов. АГ диагностировалась в том случае, если при измерении на обеих руках уровень среднего АД был 140/90 мм рт.ст. и выше. Степень АГ определялась по уровню АД в соответствии с классификацией ВНОК 2010 [18]. Диагноз ИБС выставлялся с использованием вопросника ROSE [19] и анализа имеющихся на руках выписных документов и клинического осмотра (анализ в статье представлен по данным репрезентативной выборки Нижегородской области).
Анализ принимаемой лекарственной терапии у больных АГ и ИБС проводился с помощью опроса, при этом врачи-исследователи не имели права влиять на ответы респондентов, и в картах-вопросниках указывались только те лекарственные средства, которые указывал пациент и подтверждал факт приема препаратов для лечения ССЗ. В карту заносились торговые названия лекарственных средств, доза и кратность их приема. Весь ряд лекарственных средств был разделен на рекомендованные ВНОК, и нерекомендованные препараты (прочие). Среди больных АГ эффективно леченными считались пациенты, принимающие любое гипотензивное лекарственное средство и имеющие уровень АД ниже 140/90 мм рт. ст. Контролируемым АД у пациентов с АГ считалось в том случае, если исследуемый при обследовании имел АД ниже 140/90 и принимал постоянно хотя бы одно пролонгированное гипотензивное средство в средней суточной дозе.
Для определения эффективности контроля АД у больных ИБС мы всех пациентов с ИБС разделили на четыре подгруппы: первая – применение препаратов базисной терапии ИБС в моно- или в комбинации: бета-блокаторы (ББ) и ингибиторы ангиотензин-превращающего фермента (ИАПФ); вторая – усиление базисной терапии рекомендованными ВНОК препаратами для лечения АГ (антагонисты кальция и/или диуретики); третья – применение базисной моно- или комбинированной терапии ИБС и прочих гипотензивных лекарственных средств; четвертая – применение только нерекомендованных ВНОК гипотензивных лекарственных средств.
Эффективность контроля частоты сердечных сокращений (ЧСС) определялась для больных ИБС. Эффективный контроль ЧСС считался для больных ИБС ниже 70 уд/мин. Для пациентов, перенесших ИМ, тахикардия как фактор риска (ФР) расценивалась при ЧСС выше 60 уд/мин. Комплаентность к терапии оценивалась по тактике приема гипотензивных препаратов, а именно: постоянно, курсами или при повышении АД. Медицинская статистическая обработка проводилась c помощью программного продукта OPENOFFICE на кафедре внутренних болезней и сестринского дела ГОУ ВПО НижГМА Росздрава.
Результаты и обсуждение
Основными этиологическими причинами развития ХСН в РФ являются АГ (88,0% случаев) и ИБС (59,0% случаев). При высокой распространенности среди пациентов с ХСН стабильной стенокардии (51,3% случаев) нами выявлено наличие очень низкой распространенности перенесенного ОИМ среди них (13,3% случаев), что говорит о низкой эффективности лечения данного осложнения ИБС и сохраняющейся высокой смертности от ОИМ. Эти данные сравнимы с эпидемиологическими исследованиями 1970–80-х годов в Европе и США [16]. Можно утверждать, что современное лечение ОИМ в РФ остается настолько плохим, что требует незамедлительного вмешательства для изменения ситуации. Этот факт определил важность исследования эффективности терапии среди больных АГ и ИБС в репрезентативной выборке РФ для анализа ситуации в популяции в отношении профилактики формирования ХСН.
Так как установлено, что АГ является основным этиологическим фактором для формирования ХСН в популяции РФ, нами из выборки больных АГ была выделена группа пациентов, принимающих любые гипотензивные лекарственные средства, в целях определения эффективности лечения данного заболевания. Она была представлена пациентами, достигшими целевого уровня АД, и исследуемыми, не достигшими искомой величины. Среди пациентов с АГ принимали гипотензивные препараты 66,4% респондентов, а среди них только 56,5% принимали гипотензивные средства постоянно. Эффективность лечения больных АГ составила 13,7% среди всей выборки больных АГ. При этом гендерных различий в эффективности терапии не было выявлено.
Была проанализирована комплаентность этих пациентов к гипотензивной терапии (рис. 1). Оказалось, что чаще всех постоянно принимали гипотензивные препараты пациенты с уровнем АД, соответствующем 3-й степени АГ, и эта величина достигала 66,5%. Реже всего имели постоянную гипотензивную терапию пациенты с уровнем АД, соответствующего АГ 1-й степени – 53,0% (рАГ3/АГ1 = 0,01). Пациенты, имеющие вторую степень АГ, лечились постоянно в 60,3% случаев, что достоверно чаще против больных АГ первой степени (рАГ1/АГ2 = 0,048). Обращает на себя внимание, что среди больных, имеющих на момент осмотра целевой уровень АД, постоянно принимают гипотензивные лекарственные средства только в 59,1% случаев. Таким образом, комплаентность к терапии зависит от степени повышения АД: чем выше АД, тем чаще встречается тактика постоянного приема гипотензивной терапии.
Тактики лечения «при повышении АД» и «курсами» имели обратную зависимость от степени повышения АД. Среди пациентов с АГ 1-й степени 33,3% принимали лекарства при повышении АД и 13,7% – курсами, тогда как респонденты с АГ 3-й степени принимали гипотензивные препараты при повышении АД в 24,1% случаев, а курсами – в 9,5% случаев. В группе пациентов с АГ 2-й степени изучаемые тактики лечения занимали по частоте промежуточное положение и составили 27,4% и 12,3% соответственно. В группе пациентов, достигших целевого уровня АД, данные показатели соответствовали 30,8% и 10,1% случаев, что формирует предположение о более низкой средней степени повышения АД среди эффективно леченых больных АГ (каждый третий принимал лекарственные средства при повышении АД).
Была проанализирована частота контролируемости АД среди эффективно леченых пациентов. Оказалось, что только каждый пятый (22,2%) в этой группе принимал постоянно хотя бы одно пролонгированное гипотензивное средство (3,0% пациентов среди всех больных АГ). При изучении этой величины в зависимости от пола, выяснилось, что среди эффективно леченых мужчин принимали хотя бы одно пролонгированное гипотензивное средство в 22,4% случаев (3,1% от всей выборки мужчин больных АГ), а среди эффективно леченых женщин – 22,1% (3,0% от всей выборки женщин больных АГ) (р = 0,95).
Еще один важный факт: в выборке респондентов, не имеющих сердечно-сосудистых осложнений, распространенность АГ составила 33,6% случаев и среди них только 9,3% респондентов имели целевой уровень АД на фоне терапии. Формируется патологическая закономерность – при отсутствии сердечно-сосудистых осложнений эффективность лечения АГ очень низкая. При наличии осложнений эффективность терапии АГ несколько повышается, но не выполняются требования постоянной (пожизненной) терапии, что становится базисом для формирования ХСН и сердечно-сосудистой смертности. Сочетание двух основных этиологических причин (АГ и ИБС) будут выступать максимально агрессивно в формировании ХСН. Было обнаружено, что среди больных ИБС очень часто присутствовала АГ и имела очень высокую распространенность, которая составила 91,3% случаев. Такой же показатель был выявлен в выборке больных ИМ (93,0% случаев) (р = 0,70) (табл. 1).
Тахикардия является отдельным самостоятельным фактором ухудшения прогноза больных ИБС, что провоцирует также ХСН. Среди пациентов с ИБС, не принимающих хрононегативных лекарственных средств, тахикардия как ФР была диагностирована у 81,4% больных (табл. 1). Среди больных ИМ этот показатель составил 95,2% случаев, что оказалось так же сопоставимым (р = 0,09) с аналогичным показателем среди больных ИБС. Таким образом, наличие АГ или комбинация АГ и ИБС является наиболее агрессивными этиологическими причинами формирования ХСН.
Достижение целевого уровня АД на фоне любой гипотензивной терапии у больных ИБС отмечалось в 13,3% случаев, а среди больных ОИМ – 11,6% случаев (р = 0,77). Вероятнее всего, достижение целевого уровня АД произошло не за счет агрессивного контроля АГ как важного фактора риска, а было ассоциировано с назначением ББ и ИАПФ в рамках базисного лечения ИБС у данной категории пациентов.
Мы проанализировали средние уровни систолического (САД) и диастолического (ДАД) АД среди больных ИБС (табл. 2). Средний уровень САД в группе больных ИБС составил 150,8 ± 22,2 мм рт. ст., тогда как уровень ДАД у них же в среднем составлял 89,9 ± 10,5 мм рт. ст. Средние уровни САД и ДАД у больных ИМ достоверно не отличались от таковых у больных ИБС (р = 0,19 и р = 0,34 соответственно). На популяционном уровне независимо от проводимой гипотензивной терапии оказалось, что среди больных ИБС уровень САД выше в среднем на 20 мм рт. ст., а уровень ДАД – на 10 мм рт. ст. по сравнению с выборкой респондентов без ИБС. Наличие, особенно, повышенного САД приводит к большему риску формирования системного атеросклероза и сердечно-сосудистых осложнений, что было показано во многих международных исследованиях [4]. Медикаментозное урежение ЧСС у больных ИБС является одной из основных задач лечения. Данные представлены на рисунке 2.
В репрезентативной выборке исследуемых без ИБС брадикардия была диагностирована в 5,5% случаев. Почти все респонденты без ИБС (81,8%) имели нормальную ЧСС от 61 до 80 уд/мин. Тахикардия у респондентов без ИБС была диагностирована в 12,7% случаев. Наоборот, у больных ИБС распространенность тахикардии (более 70 уд/мин) составила 81,4% случаев, что оказалось достоверно (р < 0,001) чаще по сравнению с группой без ИБС. Оптимальная ЧСС у больных ИБС (50–70 уд/мин) отмечалась всего лишь в 18,6% случаев (до 60 уд/мин – 5,1% случаев и 60–70 уд/мин 13,5% случаев), что достоверно реже, чем среди респондентов без ИБС (р < 0,001).
Наиболее неблагоприятная ситуация сложилась среди больных ИМ, не получающих терапию ББ. Эффективный контроль ЧСС отмечался всего лишь в 4,8% случаев. Все остальные варианты ЧСС для больных ИМ являются отдельным фактором риска ухудшения прогноза: ЧСС в диапазоне от 61 до 70 уд/мин была зарегистрирована у 19,0% респондентов, а тахикардия свыше 70 уд/мин – у 76,2% респондентов. При сопоставлении частоты встречаемости тахикардии у больных ИБС и ИМ достоверных различий не было выявлено (р = 0,09). Различия между средней ЧСС группы больных ИБС (78,4 ± 9,0 уд/мин) и средней ЧСС группы респондентов без ИБС (73,3 ± 7,4 уд/мин) оказались статистически значимыми (р < 0,001). Средняя ЧСС в группе больных ИБС и в группе больных ИМ (77,4 ± 10,4 уд/мин) достоверно не различались (р = 0,36).
Полученные данные свидетельствуют о том, что тахикардия имеет достоверно большую распространенность среди больных ИБС по сравнению с респондентами в выборке, а значит, предопределяет значительно худший прогноз респондентов с ИБС и может повлиять на формирование ХСН. Среди больных ИБС прием ББ был отмечен нами у 44,1% респондентов (в 73,6% случаев – ежедневный длительный прием лекарственных средств, в 26,4% случаев – курсами). Мы выявили, что в группе больных стенокардией ритм реже 70 уд/мин отмечался лишь у трети респондентов (29,6% случаев). Среди больных с ИМ в анамнезе, получавших терапию ББ, брадикардия ниже 60 уд/мин не достигалась ни в одном случае, а доля респондентов с ЧСС от 61 до 70 уд/мин составила сравнимую величину в выборке больных ИБС 27,3% случаев. Таким образом, почти 2/3 больных ИБС несмотря на прием ББ не достигают оптимальных значений ЧСС. Сопоставив частотные распределения больных ИБС, не принимающих ББ, и указанные выше показатели достижения оптимальных значений ЧСС на фоне лекарственной терапии, мы вынуждены констатировать, что назначение ББ не оказывает влияния на прогноз больных ИБС на популяционном уровне.
Учитывая данные Khot U.N. (2003), мы могли ожидать, что распространенность АГ среди больных ИБС не превышала бы 50–60%. Однако в действительности было выявлено, что практически каждый больной ИБС имеет искомый фактор риска. Отсутствие эффективного контроля АД на популяционном уровне для больных ИБС является мощным ФР формирования ХСН. Высокая частота встречаемости тахикардии (81,4% случаев) среди больных ИБС в условиях отсутствия приема ББ или других хрононегативных средств сама по себе предопределяет неблагоприятный прогноз данной категории респондентов. Вероятнее всего, сложившаяся ситуация обусловлена недостаточной обеспеченностью пациентов с ИБС квалифицированной врачебной помощью. На наш взгляд, мероприятия, направленные на коррекцию одного этого ФР значительно улучшили бы эпидемиологическую ситуацию в отношении изучаемого заболевания.
Учитывая мощный патогенетический потенциал гемодинамических ФР для больных ХСН, мы вынуждены признать, что подавляющая часть респондентов полученной нами выборки находится в зоне высокого риска развития неблагоприятного исхода. В то же время положительным моментом является то, что изученные ФР входят в категорию изменяемых (модифицируемых). Нам представляется, что агрессивная политика по воздействию на ФР с целью устранения, как со стороны самих пациентов, так и со стороны врачей, способна не только значительно улучшить прогноз жизни, но и значительно замедлить формирование ХСН.
Заключение
Основными этиологическими причинами формирования ХСН в РФ являются АГ и ИБС. Комбинация двух этиологических причин наблюдается в 57,2% случаев среди больных ХСН. Отсутствие эффективного контроля АД на популяционном уровне будет оставаться важным триггером формирования ХСН и сердечно-сосудистых осложнений. Неэффективный контроль частоты сердечных сокращений приводит к высокому риску формирования осложненной ИБС, что сопровождается в дальнейшем более быстрой декомпенсацией кровообращения.
По данным Framingham Heart Study [12] в 1971 году и New Zealand HF Study [13] в 1988 году, АГ оказалась основной этиологической причиной ХСН более чем у 70% и 60% больных соответственно. Через 20 лет в Framingham Heart Study в когорте пациентов с ХСН ИБС становится основной этиологической причиной среди 59% мужчин и 48% женщин. Но комбинация ИБС и АГ или присутствие одного из вышеназванных заболеваний встречалась в 90% случаев у больных ХСН. Изменение весомости этиологических причин формирования ХСН в Framingham Heart Study позволяет говорить о более эффективном лечении АГ в США, происшедшем за последние двадцать лет, и увеличении продолжительности жизни больных ИБС [14]. Этот факт подтверждает эпидемиологическое наблюдение NHANES I, II и III, проведенное в США в течение тридцати лет, которое указывает, что в настоящее время АГ уступила ИБС как основной этиологической причине развития ХСН [15, 16].
Высокая эффективность лечения АГ и ИБС приводит к минимизации риска развития ХСН при АГ и увеличения риска от ИБС: так называемый перекрест весомости этиологических причин формирования ХСН за счет повышения эффективности терапии. Оставаясь самым агрессивным этиологическим фактором, ИБС становится главенствующей причиной развития ХСН у пациентов. Было решено провести анализ весомости АГ и ИБС как двух основных этиологических причин (ИБС и АГ) в формировании ХСН и определить эффективность их лечения в репрезентативной выборке Европейской части РФ по данным исследования ЭПОХА 2007.
Материалы и методы
В 2007 году было проведено ЭПидемиологическое Обследование больныХ в Европейской чАсти России (ЭПОХА) (второй этап), позволившее выявить распространенность основных сердечно-сосудистых заболеваний в Европейской части РФ. Исследование охватило девять субъектов Европейской части России: Кировская, Нижегородская, Оренбургская, Рязанская и Саратовская области, Республики Татарстан и Чувашия, Пермский и Ставропольский края. В 2002 г. в исследовании приняли участие 286 врачей амбулаторно-поликлинического звена, которые обследовали 6780 семей. В исследование было включено 14548 респондентов. Данные, полученные в исследовании, можно экстраполировать на Европейскую часть РФ. Включение в репрезентативную выборку начиналось с возраста 10 лет.
Дизайн рандомизации представлен в журнале «Сердечная недостаточность» [17]. Для анализа выборки больных ХСН были определены мягкие и жесткие критерии постановки диагноза. К мягким критериям относились: наличие сердечно-сосудистого заболевания (ССЗ) (АГ, ИБС, перенесенные острый инфаркт миокарда (ОИМ), острое нарушение мозгового кровообращения (ОНМК), перемежающая хромота, пороки сердца) и более тяжелой степени одышка при обычной ходьбе. В сформированную группу респондентов включались пациенты с предположительным диагнозом ХСН I–IV функционального класса (ФК).
Для подтверждения диагноза ХСН был проведен госпитальный этап исследования. В ходе этого исследования респонденты, имеющие мягкие критерии ХСН, были госпитализированы в ЛПУ. Для верификации ФК ХСН у госпитализированных респондентов врачи стационаров кроме клинического осмотра проводили функциональное и инструментальное дообследование (ЭКГ, рентгенография грудной клетки, УЗИ сердца, тест 6-минутной ходьбы, вопросники клинического состояния). При наличии симптомов ХСН и хотя бы одного положительного инструментального исследования, и положительного теста 6-минутной ходьбы диагноз ХСН считался подтвержденным.
На догоспитальном этапе карты-вопросники, заполняемые исследователями, включали в себя не только паспортные данные, анамнез, но и клиническое состояние на момент осмотра, данные измерения артериального давления (АД) в положении сидя на обеих руках, указывалась принимаемая терапия с уточнением доз препаратов. АГ диагностировалась в том случае, если при измерении на обеих руках уровень среднего АД был 140/90 мм рт.ст. и выше. Степень АГ определялась по уровню АД в соответствии с классификацией ВНОК 2010 [18]. Диагноз ИБС выставлялся с использованием вопросника ROSE [19] и анализа имеющихся на руках выписных документов и клинического осмотра (анализ в статье представлен по данным репрезентативной выборки Нижегородской области).
Анализ принимаемой лекарственной терапии у больных АГ и ИБС проводился с помощью опроса, при этом врачи-исследователи не имели права влиять на ответы респондентов, и в картах-вопросниках указывались только те лекарственные средства, которые указывал пациент и подтверждал факт приема препаратов для лечения ССЗ. В карту заносились торговые названия лекарственных средств, доза и кратность их приема. Весь ряд лекарственных средств был разделен на рекомендованные ВНОК, и нерекомендованные препараты (прочие). Среди больных АГ эффективно леченными считались пациенты, принимающие любое гипотензивное лекарственное средство и имеющие уровень АД ниже 140/90 мм рт. ст. Контролируемым АД у пациентов с АГ считалось в том случае, если исследуемый при обследовании имел АД ниже 140/90 и принимал постоянно хотя бы одно пролонгированное гипотензивное средство в средней суточной дозе.
Для определения эффективности контроля АД у больных ИБС мы всех пациентов с ИБС разделили на четыре подгруппы: первая – применение препаратов базисной терапии ИБС в моно- или в комбинации: бета-блокаторы (ББ) и ингибиторы ангиотензин-превращающего фермента (ИАПФ); вторая – усиление базисной терапии рекомендованными ВНОК препаратами для лечения АГ (антагонисты кальция и/или диуретики); третья – применение базисной моно- или комбинированной терапии ИБС и прочих гипотензивных лекарственных средств; четвертая – применение только нерекомендованных ВНОК гипотензивных лекарственных средств.
Эффективность контроля частоты сердечных сокращений (ЧСС) определялась для больных ИБС. Эффективный контроль ЧСС считался для больных ИБС ниже 70 уд/мин. Для пациентов, перенесших ИМ, тахикардия как фактор риска (ФР) расценивалась при ЧСС выше 60 уд/мин. Комплаентность к терапии оценивалась по тактике приема гипотензивных препаратов, а именно: постоянно, курсами или при повышении АД. Медицинская статистическая обработка проводилась c помощью программного продукта OPENOFFICE на кафедре внутренних болезней и сестринского дела ГОУ ВПО НижГМА Росздрава.
Результаты и обсуждение
Основными этиологическими причинами развития ХСН в РФ являются АГ (88,0% случаев) и ИБС (59,0% случаев). При высокой распространенности среди пациентов с ХСН стабильной стенокардии (51,3% случаев) нами выявлено наличие очень низкой распространенности перенесенного ОИМ среди них (13,3% случаев), что говорит о низкой эффективности лечения данного осложнения ИБС и сохраняющейся высокой смертности от ОИМ. Эти данные сравнимы с эпидемиологическими исследованиями 1970–80-х годов в Европе и США [16]. Можно утверждать, что современное лечение ОИМ в РФ остается настолько плохим, что требует незамедлительного вмешательства для изменения ситуации. Этот факт определил важность исследования эффективности терапии среди больных АГ и ИБС в репрезентативной выборке РФ для анализа ситуации в популяции в отношении профилактики формирования ХСН.
Так как установлено, что АГ является основным этиологическим фактором для формирования ХСН в популяции РФ, нами из выборки больных АГ была выделена группа пациентов, принимающих любые гипотензивные лекарственные средства, в целях определения эффективности лечения данного заболевания. Она была представлена пациентами, достигшими целевого уровня АД, и исследуемыми, не достигшими искомой величины. Среди пациентов с АГ принимали гипотензивные препараты 66,4% респондентов, а среди них только 56,5% принимали гипотензивные средства постоянно. Эффективность лечения больных АГ составила 13,7% среди всей выборки больных АГ. При этом гендерных различий в эффективности терапии не было выявлено.
Была проанализирована комплаентность этих пациентов к гипотензивной терапии (рис. 1). Оказалось, что чаще всех постоянно принимали гипотензивные препараты пациенты с уровнем АД, соответствующем 3-й степени АГ, и эта величина достигала 66,5%. Реже всего имели постоянную гипотензивную терапию пациенты с уровнем АД, соответствующего АГ 1-й степени – 53,0% (рАГ3/АГ1 = 0,01). Пациенты, имеющие вторую степень АГ, лечились постоянно в 60,3% случаев, что достоверно чаще против больных АГ первой степени (рАГ1/АГ2 = 0,048). Обращает на себя внимание, что среди больных, имеющих на момент осмотра целевой уровень АД, постоянно принимают гипотензивные лекарственные средства только в 59,1% случаев. Таким образом, комплаентность к терапии зависит от степени повышения АД: чем выше АД, тем чаще встречается тактика постоянного приема гипотензивной терапии.
Тактики лечения «при повышении АД» и «курсами» имели обратную зависимость от степени повышения АД. Среди пациентов с АГ 1-й степени 33,3% принимали лекарства при повышении АД и 13,7% – курсами, тогда как респонденты с АГ 3-й степени принимали гипотензивные препараты при повышении АД в 24,1% случаев, а курсами – в 9,5% случаев. В группе пациентов с АГ 2-й степени изучаемые тактики лечения занимали по частоте промежуточное положение и составили 27,4% и 12,3% соответственно. В группе пациентов, достигших целевого уровня АД, данные показатели соответствовали 30,8% и 10,1% случаев, что формирует предположение о более низкой средней степени повышения АД среди эффективно леченых больных АГ (каждый третий принимал лекарственные средства при повышении АД).
Была проанализирована частота контролируемости АД среди эффективно леченых пациентов. Оказалось, что только каждый пятый (22,2%) в этой группе принимал постоянно хотя бы одно пролонгированное гипотензивное средство (3,0% пациентов среди всех больных АГ). При изучении этой величины в зависимости от пола, выяснилось, что среди эффективно леченых мужчин принимали хотя бы одно пролонгированное гипотензивное средство в 22,4% случаев (3,1% от всей выборки мужчин больных АГ), а среди эффективно леченых женщин – 22,1% (3,0% от всей выборки женщин больных АГ) (р = 0,95).
Еще один важный факт: в выборке респондентов, не имеющих сердечно-сосудистых осложнений, распространенность АГ составила 33,6% случаев и среди них только 9,3% респондентов имели целевой уровень АД на фоне терапии. Формируется патологическая закономерность – при отсутствии сердечно-сосудистых осложнений эффективность лечения АГ очень низкая. При наличии осложнений эффективность терапии АГ несколько повышается, но не выполняются требования постоянной (пожизненной) терапии, что становится базисом для формирования ХСН и сердечно-сосудистой смертности. Сочетание двух основных этиологических причин (АГ и ИБС) будут выступать максимально агрессивно в формировании ХСН. Было обнаружено, что среди больных ИБС очень часто присутствовала АГ и имела очень высокую распространенность, которая составила 91,3% случаев. Такой же показатель был выявлен в выборке больных ИМ (93,0% случаев) (р = 0,70) (табл. 1).
Тахикардия является отдельным самостоятельным фактором ухудшения прогноза больных ИБС, что провоцирует также ХСН. Среди пациентов с ИБС, не принимающих хрононегативных лекарственных средств, тахикардия как ФР была диагностирована у 81,4% больных (табл. 1). Среди больных ИМ этот показатель составил 95,2% случаев, что оказалось так же сопоставимым (р = 0,09) с аналогичным показателем среди больных ИБС. Таким образом, наличие АГ или комбинация АГ и ИБС является наиболее агрессивными этиологическими причинами формирования ХСН.
Достижение целевого уровня АД на фоне любой гипотензивной терапии у больных ИБС отмечалось в 13,3% случаев, а среди больных ОИМ – 11,6% случаев (р = 0,77). Вероятнее всего, достижение целевого уровня АД произошло не за счет агрессивного контроля АГ как важного фактора риска, а было ассоциировано с назначением ББ и ИАПФ в рамках базисного лечения ИБС у данной категории пациентов.
Мы проанализировали средние уровни систолического (САД) и диастолического (ДАД) АД среди больных ИБС (табл. 2). Средний уровень САД в группе больных ИБС составил 150,8 ± 22,2 мм рт. ст., тогда как уровень ДАД у них же в среднем составлял 89,9 ± 10,5 мм рт. ст. Средние уровни САД и ДАД у больных ИМ достоверно не отличались от таковых у больных ИБС (р = 0,19 и р = 0,34 соответственно). На популяционном уровне независимо от проводимой гипотензивной терапии оказалось, что среди больных ИБС уровень САД выше в среднем на 20 мм рт. ст., а уровень ДАД – на 10 мм рт. ст. по сравнению с выборкой респондентов без ИБС. Наличие, особенно, повышенного САД приводит к большему риску формирования системного атеросклероза и сердечно-сосудистых осложнений, что было показано во многих международных исследованиях [4]. Медикаментозное урежение ЧСС у больных ИБС является одной из основных задач лечения. Данные представлены на рисунке 2.
В репрезентативной выборке исследуемых без ИБС брадикардия была диагностирована в 5,5% случаев. Почти все респонденты без ИБС (81,8%) имели нормальную ЧСС от 61 до 80 уд/мин. Тахикардия у респондентов без ИБС была диагностирована в 12,7% случаев. Наоборот, у больных ИБС распространенность тахикардии (более 70 уд/мин) составила 81,4% случаев, что оказалось достоверно (р < 0,001) чаще по сравнению с группой без ИБС. Оптимальная ЧСС у больных ИБС (50–70 уд/мин) отмечалась всего лишь в 18,6% случаев (до 60 уд/мин – 5,1% случаев и 60–70 уд/мин 13,5% случаев), что достоверно реже, чем среди респондентов без ИБС (р < 0,001).
Наиболее неблагоприятная ситуация сложилась среди больных ИМ, не получающих терапию ББ. Эффективный контроль ЧСС отмечался всего лишь в 4,8% случаев. Все остальные варианты ЧСС для больных ИМ являются отдельным фактором риска ухудшения прогноза: ЧСС в диапазоне от 61 до 70 уд/мин была зарегистрирована у 19,0% респондентов, а тахикардия свыше 70 уд/мин – у 76,2% респондентов. При сопоставлении частоты встречаемости тахикардии у больных ИБС и ИМ достоверных различий не было выявлено (р = 0,09). Различия между средней ЧСС группы больных ИБС (78,4 ± 9,0 уд/мин) и средней ЧСС группы респондентов без ИБС (73,3 ± 7,4 уд/мин) оказались статистически значимыми (р < 0,001). Средняя ЧСС в группе больных ИБС и в группе больных ИМ (77,4 ± 10,4 уд/мин) достоверно не различались (р = 0,36).
Полученные данные свидетельствуют о том, что тахикардия имеет достоверно большую распространенность среди больных ИБС по сравнению с респондентами в выборке, а значит, предопределяет значительно худший прогноз респондентов с ИБС и может повлиять на формирование ХСН. Среди больных ИБС прием ББ был отмечен нами у 44,1% респондентов (в 73,6% случаев – ежедневный длительный прием лекарственных средств, в 26,4% случаев – курсами). Мы выявили, что в группе больных стенокардией ритм реже 70 уд/мин отмечался лишь у трети респондентов (29,6% случаев). Среди больных с ИМ в анамнезе, получавших терапию ББ, брадикардия ниже 60 уд/мин не достигалась ни в одном случае, а доля респондентов с ЧСС от 61 до 70 уд/мин составила сравнимую величину в выборке больных ИБС 27,3% случаев. Таким образом, почти 2/3 больных ИБС несмотря на прием ББ не достигают оптимальных значений ЧСС. Сопоставив частотные распределения больных ИБС, не принимающих ББ, и указанные выше показатели достижения оптимальных значений ЧСС на фоне лекарственной терапии, мы вынуждены констатировать, что назначение ББ не оказывает влияния на прогноз больных ИБС на популяционном уровне.
Учитывая данные Khot U.N. (2003), мы могли ожидать, что распространенность АГ среди больных ИБС не превышала бы 50–60%. Однако в действительности было выявлено, что практически каждый больной ИБС имеет искомый фактор риска. Отсутствие эффективного контроля АД на популяционном уровне для больных ИБС является мощным ФР формирования ХСН. Высокая частота встречаемости тахикардии (81,4% случаев) среди больных ИБС в условиях отсутствия приема ББ или других хрононегативных средств сама по себе предопределяет неблагоприятный прогноз данной категории респондентов. Вероятнее всего, сложившаяся ситуация обусловлена недостаточной обеспеченностью пациентов с ИБС квалифицированной врачебной помощью. На наш взгляд, мероприятия, направленные на коррекцию одного этого ФР значительно улучшили бы эпидемиологическую ситуацию в отношении изучаемого заболевания.
Учитывая мощный патогенетический потенциал гемодинамических ФР для больных ХСН, мы вынуждены признать, что подавляющая часть респондентов полученной нами выборки находится в зоне высокого риска развития неблагоприятного исхода. В то же время положительным моментом является то, что изученные ФР входят в категорию изменяемых (модифицируемых). Нам представляется, что агрессивная политика по воздействию на ФР с целью устранения, как со стороны самих пациентов, так и со стороны врачей, способна не только значительно улучшить прогноз жизни, но и значительно замедлить формирование ХСН.
Заключение
Основными этиологическими причинами формирования ХСН в РФ являются АГ и ИБС. Комбинация двух этиологических причин наблюдается в 57,2% случаев среди больных ХСН. Отсутствие эффективного контроля АД на популяционном уровне будет оставаться важным триггером формирования ХСН и сердечно-сосудистых осложнений. Неэффективный контроль частоты сердечных сокращений приводит к высокому риску формирования осложненной ИБС, что сопровождается в дальнейшем более быстрой декомпенсацией кровообращения.
1. Ho K.K., Anderson K.M., Kannel W.B., Grossman W., Levy D. Survival after the onset of congestive heart failure in Framingham Heart Study subjects. Circulation. 1993; 88: 107–15.
2. Kannel W.B. Epidemiology and prevention of cardiac failure: Framingham Study insights. Eur Heart J 1987; 8 (Suppl F): 23–6.
3. Katz A.M. Cardiomyopathy of overload. A major determinant of prognosis in congestive heart. N Engl J Med. 1990; 322: 100–10.
4. Killip T. Epidemiology of congestive heart failure. Am J Cardiol. 1985; 56: 2A–6A.
5. Manolio Т.А., Baughman K.L., Rodeheffer R. et al. Prevalence and etiology of idiopathic dilated cardiomyopathy (summary of a National Heart, Lung, and Blood Institute workshop). Am J Cardiol. 1992; 69: 1458–66.
6. Kannel W.B., Plehn J.F., Cupples L.A. Cardiac failure and sudden death in the Framingham Study. Am Heart J. 1988; 115: 869–75.
7. Teerlink J.R., Goldhaber S.Z., Pfeffer M.A. An overview of contemporary etiologies of congestive heart failure. Am Heart J 1991; 121: 1852–3.
8. Harlan W.R., Obermann A., Grimm R., Rosati R.A. Chronic congestive heart failure in coronary artery disease: clinical criteria. Ann Intern Med. 1977; 86: 133–8.
9. Mosterd A., Hoes A.W., Bruijne de M.C. et al. Prevalence of heart failure and left ventricular dysfunction in the general population. The Rotterdam Study. Eur Heart J. 1999; 20: 447–55.
10. Cleland JGF, Swedberg K., Follath F. et al. The IMPROVEMENT of heart failure survey. International variations in the aetiology of heart failure managed in primary care. Eur J Heart Fait. 2001; 3: S72. [Abstract].
11. McMurray J.J., Stewart S. Epidemiology, aetiology, and prognosis of heart failure. Heart. 2000; 83: 596–602.
12. McKee P.A., Castelli W.P., McNamara P.M., Kannel W.B. The natural history of congestive heart failure: the Framingham Study. N Engl J Med. 1971; 285: 1441–6.
13. Sharpe N., Doughty R. Epidemiology of heart failure and ventricular dysfunction. Lancet. 1998; 352 (Suppl 1): 3–8.
14. Kannel W.B., Ho K., Thorn T. Changing epidemiological feattres of cardiac failure. Br Heart J. 1994; 72: 3–9.
15. Kannel W.B., Castelli W.P., McNamara P.M., McKee P.A., Feinleib M. Role of blood pressure in the development of congestive heart failure. The Framingham Study. N Engl J Med. 1972; 287: 781–7.
16. Yusuf S., Thom T., Abbott R.D. Changes in hypertension treatment and in congestive heart failure mortality in the United States. Hypertension 1989; 13: I74–9.
17. Мареев В.Ю., Беленков Ю.Н., Агеев Ф.Т., Фомин И.В. и др. Первые результаты Российского эпидемиологического исследования по ХСН (ЭПОХА-ХСН). Сердечная недостаточность. 2003; №1, Т. 4: 17–18.
18. РМОАГ, ВНОК. Диагностика и лечение артериальной гипертензии. Российские рекомендации (четвертый пересмотр). Системные гипертензии. 2010; 3: 5–26.
19. Rose G., McCartney P., Reid D. D.: Self–administration of a questionnaire on chest pain and intermittent claudication. Br J Prev Soc Med. 1977; 31: 42–48.
Новости на тему
13.02.2025
14.05.2024
Отправить статью по электронной почте
Ваш адрес электронной почты:
Ишемическая болезнь сердца (ИБС), артериальная гипертония (АГ) и сахарный диабет (СД) являются основными причинами формирования хронической сердечной недостаточности (ХСН) в современной медицине [1, 2].
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
