Эрбитукс – инструмент повышения эффективности комплексного лечения плоскоклеточного рака головы и шеи
- Аннотация
- Статья
- Ссылки
- English
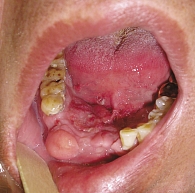
Лечение плоскоклеточного рака головы и шеи (ПРГШ) представляется достаточно сложной задачей. Несмотря на то что опухоли данной локализации часто легко выявляются при обычном осмотре полости рта (рис. 1), основной проблемой остается обращение пациентов к врачу в запущенных стадиях. Так, по данным статистики, с 1997 по 2007 г. опухоли полости рта и глотки в III–IV стадии заболевания составляли почти 70% от всех выявленных опухолей этой локализации, при этом летальность на 1-м году после выявления этого заболевания в 2007 г. составила 39,1% [1]. У этой категории больных, по современным стандартам, лечение должно проводиться в виде комплекса мероприятий с применением не только хирургической операции и лучевой терапии, но и химиотерапии. Для успешного решения данной задачи необходима слаженная работа команды, состоящей из хирурга, радиолога и химиотерапевта [2].
Химиотерапия у больных ПРГШ долгое время применялась с паллиативной целью при неоперабельных распространенных опухолевых процессах, чаще рецидивного характера, с наличием отдаленных метастазов. Но в 1982 г. выступление D. Decker на ежегодном конгрессе ASCO (American Society of Clinical Oncology – Американское общество клинической онкологии) положило начало использованию химиотерапии как равноправного компонента комплексного лечебного воздействия вместе с хирургическим и лучевым методами лечения [3].
На сегодняшний день особенно актуальными являются две проблемы применения химиотерапии при ПРГШ. Первая – как повысить эффективность химиолучевого лечения пациентов с местнораспространенным ПРГШ без увеличения токсичности. К сожалению, успехи, достигнутые химиолучевым лечением, оборачиваются большим количеством серьезных побочных эффектов как в период лечения, так и после него, сильно осложняя жизнь вылеченным больным. Так, по данным J.S. Cooper [4], применение послеоперационного конкурентного химиолучевого лечения позволило повысить локорегионарный контроль на 10% по сравнению с группой самостоятельного послеоперационного лучевого лечения, но при этом острая токсичность выросла более чем в два раза. Вторая проблема связана с химиотерапией больных с рецидивным ПРГШ: все применяемые современные схемы полихимиотерапии, обеспечивая объективные ответы на уровне 30–40%, не увеличивают продолжительность жизни пациентов, в сравнении с использованием в монорежимах давно известных препаратов [5, 6].
Появление таргетных препаратов открыло новый этап эволюции применения химиотерапии и лучевой терапии у пациентов с ПРГШ. Почти в 100% случаев рецептор эпидермального фактора роста (РЭФР) экспрессируется ПРГШ, и повышение его экспрессии обычно ассоциируется со снижением безрецидивной и общей продолжительности жизни [7]. Таким образом, РЭФР стал мишенью при лечении плоскоклеточного рака головы и шеи.
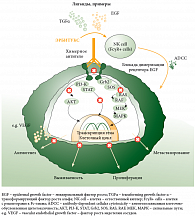
Цетуксимаб (препарат Эрбитукс, компания «Мерк Сероно», Германия) представляет собой моноклональное антитело IgG1, которое обладает высоким сродством к РЭФР и, взаимодействуя с экстрацеллюлярным доменом РЭФР, блокирует лиганд-индуцированный процесс фосфорилирования РЭФР. Прекращается подача сигнала к ядру клетки, и, соответственно, происходит подавление пролиферации клетки, ангиогенеза, опухолевой инвазии, метастазирования с одновременной стимуляцией апоптоза и повышением чувствительности клетки к лучевой терапии и химиотерапии (рис. 2) [8, 9].
Цетуксимаб в лечении местнораспространенного плоскоклеточного рака головы и шеи
Команда специалистов, принимающих решение о лечении пациента с местнораспространенным ПРГШ, в большинстве случаев планирует полное его излечение. Могут использоваться следующие варианты применения химиотерапии в комбинации с лучевой терапией. Во-первых – индукционная химиотерапия, при которой проводится 2–3 курса полихимиотерапии с последующей лучевой терапией. Индукционная химиотерапия может отобрать опухоли, чувствительные к лучевой терапии, позволяя произвести хирургическое вмешательство на ранних этапах лечения в случае неудовлетворительной регрессии, не компрометирует последующую операцию или отдаленный локорегионарный контроль, снижает отдаленное метастазирование и дает возможность сохранения органов, но не может улучшить выживаемость. Вторым вариантом является конкурентная химиолучевая терапия (ХЛТ), когда химиотерапия проводится одновременно с лучевой терапией. Конкурентная химиолучевая терапия дает увеличение продолжительности жизни и улучшение локорегионарного контроля [10]. Конкурентное назначение лучевой терапии и химиотерапии, обычно включающее химиотерапию на основе платиносодержащих препаратов, в настоящее время является стандартным нехирургическим подходом к лечению местнораспространенного ПРГШ. Однако данный вид ХЛТ ассоциирован с сильно выраженной острой токсичностью, включающей связанные с лучевой терапией побочные эффекты, такие как мукозиты [11, 12].
Применение комбинации цетуксимаба в сочетании с лучевой терапией (ЛТ) продемонстрировало значительную эффективность по сравнению с использованием лучевой терапии в самостоятельном варианте у больных с местнораспространенным ПРГШ, что было доказано результатами многоцентрового, рандомизированного исследования III фазы более чем у 400 пациентов с местнораспространенным ПРГШ [13]. В исследование включались пациенты с плоскоклеточным раком ротоглотки, гортаноглотки или гортани в стадии III и IV, без отдаленных метастазов, не получавшие ранее химиотерапию, лучевую терапию и не подвергавшиеся хирургическим вмешательствам по поводу рака головы и шеи. Пациенты рандомизировались в группы с целью проведения ЛТ в самостоятельном варианте или ЛТ в комбинации с цетуксимабом (начальная доза 400 мг/м2, с последующими еженедельными введениями по 250 мг/м2) с начальной дозой препарата, вводимой за 1 неделю до начала ЛТ. Из 208 пациентов, рандомизированных в группу с применением цетуксимаба, 90% получили запланированное лечение в полном объеме [13].
Добавление цетуксимаба к ЛТ привело к значительному увеличению 5-летней продолжительности жизни по сравнению с группой лучевой терапии (45,6% против 36,4%, p = 0,018). В группе цетуксимаба с ЛТ отмечено снижение на 32% риска локорегионарного прогрессирования по сравнению с группой ЛТ. Комбинация цетуксимаба и ЛТ также показала улучшение медианы выживаемости на 20 месяцев по сравнению с группой ЛТ в самостоятельном варианте. Медиана выживаемости в группе комбинации цетуксимаба и ЛТ составила 49 месяцев по сравнению с 29,3 месяца у пациентов, получивших ЛТ в самостоятельном варианте. В группе цетуксимаба и ЛТ отмечено снижение риска смерти на 26% по сравнению с группой ЛТ. Также выявлено, что в группе цетуксимаба и ЛТ риск прогрессирования заболевания ниже на 30% по сравнению с группой ЛТ. В ходе исследования установлено, что развитие у пациентов выраженной кожной сыпи было связано с улучшением выживаемости больных и со снижением риска смерти до 51% [13].
Это исследование впервые показало, что таргетная терапия может улучшать исходы лечения при ПРГШ в комбинации с ЛТ, и продемонстрировало значительные клинические преимущества такого лечения. Самым заметным результатом, который достигнут в этом исследовании, было то, что комбинация цетуксимаба и лучевой терапии отличалась значительной эффективностью без усиления побочных эффектов, традиционно связанных с применением лучевой терапии, таких как мукозиты, ксеростомия и дисфагия.
Учитывая высокую эффективность традиционного конкурентного химиолучевого лечения, казалось, что простое сложение цисплатина и цетуксимаба в конкурентном режиме приведет к высокой эффективности данной схемы. Результаты такого сложения были продемонстрированы в исследовании RTOG 0522. В это исследование было включено 720 больных ПРГШ III и IV стадий с локализацией опухолевого процесса в гортани, гортаноглотке и ротоглотке. Одной группе пациентов проводилось стандартное конкурентное химиолучевое лечение с трехкратным введением цисплатина, а второй – с введением цисплатина и еженедельным введением цетуксимаба. Были получены следующие результаты: добавление цетуксимаба к конкурентному режиму ХЛТ (цисплатин + ЛТ) не улучшает выживаемость пациентов, но сопровождается повышением количества дерматитов и мукозитов [14].
В последние годы особый интерес исследователей, занимающихся проблемами лечения рака головы и шеи, привлекает использование последовательной (англ. sequential) химиолучевой терапии. Она заключается в проведении индукционной полихимиотерапии, в основном с использованием комбинации доцетаксела, цисплатина и 5-фторурацила, с последующей конкурентной химиолучевой терапией. Результаты, полученные в 3 фазах исследований, привели к тому, что схемы последовательного химиолучевого лечения стали активно применяться для лечения местнораспространенного ПРГШ как в Европе, так и в США [15, 16]. Естественно, особое внимание приковано к вопросу применения цетуксимаба в схемах последовательного химиолучевого лечения. Одним из исследований, изучавших этот вопрос, было исследование TREMPLIN. В это исследование было включено 153 больных раком гортани и гортаноглотки, которым на первом этапе проводилось три курса индукционной полихимиотерапии по схеме DCF (доцетаксел + цисплатин + 5-фторурацил), после этого оценивался эффект. В случае выявления частичной или полной регрессии опухоли больные рандомизировались в две группы конкурентного химиолучевого лечения: в одной применялся цисплатин, во второй – цетуксимаб. Были получены чрезвычайно интересные результаты: обе группы оказались идентичными как по локорегионарному контролю, так и по общей выживаемости [17].
Таким образом, результаты завершенных на сегодняшний день клинических исследований [13, 14, 17] позволяют с уверенностью утверждать, что конкурентный режим лечения (цетуксимаб + лучевая терапия) стал стандартом лечения больных с местнораспространенным ПРГШ, а также может включаться в схемы последовательного химиолучевого лечения. При этом данный вид терапии не обладает таким широким спектром побочных эффектов, как стандартная конкурентная ХЛТ.
Рецидивный и/или метастатический плоскоклеточный рак головы и шеи
Пациентам с рецидивами ПРГШ, которым не показано хирургическое лечение, обычно предлагается химиотерапия как лечение первой линии. Есть много препаратов, показавших свою активность в режимах монохимиотерапии, с уровнем объективного ответа около 15% (цисплатин, карбоплатин, метотрексат, 5-фторурацил, блеомицин и таксаны) [18]. До настоящего времени комбинация цисплатина с 5-фторурацилом или таксанами была наиболее часто применяемым режимом и обеспечивала уровень объективных ответов от 30 до 40%. Однако медиана выживаемости, в общем, не улучшалась по сравнению с применением монотерапевтических режимов и оставалась на уровне от 6 до 9 месяцев [5, 6, 18].
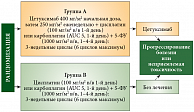
Было проведено несколько крупных рандомизированных международных клинических исследований по оценке эффективности включения цетуксимаба в схемы лечения больных с рецидивным и/или метастатическим плоскоклеточным раком головы и шеи. Основные достижения добавления цетуксимаба к полихимиотерапии с использованием цисплатина и 5-фторурацила были продемонстрированы в недавно завершенном Европейском исследовании III фазы EXTREME (Erbitux in First-Line Treatment of Recurrent or Metastatic Head and Neck Cancer) (рис. 3). Всего в исследование было включено 442 пациента для проведения полихимиотерапии с использованием цисплатина или карбоплатина и 5-фторурацила с добавлением цетуксимаба или без него [19, 20]. Исследование дало самый главный ответ: медиана выживаемости была значительно выше у пациентов, леченных с применением цетуксимаба и полихимиотерапии, по сравнению с группой, где применялась только полихимиотерапия (10,1 против 7,4 месяца; p = 0,036). Добавление цетуксимаба к стандартной схеме полихимиотерапии дало увеличение медианы выживаемости больных без прогрессирования болезни почти в два раза (5,6 против 3,3 месяца). Анализ безопасности показал, что добавление цетуксимаба не увеличило количество характерных побочных эффектов, свойственных стандартной полихимиотерапии (цисплатин + 5-фторурацил) [19, 20].
Таким образом, на сегодняшний день схема, включающая в себя цетуксимаб, цисплатин и 5-фторурацил, является наиболее эффективной для первой линии лечения рецидивного ПРГШ. В качестве примера успешного применения цетуксимаба у пациента с неоперабельным рецидивом ПРГШ можно привести клинический случай.
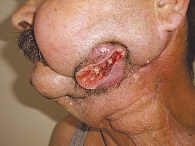
Больному Ф., 58 лет, по поводу рака слизистой оболочки альвеолярного отростка нижней челюсти (Т3N2бМ0, стадия IV, гистологическое исследование – плоскоклеточный рак) в ноябре–декабре 2008 г. по месту жительства была проведена предоперационная лучевая терапия до суммарной очаговой дозы (СОД) 40 Гр. Отмечена стабилизация опухолевого процесса. Для продолжения лечения больной был направлен в РОНЦ им. Н.Н. Блохина РАМН, где 16.02.2009 выполнена операция типа «коммандо»: сегментарная резекция нижней челюсти, резекция тканей дна полости рта, слизистой оболочки левой щеки, фасциально-футлярное иссечение клетчатки шеи слева, пластика дефекта кожно-мышечным лоскутом с включением большой грудной мышцы. При контрольном обследовании 19.05.2009 у больного выявлен продолженный рост опухоли, процесс расценен как неоперабельный (рис. 4). С 26.05.2009 больному начато проведение полихимиотерапии с использованием цетуксимаба, цисплатина и 5-фторурацила. Было проведено шесть курсов полихимиотерапии, лечение закончено 06.10.2009. Отмечена полная регрессия опухоли. При контрольных обследованиях в РОНЦ им. Н.Н. Блохина РАМН в течение 3 лет признаков продолженного роста опухоли и метастазов не выявлено (рис. 5).
Таким образом, на сегодняшний день цетуксимаб должен быть стандартной составляющей схем полихимиотерапии и химиолучевого лечения больных плоскоклеточным раком головы и шеи.
Blokhin Russian Oncological Research Center of the Russian Academy of Medical Sciences, Department of Surgery Of Head nd Neck Tumors
Current guidelines for management of head and neck squamous cell carcinoma (SCCHN) recommend multimodal treatment involving surgery, radiotherapy, and chemotherapy. Several studies demonstrate that concurrent regimen of treatment (cetuximab + radiotherapy) is a standard therapy for stage III–IV locally advanced SCCHN, and also may be a part of sequential chemoradiotherapy.
Key words: locally advanced head and neck squamous cell carcinoma, recurrent/metastatic head and neck squamous cell carcinoma, cetuximab
