Эволюция лекарственной терапии диссеминированного колоректального рака. Химиотерапия
- Аннотация
- Статья
- Ссылки
![Таблица 1. Результаты исследования III фазы по сравнению эффективности режимов FOLFIRI и FOLFOX6 в ХТ первой и второй линий диссеминированного КРР [8]](/upload/resize_cache/iblock/50f/195_350_1/50fc0c105624c9fd5e7cce59ac6e7761.png)
![Таблица 2. Результаты исследования сравнения эффективности режимов FOLFOXIRI и FOLFIRI в первой линии лечения диссеминированного КРР [9, 10]](/upload/resize_cache/iblock/f81/195_350_1/f811a7b2815f54c4f59d5d47d7edd96a.png)

![Таблица 6. Капецитабин + оксалиплатин в первой линии ХТ диссеминированного КРР. Сравнительные рандомизированные исследования III фазы [25]](/upload/resize_cache/iblock/e6f/195_350_1/e6fbbf9eff1c38eb865a1901257acc8d.png)
Более 40 лет единственным препаратом для лечения диссеминированного колоректального рака являлся 5-фторурацил (5-ФУ). Химиотерапия (ХТ) 5-ФУ в комбинации с лейковорином (ЛВ) позволила увеличить медиану продолжительности жизни больных с 6 мес. до 10–12 мес. при струйном введении и до 14 мес. при инфузионном введении препаратов [1–4]. Именно 5-ФУ/ЛВ долгие годы оставался стандартом химиотерапии колоректального рака. В США традиционно использовались режимы струйного введения. В Европе отдавалось предпочтение инфузионному введению препаратов как более эффективному и менее токсичному [5].
Анализ данных проспективных рандомизированных исследований с участием 2500 больных, получавших в первой линии ХТ на основе 5-ФУ, позволил выделить 4 клинико-биологических фактора прогноза эффективности ХТ: общее состояние (функциональный статус) больного (оценивается обычно по шкале, предложенной Eastern Cooperative Oncology Group – ECOG), количество лейкоцитов, число пораженных органов, уровень щелочной фосфатазы. При функциональном статусе пациента по шкале ECOG 2 и более, количестве лейкоцитов более 10000/мл, наличии более 1 пораженного метастазами органа и уровне щелочной фосфатазы более 300 Ед/л медиана выживаемости составила 6,1 месяца (прогностически неблагоприятная группа); при функциональном статусе 0–1, количестве лейкоцитов менее 10000/мл, поражении 1 органа и уровне щелочной фосфатазы менее 300 ед/л – 15,0 месяцев (прогностически благоприятная группа); в группе промежуточного риска – 10,7 месяца [6, 7].
На рубеже XX–XXI веков в клинической практике появились новые противоопухолевые средства с отличным от 5-ФУ механизмом действия, что кардинально изменило возможности лечения КРР. К ним относятся препараты цитотоксического действия: иринотекан (CAMPTO, CPT-11, Irinotecan), оксалиплатин (Oxaliplatin, Eloxatin), капецитабин (Сapecitabine, Xeloda), также препараты таргетной терапии: бевацизумаб (Bevacizumab, Avastin) – моноклональное антитело, блокирующее фактор роста эндотелия сосудов, цетуксимаб (C-225, Cetuximab, Erbitux) и панитумумаб (Вектибикс) – моноклональные антитела, блокирующие рецепторы эпидермального фактора роста.
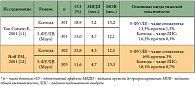
Фундаментальным исследованием, надолго определившим тактику лечения больных диссеминированным КРР, стало исследование C. Tournigand и соавт. [8]. В исследовании была решена проблема выбора ХТ первой линии, доказана возможность проведения второй линии лечения, показано, что последовательное применение эффективных режимов ХТ позволяет улучшить отдаленные результаты лечения, определена оптимальная последовательность режимов [8]. Путем рандомизации больные были разделены на 2 группы: больным первой группы в 1-й линии проводили ХТ по схеме FOLFIRI (иринотекан/ЛВ/5-ФУ), при регистрации прогрессирования болезни во 2-й линии применялся режим FOLFOX6 (оксалиплатин/ЛВ/5-ФУ). Больным второй группы лечение начинали по схеме FOLFOX6, после прогрессирования процесса их переводили на ХТ в режиме FOLFIRI. Оценка эффекта производилась каждые 4 введения, токсичности – перед каждым введением препаратов. Полученные результаты показали одинаковую эффективность изучаемых режимов в первой линии ХТ при равной медиане выживаемости больных. Во второй линии лечения режим FOLFOX6 позволил добиться объективного эффекта у 15% больных при медиане времени до прогрессирования 4,5 месяца, режим FOLFIRI – у 4% при медиане времени до прогрессирования 2,5 месяца. Низкая эффективность режима FOLFIRI во 2-й линии ХТ (не повлиявшая, однако, на выживаемость) позволила авторам предположить, что 5-ФУ не является обязательным компонентом 2-й линии после режима FOLFOX и возможна монотерапия иринотеканом. Было выявлено лишь два достоверных прогностических фактора, влияющих на эффективность 1-й линии: хороший функциональный статус больного (p = 0,001) и локализация метастазов только в печени (p = 0,004). Резекцию печени удалось выполнить 9% больных, получавших в первой линии режим FOLFIRI, и 22% больных, получавших FOLFOX6 (p = 0,02) (табл. 1).
Наиболее впечатляющим результатом данного исследования стала медиана выживаемости больных, превышающая 20 месяцев в обеих группах. Подобных отдаленных результатов лечения ранее не удавалось достичь ни в одном рандомизированном исследовании по лечению диссеминированного КРР. Возможной причиной успеха могло быть плановое последовательное проведение эффективной ХТ второй линии. Оба режима до настоящего времени рекомендуются в качестве стандарта первой линии химиотерапии диссеминированного КРР. Помимо режимов FOLFOX и FOLFIRI еще одним эффективным режимом ХТ первой линии стала комбинация, включающая элоксатин 85 мг/м² в 1-й день + иринотекан 180 мг/ м² в 1-й день + лейковорин 200 мг/м² х 2 часа в 1-й день + 5-ФУ 400 мг/м² струйно в 1-й день, затем инфузия 2400 мг/м² х 46 час, каждые 2 недели – режим FOLFOXIRI или FOLFIRINOX.
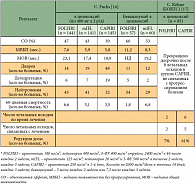
В сравнительном исследовании III фазы (n = 244) (табл. 2) было показано достоверное повышение эффективности лечения диссеминированного КРР при использовании в первой линии ХТ трехкомпонентного режима FOLFOXIRI по сравнению с режимом FOLFIRI. Частота радикальных резекций при изолированном метастатическом поражении печени составила 36%. Сводные данные по эффективности комбинации FOLFOXIRI при исходно неоперабельных метастазах КРР в печень представлены в таблице 3.
Согласно результатам обобщенного анализа данных двух исследований [13], больные, получавшие лечение Кселодой, существенно реже нуждались в госпитализации по поводу жизнеугрожающей токсичности ХТ (11,6% против 18,8%) и во врачебных визитах. Несмотря на отсутствие исследований прямого сравнения эффективности и токсичности капецитабина с комбинацией 5-ФУ/ЛВ в режиме инфузионного введения, Кселода начала успешно заменять инфузионный 5-ФУ/ЛВ в лечении КРР как в монотерапии, так и в комбинированных режимах с иринотеканом или оксалиплатином, являющихся стандартами ХТ первой линии.
Комбинация Кселоды с иринотеканом изучалась, как правило, в двух вариантах. Режим XELIRI: иринотекан в дозе 225–250 мг/м² в 1-й день трехнедельного цикла + капецитабин по 1000 мг/м² х 2 р/сут с 1–14-й или во 2–15-й дни трехнедельного цикла. Режим CAPIRI: еженедельное введение иринотекана по 100–125 мг/м² в 1-й и 8-й дни трехнедельного цикла + капецитабин по 1000 мг/м² х 2 р/сут в 1–14-й или 2–15-й дни или иринотекан по 70–80 мг/м² в 1,8,15,22 ± 29,35 дни + капецитабин в том же режиме.
В исследованиях E. Bajetta [14] и M.M. Borner [15] проведено сравнительное изучение режимов XELIRI и CAPIRI у больных диссеминированным КРР. По данным обоих авторов, несмотря на редукцию доз препаратов, наиболее частым из побочных эффектов 3–4-й степени тяжести являлась диарея, при этом однократное введение иринотекана на протяжении цикла лечения (режим XELIRI) кажется менее токсичным: диарея 3–4-й степени для режимов CAPIRI и XELIRI наблюдалась соответственно у 34% и 19% больных, по данным M.M. Borner, и у 38% и 26%, по данным E. Bajetta.
Дальнейшее изучение режима CAPIRI в сравнительных исследованиях III фазы показало, что комбинация капецитабина с еженедельным введением иринотекана сопровождается неприемлемо высокой частотой токсических реакций не ниже 3-й степени (табл. 5). Частота тяжелой диареи и дегидратации у больных, получавших данный режим, встречалась в 2 раза чаще, чем при использовании комбинации FOLFIRI (диарея – у 48% больных, получавших CAPIRI, против 14 и 19% больных, получавших FOLFIRI и mIFL; дегидратация – у 19 против 6 и 7% больных соответственно).
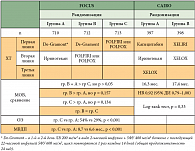
Наиболее популярным благодаря удобству проведения и низкой управляемой токсичности стал режим XELOX. В настоящее время известны результаты достаточно большого числа клинических рандомизированных исследований III фазы по сравнению комбинации капецитабина с оксалиплатином с комбинациями оксалиплатина с 5-ФУ (табл. 6) [25]. В 2011 г. был опубликован анализ 6 рандомизированных исследований III фазы по применению капецитабина у больных РМЖ и раком толстой кишки (как в адъювантном режиме, так и при диссеминированной форме). Было показано, что нежелательные явления, связанные с приемом капецитабина, поддаются коррекции благодаря гибкому подбору дозы препарата или отсроченному началу цикла ХТ, что не влияло на эффективность терапии. В данном анализе больше чем у половины больных (57–67%) наблюдалось снижение дозы капецитабина, отсроченное начало курса ХТ, что не влияло на показатели времени без прогрессирования и времени без признаков заболевания. Эта тенденция сохранялась во всех показаниях [38].
Результаты всех рандомизированных исследований свидетельствуют о равной эффективности режима XELOX и комбинаций оксалиплатина с 5-ФУ в различных режимах. Практически во всех исследованиях при использовании режима XELOX отмечена более низкая частота нейтропений и фебрильных нейтропений. Что касается гастроинтестинальной токсичности, то в части исследований показана меньшая частота диареи и стоматитов на фоне ХТ по схеме XELOX [26, 29], в ряде других исследований, наоборот, частота диареи или тяжелой дегидратации выше [27, 31, 32]. Ретроспективный мультивариантный анализ исследований III фазы, представленный различными авторами, выявил, что переносимость фторпиримидинов как в монотерапии [33], так и в комбинации с оксалиплатином [34], различается в зависимости от региона проживания пациентов. Так, частота тяжелой токсичности (3–4-й степени) оказалась существенно выше у жителей США по сравнению с жителями остальных стран мира.
В 2011 г. был опубликован метаанализ эффективности применения капецитабина и 5-ФУ у больных КРР и РЖ, основанный на базе данных пациентов, участвовавших в 6 исследованиях III фазы. Общее количество пациентов – 6171: из них с раком толстой кишки III стадии – 1987, мКРР – 3868, РЖ – 316. В данном мета-анализе было достоверно показано, что капецитабин равноэффективен 5-ФУ в показателях общей выживаемости ОР 0,94% (95% ДИ 0,89–1,00; р = 0,0489) [39].
Создание новых комбинированных режимов ХТ привело к повышению эффективности лечения диссеминированного КРР и увеличению продолжительности жизни больных. Расширение спектра эффективных цитостатиков сделало возможным проведение нескольких линий ХТ, что положительно повлияло на отдаленные результаты лечения. Анализ рандомизированных исследований III фазы, проведенный A. Grothey (2004) [35], выявил прямо пропорциональную зависимость между продолжительностью жизни больных диссеминированным КРР и количеством активных препаратов, использованных в лечении.
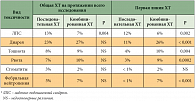
Согласно результатам исследований, явное улучшение МОВ больных, полученное при использовании комбинированных режимов в 1-й и 2-й линиях, не достигло статистической достоверности. По данным исследования CAIRO, токсичность обоих тактических подходов в целом была одинакова, за исключением ладонно-подошвенного синдрома, который достоверно чаще регистрировался при последовательной монотерапии вследствие увеличения суточной дозы капецитабина в монорежиме до 2500 мг/м²/сут (табл. 8). Говоря о токсичности первой линии ХТ, следует отметить, что при режимах комбинированной ХТ чаще регистрировались токсические явления 3-й + 4-й степени тяжести по сравнению с монотерапией (табл. 8). Таким образом, при диссеминированном, потенциально неоперабельном КРР применение последовательной монохимиотерапии является обоснованной альтернативой комбинированным режимам химиотерапии, особенно у больных с высоким риском развития токсических осложнений.
