количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Факторы, влияющие на эффективность обезболивающей терапии
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Неврология и Психиатрия" №5 (47)
- Аннотация
- Статья
- Ссылки
- English
Автором проведен анализ результатов исследования эффективности и безопасности кетопрофена лизиновой соли с целью определения зависимости терапевтического потенциала препарата от влияния ряда клинических факторов, а также установления связи между уровнем обезболивания и субъективной оценкой эффективности анальгетика.
Было установлено, что пол и возраст пациентов, а также неудачный опыт использования других нестероидных противовоспалительных препаратов не влиял на результат терапии. Подчеркивается, что первоначальное внутримышечное введение лизиновой соли кетопрофена, а также ее комбинация с миорелаксантами ассоциированы с более высокой эффективностью лечения.
Было установлено, что пол и возраст пациентов, а также неудачный опыт использования других нестероидных противовоспалительных препаратов не влиял на результат терапии. Подчеркивается, что первоначальное внутримышечное введение лизиновой соли кетопрофена, а также ее комбинация с миорелаксантами ассоциированы с более высокой эффективностью лечения.
Автором проведен анализ результатов исследования эффективности и безопасности кетопрофена лизиновой соли с целью определения зависимости терапевтического потенциала препарата от влияния ряда клинических факторов, а также установления связи между уровнем обезболивания и субъективной оценкой эффективности анальгетика.
Было установлено, что пол и возраст пациентов, а также неудачный опыт использования других нестероидных противовоспалительных препаратов не влиял на результат терапии. Подчеркивается, что первоначальное внутримышечное введение лизиновой соли кетопрофена, а также ее комбинация с миорелаксантами ассоциированы с более высокой эффективностью лечения.
Было установлено, что пол и возраст пациентов, а также неудачный опыт использования других нестероидных противовоспалительных препаратов не влиял на результат терапии. Подчеркивается, что первоначальное внутримышечное введение лизиновой соли кетопрофена, а также ее комбинация с миорелаксантами ассоциированы с более высокой эффективностью лечения.
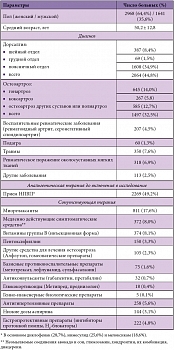
Таблица 1. Характеристика больных, принявших участие в исследовании КУЛОН (n = 4609)
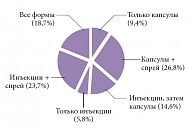
Рис. 1. Различные лекарственные формы КЛС и их сочетания, использованные в исследовании КУЛОН
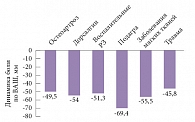
Рис. 2. Динамика выраженности боли при различных заболеваниях (по ВАШ) у пациентов в исследовании КУЛОН
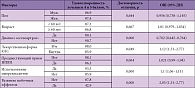
Таблица 2. Влияние различных факторов на субъективную оценку эффективности анальгетической терапии в исследовании КУЛОН
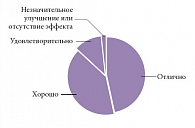
Рис. 3. Субъективная оценка эффективности лечения КЛС в исследовании КУЛОН

Рис. 4. Зависимость субъективной удовлетворенности лечением (в баллах от 1 до 5) от выраженности динамики боли (по ВАШ) в исследовании КУЛОН
Эффективное обезболивание относится к числу первоочередных задач медицинской помощи. Боль – самое тягостное проявление основных патологических состояний, поэтому ее быстрое и максимально полное устранение позволяет существенно улучшить качество жизни пациентов и завоевать их доверие, что немаловажно, если речь идет о дебюте хронического заболевания, требующего длительной патогенетической терапии. Кроме этого, адекватная анальгезия позволяет предотвратить хронизацию острой боли, в свою очередь хроническая боль – это самостоятельный синдром, с которым связывают стойкое нарушение трудоспособности и снижение продолжительности жизни пациентов [1–3].
Центральное место среди анальгетиков, применяемых для купирования боли, возникшей на фоне повреждения или воспаления, занимают нестероидные противовоспалительные препараты (НПВП). НПВП оказывают комплексное обезболивающее, противовоспалительное и жаропонижающее действие, что обусловливает возможность их использования в купировании болей, связанных с заболеваниями опорно-двигательной системы [1–3].
В настоящее время в практике используется широкий спектр различных НПВП; их разнообразие предоставляет большие возможности для индивидуального подбора лекарственного средства. Важным вопросом является прогноз эффективности обезболивающей терапии, что в первую очередь связано с определением факторов, которые способны влиять на результат лечения. Эти факторы должны учитываться при планировании обезболивающей терапии, чтобы вероятность достижения терапевтического успеха была как можно выше [4]. В этой связи, планируя назначение того или иного НПВП, лечащий врач должен учитывать фармакологические преимущества препарата. Кроме того, хорошо известно, что «ответ» на лечение НПВП может существенно различаться и зависит не только от свойств конкретного средства, но и от конкретной клинической ситуации и самого пациента [5–7].
Очевидно, что при оценке «ответа» на терапию должны использоваться стандартизированные инструменты оценки выраженности боли и самочувствия. Среди них наиболее простыми представляются визуальная аналоговая шкала (ВАШ), а также балльная оценка удовлетворенности лечением. Однако необходимо понимать, какая динамика этих показателей соответствует мнению больного о низкой или высокой эффективности терапии, а также какое различие между данными параметрами определяется как субъективно значимое.
Возможность проведения подобного анализа предоставляется при проведении масштабных клинических испытаний новых (или относительно новых) препаратов – представителей группы НПВП. Так, недавно в России было закончено исследование эффективности и безопасности кетопрофена лизиновой соли (КЛС). Этот препарат представляет собой модифицированный кетопрофен – широко используемый в клинической практике в качестве мощного и быстродействующего анальгетика [8]. Нами была изучена зависимость терапевтического потенциала КЛС от влияния ряда клинических факторов, а также определена взаимосвязь между уровнем обезболивания и субъективной оценкой эффективности этого препарата.
Материал и методы
Материалом для анализа послужили данные открытого наблюдательного исследования КУЛОН (Кетопрофен: Удовлетворенность Лечением и Оценка Нежелательных явлений). В ходе исследования в реальной клинической практике проводилась оценка эффективности и переносимости КЛС (Артрозилен®) у амбулаторных пациентов с заболеваниями или травмами опорно-двигательного аппарата, испытывающих выраженные мышечно-скелетные боли. Показания и противопоказания для назначения КЛС соответствовали инструкции по применению этого препарата. Период наблюдения составлял 2 недели; при этом лечащий врач, учитывая особенности клинического случая, мог использовать КЛС в виде капсул контролируемого высвобождения, спрея, короткого курса внутримышечных инъекций, ректальных свечей или последовательно сочетать разные формы. Результаты применения КЛС вносились в специальную карту. Учитывались такие параметры, как предшествующая анальгетическая и сопутствующая терапия, выраженность боли и ухудшения самочувствия (по ВАШ) до и после 2-недельного курса лечения, суммарная оценка эффективности препарата по 5-балльной шкале (где «1» – нет эффекта, а «5» – отличный эффект), развитие побочных явлений.
В итоге статистическому анализу были подвергнуты данные по применению КЛС у 4609 амбулаторных больных. Клиническая характеристика пациентов представлена в таблице 1. Среди пациентов преобладали женщины среднего и пожилого возраста, а наиболее распространенными диагнозами были «дорсалгия» и «остеоартроз» (в основном крупных суставов). Около половины больных на момент назначения КЛС получали другие НПВП; существенная часть пациентов (17,6%) использовала миорелаксанты.
Эффективность терапии определялась по динамике выраженности боли и самочувствия, а также удовлетворенности лечением. Был проведен анализ зависимости результата лечения (при этом хорошим результатом считалась удовлетворенность лечением не менее 4 баллов) от ряда факторов, таких как пол, возраст, диагноз, лекарственная форма КЛС, предшествующая терапия НПВП и миорелаксантами, развитие побочных эффектов.
Электронная база данных была создана с помощью программы Microsoft Office Excel 2007, статистический анализ проводился с помощью программы SPSS 10.0. Приведенные в статье цифровые значения представлены в виде средних величин и ошибок среднего значения (M ± m). Для оценки значимости отличия количественных параметров использован t-тест Стьюдента, для качественных параметров – точный тест Фишера, а также определено соотношение шансов (ОШ), которое представлено вместе с 95% доверительным интервалом (ДИ).
Результаты
Большинство врачей (73,8%) предпочитало начинать обезболивающую терапию с в/м введения КЛС, в основном в сочетании с формой для локального применения, а затем переходить на пероральный прием этого лекарства. Реже врачи ограничивались коротким курсом в/м введения КЛС без использования других лекарственных форм. Чуть больше трети врачей (36,2%) назначали только пероральную форму КЛС как в сочетании с гелем или спреем, так и без применения локальных форм (рис. 1).
Лечение оказалось весьма действенным – средний уровень боли по ВАШ снизился с 67,93 ± 15,63 до 15,96 ± 13,48 мм; средняя абсолютная величина динамики болевых ощущений составила 52,2 ± 18,5 мм. Кроме того, улучшилось общее самочувствие (снижение по ВАШ с 57,43 ± 22,05 до 11,93 ± 11,88 мм).
На рисунке 2 показана зависимость динамики боли от диагноза. Как видно, наилучший результат был отмечен у больных подагрой, дорсалгиями и ревматическим поражением околосуставных мягких тканей, менее выраженное снижение боли было выявлено у больных остеоартрозом и пациентов с травмами (различие достоверно, р < 0,001). При этом наихудший результат был зафиксирован у пациентов, страдающих коксартрозом («хороший» или «отличный» результат лишь в 68% случаев), в сравнении со средним результатом по группе или пациентами с остеоартрозом другой локализации (в частности, при гонартрозе «хороший» или «отличный» результат отмечен у 80,1% больных), р < 0,001.
Большинство больных (87,1%) отметили высокую эффективность КЛС (рис. 3). Как видно, подавляющее большинство из них оценило действие этого препарата как «хорошее» или «отличное». Лишь немногие больные – 74 (1,6%) – назвали результат терапии КЛС «неудовлетворительным» (1–2 балла по 5-балльной шкале удовлетворенности).
Отмечалось определенное различие по динамике боли в зависимости от используемых лекарственных форм КЛС и их сочетаний. Так, наибольшее снижение выраженности боли отмечалось при назначении в дебюте в/м инъекций в сочетании со спреем – на 55,4 ± 18,9 мм по ВАШ, по сравнению с пероральным приемом – на 51,3 ± 19,6 мм, комбинацией перорального приема и спрея – на 50,6 ± 19,4 мм, инъекциями с дальнейшим переходом на пероральный прием – на 52,9 ± 17,6 мм, только в/м инъекциями – на 49,7 ± 16,7 и комбинацией всех форм – на 51,5 ± 16,5 мм. Аналогичной оказалась и оценка удовлетворенности. Так, «хорошо» или «отлично» оценили терапию 93,4%, 82,2%, 87,1%, 78,7%, 87,4% и 88,6% больных соответственно. Отличие эффекта комбинации в/м введения и спрея от эффекта КЛС в целом оказалось достоверным как в отношении динамики боли, так и удовлетворенности лечением (р < 0,001).
Нами был проведен анализ зависимости субъективной оценки удовлетворенности от динамики уровня боли. Как оказалось, данная зависимость носила линейный характер (рис. 4). Так, различие снижения уровня болевых ощущений между оценками «1» и «2» составило 14,3 (95% ДИ 2,9–25,7) мм ВАШ, р = 0,014; между оценками «2» и «3» – 11,1 (95% ДИ 6,7–15,5) мм, р < 0,001; «3» и «4» – 8,5 (95% ДИ 6,9–9,9) мм, р < 0,001; «4» и «5» – 14,2 (95% ДИ 13,3–15,3) мм, р < 0,001.
Терапия КЛС в большинстве случаев хорошо переносилась. Из нежелательных явлений чаще всего отмечались осложнения со стороны желудочно-кишечного тракта. Так, слабые гастралгии, изжога, тошнота, чувство тяжести были выявлены у 530 (11,5%) пациентов; незначительное учащение стула – у 181 (3,9%), запоры – у 63 (1,4%). Побочные эффекты, представляющие определенную угрозу, потребовавшие дополнительных назначений или прерывания терапии, были зарегистрированы лишь у 61 больного (1,3%): у 40 пациентов – умеренно выраженные или выраженные гастралгии и/или диспепсии (при этом у одного в ходе эндоскопического исследования была выявлена язва желудка, а у 2 – множественные эрозии), у 1 – выраженный запор, у 16 – дестабилизация артериальной гипертонии, у 5 – головные боли или головокружения, у 2 – боли в месте в/м инъекции.
Нами было оценено влияние ряда клинических факторов на результаты лечения. Как было указано выше, лечение считалось успешным, если его субъективная оценка составляла 4 или 5 баллов по 5-балльной шкале; тем более что такая оценка четко ассоциировалась с весьма значительной положительной динамикой болевых ощущений. В таблице 2 продемонстрировано влияние указанных факторов на вероятность достижения успешного результата. Пол, возраст и предшествующий неэффективный прием НПВП не влияли на результат лечения. Применение в/м инъекций КЛС незначительно (хотя и статистически достоверно) улучшало эффективность терапии. Применение миорелаксантов также ассоциировалось с достоверным повышением уровня обезболивания. В то же время хороший результат лечения существенно реже регистрировался у больных остеоартрозом и у тех лиц, у которых отмечалось развитие серьезных побочных эффектов.
Обсуждение результатов
Полученные данные показали высокую эффективность КЛС. Использование этого препарата позволило добиться значительного уменьшения боли и улучшения самочувствия у подавляющего большинства пациентов, включенных в исследование. Этот результат представляется еще более значимым, поскольку примерно половина больных до назначения КЛС получали другие НПВП и не отмечали при этом существенного улучшения своего состояния.
Следует отметить, что эффективность анальгетиков в открытых исследованиях, подобных КУЛОН, практически всегда оценивается очень высоко; такая оценка во многом отражает значительные ожидания пациентов и их лечащих врачей, связанные с применением нового лекарства. В качестве примера можно привести результаты аналогичных по дизайну масштабных исследований мелоксикама и ацеклофенака, выполненных в разных европейских странах. В этих работах эффективность обезболивания оценивалась как хорошая и отличная у 85–90% участников [9, 10]. Аналогичные результаты были показаны в раннем открытом исследовании эффективности кетопрофена, проведенном в конце 1980-х гг. [11]. Эффективность НПВП в двойных слепых рандомизированных плацебоконтролируемых исследованиях оценивается существенно ниже. Это четко показано в работе R. Moor и соавт., которые провели метаанализ серии 12-недельных рандомизированных контролируемых исследований (n = 3554) применения эторикоксиба, целекоксиба, напроксена и ибупрофена при остеоартрозе. Суммарно улучшение ≥ 50% было отмечено менее чем у половины участников этих исследований, при этом использование плацебо давало аналогичный результат примерно у 25% пациентов [12].
Однако кетопрофен, несомненно, является весьма эффективным анальгетиком [8, 13]. Проведенный недавно метаанализ 13 рандомизированных контролируемых исследований (n = 898) показал, что по своему обезболивающему потенциалу он превосходит такие популярные НПВП, как ибупрофен и диклофенак. КЛС обладает более совершенной фармакодинамикой, чем обычный кетопрофен. Этим объясняется более быстрое облегчение боли и сохранение устойчивого и длительного клинического эффекта после однократного перорального приема КЛС [14].
Следует учесть, что в исследовании КУЛОН использовался дифференцированный подход к назначению КЛС. Пациенты могли получать разные лекарственные формы этого препарата, а также их комбинации (например, пероральное или в/м введение и локальная форма), что могло улучшить результаты терапии.
Важным результатом нашего анализа следует считать определение взаимосвязи между динамикой выраженности боли и субъективной оценкой удовлетворенности лечением. Величина различий в динамике боли по шкале ВАШ, по субъективной оценке пациентов, составляла от 8,2 до 14,3 мм ВАШ (в среднем 12,0, ДИ 7,9–16,1), то есть 17,6% от исходного уровня боли. Полученные нами результаты соответствуют данным литературы. Так, была проведена серия работ, в которых оценивался «минимально значимый ответ» на анальгетическую терапию. В этих исследованиях, основанных на изучении динамики боли при ревматических заболеваниях, минимальное улучшение ощущалось пациентами, когда выраженность болевых ощущений снижалась на 15–30% (в среднем 20%) от исходного уровня (по ВАШ эта динамика составляла 10–15 мм) [15–19]. Полученные нами результаты, относящиеся к российской популяции, могут стать основой для проведения более объективной оценки эффекта различных обезболивающих средств как в клинических испытаниях, так и в реальной клинической практике.
Нами было изучено влияние ряда факторов на эффективность обезболивающей терапии. Результат применения НПВП не зависел от пола и возраста пациентов, что соответствует данным других авторов [6, 20]. Нами было также установлено, что результат обезболивания при остеоартрозе был ниже в сравнении с результатами применения КЛС у больных с иными заболеваниями опорно-двигательного аппарата, прежде всего дорсалгиями. Это может объясняться тем, что при дорсалгиях, которые в подавляющем большинстве случаев вызваны функциональными причинами, боль носит острый характер и может быть полностью купирована [21, 22]. В то же время боль при остеоартрозе во многих случаях является хронической, поэтому достичь полного терапевтического успеха в этой ситуации гораздо сложнее. Худшая оценка результатов терапии была отмечена у больных коксартрозом; данный факт уже был установлен ранее. В частности, O. Svensson и соавт. оценивали влияние НПВП на динамику индекса выраженности остеоартроза университетов Западного Онтарио и Макмастера WOMAC (Western Ontario and McMaster Universities Osteoarthritis Index) и индекса оценки качества жизни SF-36 (Short Form-36 – Короткая форма опросника-36) у пациентов с гоартрозом и коксартрозом и отметили существенно более низкие результаты лечения у вторых [23].
Интересен тот факт, что использование в дебюте терапии инъекций КЛС обеспечивало небольшое (хотя и статистически значимое) повышение эффективности лечения в сравнении с первоначальным назначением капсул для перорального приема. С одной стороны, это может указывать на хорошую эффективность пероральной формы КЛС, ее быстрый и стойкий эффект. С другой – результаты лечения оценивались спустя 2 недели, когда возможное преимущество в/м инъекций в первые дни применения (возможно, более быстрое облегчение боли) уже субъективно не определялось.
Любопытным представляется вывод об отсутствии влияния неудачного использования других НПВП на результаты обезболивающей терапии. Очевидно, что если новый препарат «работает», то результаты лечения будут высокими, несмотря на имеющийся у больных негативный опыт. Видимо, недостаточный эффект определенных представителей НПВП определяется не отсутствием «точки приложения» для этого класса анальгетиков в данной клинической ситуации, а индивидуальными особенностями восприятия больного и фармакологическими свойствами конкретного препарата.
Полученные нами данные подтверждают, что комплексная терапия НПВП и миорелаксантами повышает суммарную эффективность лечения. Очевидно, что такая комбинация является целесообразной и должна широко применяться в клинической практике [24, 25].
Важным фактором, влияющим на результат обезболивающей терапии, является ее переносимость. Не вызывает сомнений, что даже мощный анальгетик, если его использование приведет к серьезным лекарственным осложнениям, не сможет существенно улучшить состояние пациента. Именно поэтому КЛС, которая, согласно полученным данным, относительно редко вызывала серьезные побочные эффекты, может рассматриваться как один из наиболее удачных препаратов для купирования острой боли, связанной с заболеваниями опорно-двигательного аппарата.
Центральное место среди анальгетиков, применяемых для купирования боли, возникшей на фоне повреждения или воспаления, занимают нестероидные противовоспалительные препараты (НПВП). НПВП оказывают комплексное обезболивающее, противовоспалительное и жаропонижающее действие, что обусловливает возможность их использования в купировании болей, связанных с заболеваниями опорно-двигательной системы [1–3].
В настоящее время в практике используется широкий спектр различных НПВП; их разнообразие предоставляет большие возможности для индивидуального подбора лекарственного средства. Важным вопросом является прогноз эффективности обезболивающей терапии, что в первую очередь связано с определением факторов, которые способны влиять на результат лечения. Эти факторы должны учитываться при планировании обезболивающей терапии, чтобы вероятность достижения терапевтического успеха была как можно выше [4]. В этой связи, планируя назначение того или иного НПВП, лечащий врач должен учитывать фармакологические преимущества препарата. Кроме того, хорошо известно, что «ответ» на лечение НПВП может существенно различаться и зависит не только от свойств конкретного средства, но и от конкретной клинической ситуации и самого пациента [5–7].
Очевидно, что при оценке «ответа» на терапию должны использоваться стандартизированные инструменты оценки выраженности боли и самочувствия. Среди них наиболее простыми представляются визуальная аналоговая шкала (ВАШ), а также балльная оценка удовлетворенности лечением. Однако необходимо понимать, какая динамика этих показателей соответствует мнению больного о низкой или высокой эффективности терапии, а также какое различие между данными параметрами определяется как субъективно значимое.
Возможность проведения подобного анализа предоставляется при проведении масштабных клинических испытаний новых (или относительно новых) препаратов – представителей группы НПВП. Так, недавно в России было закончено исследование эффективности и безопасности кетопрофена лизиновой соли (КЛС). Этот препарат представляет собой модифицированный кетопрофен – широко используемый в клинической практике в качестве мощного и быстродействующего анальгетика [8]. Нами была изучена зависимость терапевтического потенциала КЛС от влияния ряда клинических факторов, а также определена взаимосвязь между уровнем обезболивания и субъективной оценкой эффективности этого препарата.
Материал и методы
Материалом для анализа послужили данные открытого наблюдательного исследования КУЛОН (Кетопрофен: Удовлетворенность Лечением и Оценка Нежелательных явлений). В ходе исследования в реальной клинической практике проводилась оценка эффективности и переносимости КЛС (Артрозилен®) у амбулаторных пациентов с заболеваниями или травмами опорно-двигательного аппарата, испытывающих выраженные мышечно-скелетные боли. Показания и противопоказания для назначения КЛС соответствовали инструкции по применению этого препарата. Период наблюдения составлял 2 недели; при этом лечащий врач, учитывая особенности клинического случая, мог использовать КЛС в виде капсул контролируемого высвобождения, спрея, короткого курса внутримышечных инъекций, ректальных свечей или последовательно сочетать разные формы. Результаты применения КЛС вносились в специальную карту. Учитывались такие параметры, как предшествующая анальгетическая и сопутствующая терапия, выраженность боли и ухудшения самочувствия (по ВАШ) до и после 2-недельного курса лечения, суммарная оценка эффективности препарата по 5-балльной шкале (где «1» – нет эффекта, а «5» – отличный эффект), развитие побочных явлений.
В итоге статистическому анализу были подвергнуты данные по применению КЛС у 4609 амбулаторных больных. Клиническая характеристика пациентов представлена в таблице 1. Среди пациентов преобладали женщины среднего и пожилого возраста, а наиболее распространенными диагнозами были «дорсалгия» и «остеоартроз» (в основном крупных суставов). Около половины больных на момент назначения КЛС получали другие НПВП; существенная часть пациентов (17,6%) использовала миорелаксанты.
Эффективность терапии определялась по динамике выраженности боли и самочувствия, а также удовлетворенности лечением. Был проведен анализ зависимости результата лечения (при этом хорошим результатом считалась удовлетворенность лечением не менее 4 баллов) от ряда факторов, таких как пол, возраст, диагноз, лекарственная форма КЛС, предшествующая терапия НПВП и миорелаксантами, развитие побочных эффектов.
Электронная база данных была создана с помощью программы Microsoft Office Excel 2007, статистический анализ проводился с помощью программы SPSS 10.0. Приведенные в статье цифровые значения представлены в виде средних величин и ошибок среднего значения (M ± m). Для оценки значимости отличия количественных параметров использован t-тест Стьюдента, для качественных параметров – точный тест Фишера, а также определено соотношение шансов (ОШ), которое представлено вместе с 95% доверительным интервалом (ДИ).
Результаты
Большинство врачей (73,8%) предпочитало начинать обезболивающую терапию с в/м введения КЛС, в основном в сочетании с формой для локального применения, а затем переходить на пероральный прием этого лекарства. Реже врачи ограничивались коротким курсом в/м введения КЛС без использования других лекарственных форм. Чуть больше трети врачей (36,2%) назначали только пероральную форму КЛС как в сочетании с гелем или спреем, так и без применения локальных форм (рис. 1).
Лечение оказалось весьма действенным – средний уровень боли по ВАШ снизился с 67,93 ± 15,63 до 15,96 ± 13,48 мм; средняя абсолютная величина динамики болевых ощущений составила 52,2 ± 18,5 мм. Кроме того, улучшилось общее самочувствие (снижение по ВАШ с 57,43 ± 22,05 до 11,93 ± 11,88 мм).
На рисунке 2 показана зависимость динамики боли от диагноза. Как видно, наилучший результат был отмечен у больных подагрой, дорсалгиями и ревматическим поражением околосуставных мягких тканей, менее выраженное снижение боли было выявлено у больных остеоартрозом и пациентов с травмами (различие достоверно, р < 0,001). При этом наихудший результат был зафиксирован у пациентов, страдающих коксартрозом («хороший» или «отличный» результат лишь в 68% случаев), в сравнении со средним результатом по группе или пациентами с остеоартрозом другой локализации (в частности, при гонартрозе «хороший» или «отличный» результат отмечен у 80,1% больных), р < 0,001.
Большинство больных (87,1%) отметили высокую эффективность КЛС (рис. 3). Как видно, подавляющее большинство из них оценило действие этого препарата как «хорошее» или «отличное». Лишь немногие больные – 74 (1,6%) – назвали результат терапии КЛС «неудовлетворительным» (1–2 балла по 5-балльной шкале удовлетворенности).
Отмечалось определенное различие по динамике боли в зависимости от используемых лекарственных форм КЛС и их сочетаний. Так, наибольшее снижение выраженности боли отмечалось при назначении в дебюте в/м инъекций в сочетании со спреем – на 55,4 ± 18,9 мм по ВАШ, по сравнению с пероральным приемом – на 51,3 ± 19,6 мм, комбинацией перорального приема и спрея – на 50,6 ± 19,4 мм, инъекциями с дальнейшим переходом на пероральный прием – на 52,9 ± 17,6 мм, только в/м инъекциями – на 49,7 ± 16,7 и комбинацией всех форм – на 51,5 ± 16,5 мм. Аналогичной оказалась и оценка удовлетворенности. Так, «хорошо» или «отлично» оценили терапию 93,4%, 82,2%, 87,1%, 78,7%, 87,4% и 88,6% больных соответственно. Отличие эффекта комбинации в/м введения и спрея от эффекта КЛС в целом оказалось достоверным как в отношении динамики боли, так и удовлетворенности лечением (р < 0,001).
Нами был проведен анализ зависимости субъективной оценки удовлетворенности от динамики уровня боли. Как оказалось, данная зависимость носила линейный характер (рис. 4). Так, различие снижения уровня болевых ощущений между оценками «1» и «2» составило 14,3 (95% ДИ 2,9–25,7) мм ВАШ, р = 0,014; между оценками «2» и «3» – 11,1 (95% ДИ 6,7–15,5) мм, р < 0,001; «3» и «4» – 8,5 (95% ДИ 6,9–9,9) мм, р < 0,001; «4» и «5» – 14,2 (95% ДИ 13,3–15,3) мм, р < 0,001.
Терапия КЛС в большинстве случаев хорошо переносилась. Из нежелательных явлений чаще всего отмечались осложнения со стороны желудочно-кишечного тракта. Так, слабые гастралгии, изжога, тошнота, чувство тяжести были выявлены у 530 (11,5%) пациентов; незначительное учащение стула – у 181 (3,9%), запоры – у 63 (1,4%). Побочные эффекты, представляющие определенную угрозу, потребовавшие дополнительных назначений или прерывания терапии, были зарегистрированы лишь у 61 больного (1,3%): у 40 пациентов – умеренно выраженные или выраженные гастралгии и/или диспепсии (при этом у одного в ходе эндоскопического исследования была выявлена язва желудка, а у 2 – множественные эрозии), у 1 – выраженный запор, у 16 – дестабилизация артериальной гипертонии, у 5 – головные боли или головокружения, у 2 – боли в месте в/м инъекции.
Нами было оценено влияние ряда клинических факторов на результаты лечения. Как было указано выше, лечение считалось успешным, если его субъективная оценка составляла 4 или 5 баллов по 5-балльной шкале; тем более что такая оценка четко ассоциировалась с весьма значительной положительной динамикой болевых ощущений. В таблице 2 продемонстрировано влияние указанных факторов на вероятность достижения успешного результата. Пол, возраст и предшествующий неэффективный прием НПВП не влияли на результат лечения. Применение в/м инъекций КЛС незначительно (хотя и статистически достоверно) улучшало эффективность терапии. Применение миорелаксантов также ассоциировалось с достоверным повышением уровня обезболивания. В то же время хороший результат лечения существенно реже регистрировался у больных остеоартрозом и у тех лиц, у которых отмечалось развитие серьезных побочных эффектов.
Обсуждение результатов
Полученные данные показали высокую эффективность КЛС. Использование этого препарата позволило добиться значительного уменьшения боли и улучшения самочувствия у подавляющего большинства пациентов, включенных в исследование. Этот результат представляется еще более значимым, поскольку примерно половина больных до назначения КЛС получали другие НПВП и не отмечали при этом существенного улучшения своего состояния.
Следует отметить, что эффективность анальгетиков в открытых исследованиях, подобных КУЛОН, практически всегда оценивается очень высоко; такая оценка во многом отражает значительные ожидания пациентов и их лечащих врачей, связанные с применением нового лекарства. В качестве примера можно привести результаты аналогичных по дизайну масштабных исследований мелоксикама и ацеклофенака, выполненных в разных европейских странах. В этих работах эффективность обезболивания оценивалась как хорошая и отличная у 85–90% участников [9, 10]. Аналогичные результаты были показаны в раннем открытом исследовании эффективности кетопрофена, проведенном в конце 1980-х гг. [11]. Эффективность НПВП в двойных слепых рандомизированных плацебоконтролируемых исследованиях оценивается существенно ниже. Это четко показано в работе R. Moor и соавт., которые провели метаанализ серии 12-недельных рандомизированных контролируемых исследований (n = 3554) применения эторикоксиба, целекоксиба, напроксена и ибупрофена при остеоартрозе. Суммарно улучшение ≥ 50% было отмечено менее чем у половины участников этих исследований, при этом использование плацебо давало аналогичный результат примерно у 25% пациентов [12].
Однако кетопрофен, несомненно, является весьма эффективным анальгетиком [8, 13]. Проведенный недавно метаанализ 13 рандомизированных контролируемых исследований (n = 898) показал, что по своему обезболивающему потенциалу он превосходит такие популярные НПВП, как ибупрофен и диклофенак. КЛС обладает более совершенной фармакодинамикой, чем обычный кетопрофен. Этим объясняется более быстрое облегчение боли и сохранение устойчивого и длительного клинического эффекта после однократного перорального приема КЛС [14].
Следует учесть, что в исследовании КУЛОН использовался дифференцированный подход к назначению КЛС. Пациенты могли получать разные лекарственные формы этого препарата, а также их комбинации (например, пероральное или в/м введение и локальная форма), что могло улучшить результаты терапии.
Важным результатом нашего анализа следует считать определение взаимосвязи между динамикой выраженности боли и субъективной оценкой удовлетворенности лечением. Величина различий в динамике боли по шкале ВАШ, по субъективной оценке пациентов, составляла от 8,2 до 14,3 мм ВАШ (в среднем 12,0, ДИ 7,9–16,1), то есть 17,6% от исходного уровня боли. Полученные нами результаты соответствуют данным литературы. Так, была проведена серия работ, в которых оценивался «минимально значимый ответ» на анальгетическую терапию. В этих исследованиях, основанных на изучении динамики боли при ревматических заболеваниях, минимальное улучшение ощущалось пациентами, когда выраженность болевых ощущений снижалась на 15–30% (в среднем 20%) от исходного уровня (по ВАШ эта динамика составляла 10–15 мм) [15–19]. Полученные нами результаты, относящиеся к российской популяции, могут стать основой для проведения более объективной оценки эффекта различных обезболивающих средств как в клинических испытаниях, так и в реальной клинической практике.
Нами было изучено влияние ряда факторов на эффективность обезболивающей терапии. Результат применения НПВП не зависел от пола и возраста пациентов, что соответствует данным других авторов [6, 20]. Нами было также установлено, что результат обезболивания при остеоартрозе был ниже в сравнении с результатами применения КЛС у больных с иными заболеваниями опорно-двигательного аппарата, прежде всего дорсалгиями. Это может объясняться тем, что при дорсалгиях, которые в подавляющем большинстве случаев вызваны функциональными причинами, боль носит острый характер и может быть полностью купирована [21, 22]. В то же время боль при остеоартрозе во многих случаях является хронической, поэтому достичь полного терапевтического успеха в этой ситуации гораздо сложнее. Худшая оценка результатов терапии была отмечена у больных коксартрозом; данный факт уже был установлен ранее. В частности, O. Svensson и соавт. оценивали влияние НПВП на динамику индекса выраженности остеоартроза университетов Западного Онтарио и Макмастера WOMAC (Western Ontario and McMaster Universities Osteoarthritis Index) и индекса оценки качества жизни SF-36 (Short Form-36 – Короткая форма опросника-36) у пациентов с гоартрозом и коксартрозом и отметили существенно более низкие результаты лечения у вторых [23].
Интересен тот факт, что использование в дебюте терапии инъекций КЛС обеспечивало небольшое (хотя и статистически значимое) повышение эффективности лечения в сравнении с первоначальным назначением капсул для перорального приема. С одной стороны, это может указывать на хорошую эффективность пероральной формы КЛС, ее быстрый и стойкий эффект. С другой – результаты лечения оценивались спустя 2 недели, когда возможное преимущество в/м инъекций в первые дни применения (возможно, более быстрое облегчение боли) уже субъективно не определялось.
Любопытным представляется вывод об отсутствии влияния неудачного использования других НПВП на результаты обезболивающей терапии. Очевидно, что если новый препарат «работает», то результаты лечения будут высокими, несмотря на имеющийся у больных негативный опыт. Видимо, недостаточный эффект определенных представителей НПВП определяется не отсутствием «точки приложения» для этого класса анальгетиков в данной клинической ситуации, а индивидуальными особенностями восприятия больного и фармакологическими свойствами конкретного препарата.
Полученные нами данные подтверждают, что комплексная терапия НПВП и миорелаксантами повышает суммарную эффективность лечения. Очевидно, что такая комбинация является целесообразной и должна широко применяться в клинической практике [24, 25].
Важным фактором, влияющим на результат обезболивающей терапии, является ее переносимость. Не вызывает сомнений, что даже мощный анальгетик, если его использование приведет к серьезным лекарственным осложнениям, не сможет существенно улучшить состояние пациента. Именно поэтому КЛС, которая, согласно полученным данным, относительно редко вызывала серьезные побочные эффекты, может рассматриваться как один из наиболее удачных препаратов для купирования острой боли, связанной с заболеваниями опорно-двигательного аппарата.
1. Боль. Практическое руководство для врачей / под ред. Н.Н. Яхно, М.Л. Кукушкина. М.: Издательство РАМН, 2012. 512 c.
2. Lee Y.C. Effect and treatment of chronic pain in inflammatory arthritis // Curr. Rheumatol. Rep. 2013. Vol. 15. № 1. P. 300.
3. Яхно Н.Н., Кукушкин М.Л. Хроническая боль: медико-биологические и социально-экономические аспекты // Вестник Российской академии медицинских наук. 2012. № 9. С. 54–58.
4. Stamer U.M., Zhang L., Stüber F. Personalized therapy in pain management: where do we stand? // Pharmacogenomics. 2010. Vol. 11. № 6. P. 843–864.
5. Pavelka K., Pelisková Z., Stehlíková H. et al. Intraindividual differences in pain relief and functional improvement in osteoarthritis with diclofenac or tramadol // Clin. Drug Investig. 1998. Vol. 16. № 6. P. 421–429.
6. Simon L.S., Evans C., Katz N. et al. Preliminary development of a responder index for chronic low back pain // J. Rheumatol. 2007. Vol. 34. № 6. P. 1386–1391.
7. Bingham C.O. 3rd, Bird S.R., Smugar S.S. et al. Responder analysis and correlation of outcome measures: pooled results from two identical studies comparing etoricoxib, celecoxib, and placebo in osteoarthritis // Osteoarthritis Cartilage. 2008. Vol. 16. № 11. P. 1289–1293.
8. Sarzi-Puttini P., Atzeni F., Lanata L. et al. Pain and ketoprofen: what is its role in clinical practice? // Reumatismo. 2010. Vol. 62. № 3. P. 172–188.
9. Zeidler H., Kaltwasser J.P., Leonard J.P. et al. Prescription and tolerability of meloxicam in day-to-day practice: postmarketing observational cohort study of 13,307 patients in Germany // J. Clin. Rheumatol. 2002. Vol. 8. № 6. P. 305–315.
10. Lemmel E.M., Leeb B., De Bast J. et al. Patient and physician satisfaction with aceclofenac: results of the European Observational Cohort Study (experience with aceclofenac for inflammatory pain in daily practice) // Curr. Med. Res. Opin. 2002. Vol. 18. № 3. P. 146–153.
11. Le Loet X. Safety of ketoprofen in the elderly: a prospective study on 20,000 patients // Scand. J. Rheumatol. Suppl. 1989. Vol. 83. P. 21–27.
12. Moore R.A., Moore O.A., Derry S. et al. Responder analysis for pain relief and numbers needed to treat in a meta-analysis of etoricoxib osteoarthritis trials: bridging a gap between clinical trials and clinical practice // Ann. Rheum. Dis. 2010. Vol. 69. № 2. P. 374–379.
13. Veys E. 20 years' experience with ketoprofen // Scand. J. Rheumatol. Suppl. 1991. Vol. 90. Suppl. P. 1–44.
14. Sarzi-Puttini P., Atzeni F., Lanata L. et al. Efficacy of ketoprofen vs ibuprofen and diclofenac: a systematic review of the literature and meta-analysis // Clin. Exp. Rheumatol. 2013. Vol. 31. № 5. P. 731–738.
15. Englbrecht M., Tarner I., van der Heijde D. et al. Measuring pain and efficacy of pain treatment in inflammatory arthritis: a systematic literature review // J. Rheumatol. Suppl. 2012. Vol. 90. P. 3–10.
16. Ostelo R.W., de Vet H.C. Clinically important outcomes in low back pain // Best Pract. Res. Clin. Rheumatol. 2005. Vol. 19. № 4. P. 593–607.
17. Stauffer M.E., Taylor S.D., Watson D.J. et al. Definition of nonresponse to analgesic treatment of arthritic pain: an analytical literature review of the smallest detectable difference, the minimal detectable change, and the minimal clinically important difference on the pain visual analog scale // Int. J. Inflam. 2011. Vol. 2011. ID 231926.
18. Salaffi F., Stancati A., Silvestri C. et al. Minimal clinically important changes in chronic musculoskeletal pain intensity measured on a numerical rating scale // Eur. J. Pain. 2004. Vol. 8. № 4. P. 283–291.
19. Angst F., Aeschlimann A., Stucki G. Smallest detectable and minimal clinically important differences of rehabilitation intervention with their implications for required sample sizes using WOMAC and SF-36 quality of life measurement instruments in patients with osteoarthritis of the lower extremities // Arthritis Rheum. 2001. Vol. 45. № 4. P. 384–391.
20. Butcher B.E., Carmody J.J. Sex differences in analgesic response to ibuprofen are influenced by expectancy: a randomized, crossover, balanced placebo-designed study // Eur. J. Pain. 2012. Vol. 16. № 7. P. 1005–1013.
21. Kuritzky L., Samraj G. Nonsteroidal anti-inflammatory drugs in the treatment of low back pain // J. Pain Res. 2012. Vol. 5. P. 579–590.
22. Roelofs P., Deyo R., Koes B. et al. Non-steroidal anti-inflammatory drugs for low back pain // Cochrane Database Syst. Rev. 2008. Vol. 1. CD000396.
23. Svensson O., Malmenäs M., Fajutrao L. et al. Greater reduction of knee than hip pain in osteoarthritis treated with naproxen, as evaluated by WOMAC and SF-36 // Ann. Rheum. Dis. 2006. Vol. 65. № 6. P. 781–784.
24. van Tulder M., Touray T., Furlan A.D. et al. Muscle relaxants for non-specific low back pain // Cochrane Database Syst. Rev. 2003. Vol. 2. CD004252.
25. Pareek A., Chandurkar N., Chandanwale A.S. et al. Aceclofenac-tizanidine in the treatment of acute low back pain: a double-blind, double-dummy, randomized, multicentric, comparative study against aceclofenac alone // Eur. Spine J. 2009. Vol. 18. № 12. P. 1836–1842.
Factors influencing efficacy of analgesic therapy
A.Ye. Karateyev
Nasonova Research Institute of Rheumatology’ of the Russian Academy of Medical Sciences
Contact person: Andrey Yevgenyevich Karateyev, aekarateev@rambler.ru
The results of efficacy and safety studies of ketoprofen lysine salt were analyzed to determine the influence of several clinical factors on therapeutic potential of the agent and to estimate the relationship between analgesia level and patients’ assessment of the treatment. Therapy results were independent of gender, age and previous use of non-steroidal anti-inflammatory agents. Treatment initiation with intramuscular ketoprofen lysine salt and combination of ketoprofen and myorelaxants were associated with increased efficacy of treatment.
Key words: musculo-skeletal system disorders, muscular pain, non-steroidal anti-inflammatory drugs, ketoprofen lysine salt
A.Ye. Karateyev
Nasonova Research Institute of Rheumatology’ of the Russian Academy of Medical Sciences
Contact person: Andrey Yevgenyevich Karateyev, aekarateev@rambler.ru
The results of efficacy and safety studies of ketoprofen lysine salt were analyzed to determine the influence of several clinical factors on therapeutic potential of the agent and to estimate the relationship between analgesia level and patients’ assessment of the treatment. Therapy results were independent of gender, age and previous use of non-steroidal anti-inflammatory agents. Treatment initiation with intramuscular ketoprofen lysine salt and combination of ketoprofen and myorelaxants were associated with increased efficacy of treatment.
Key words: musculo-skeletal system disorders, muscular pain, non-steroidal anti-inflammatory drugs, ketoprofen lysine salt
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Автором проведен анализ результатов исследования эффективности и безопасности кетопрофена лизиновой соли с целью определения зависимости терапевтического потенциала препарата от влияния ряда клинических факторов, а также установления связи между уровнем обезболивания и субъективной оценкой эффективности анальгетика.
Было установлено, что пол и возраст пациентов, а также неудачный опыт использования других нестероидных противовоспалительных препаратов не влиял на результат терапии. Подчеркивается, что первоначальное внутримышечное введение лизиновой соли кетопрофена, а также ее комбинация с миорелаксантами ассоциированы с более высокой эффективностью лечения.
Было установлено, что пол и возраст пациентов, а также неудачный опыт использования других нестероидных противовоспалительных препаратов не влиял на результат терапии. Подчеркивается, что первоначальное внутримышечное введение лизиновой соли кетопрофена, а также ее комбинация с миорелаксантами ассоциированы с более высокой эффективностью лечения.
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
