Физиология системы гемостаза и ее особенности при неосложненной беременности
- Аннотация
- Статья
- Ссылки



Система РАСК мозаична, то есть гемостатический потенциал в различных участках кровотока, в различных органах неодинаков. Это является нормальным состоянием функциональной системы РАСК. Одна из основных особенностей системы РАСК – взаимодействие коагуляционных протеинов с поверхностями мембран и с ионами металлов. Велика роль фосфолипидов, в первую очередь фосфатидилсерина.
Вторая особенность – быстродействие системы с привлечением механизмов положительной и отрицательной обратной связи. Высокая быстрота ответа и скорость реакций осуществляются за счет базального уровня циркулирующих коагуляционных энзимов.
Третьей особенностью является ограниченность ответной реакции в отношения локализации и длительности воздействия, что имеет большое значение.
Четвертая особенность заключается в высокой интегрированности системы РАСК с другими защитными системами крови, в том числе с системой комплемента и системой цитокинов (интерлейкин 1-β, фактор некроза опухолей-α) (2).
Схематично система гемостаза представлена следующими компонентами:
- сосудистым комплексом (в первую очередь эндотелием) и тромбоцитарным звеном;
- звеном прокоагулянтов;
- фибринолитическим звеном;
- звеном ингибиторов свертывания крови.
Наиболее важное значение среди элементов сосудистой стенки имеет эндотелий. Антитромботическая активность эндотелия обусловлена синтезом простациклина (РGI2) – мощного ингибитора агрегации тромбоцитов, оксида азота (NО), тканевого активатора плазминогена (t-РА), антитромбина III (АТ III), ингибитора внешнего пути свертывания крови (ТFPI), тромбомодулина.
По данным З.С. Баркагана (3), помимо этих функций эндотелия имеется еще ряд особенностей: неспособность к контактной активации системы свертывания крови; создание антикоагулянтного потенциала на границе кровь/ткань путем фиксации на эндотелии комплекса гепарин-антитромбин III, способность удалять из кровотока активированные факторы свертывания.
Участие тромбоцитов в гемостазе определяется их способностью к адгезии у места повреждения эндотелия, процессом их агрегации и образования первичной тромбоцитарной пробки, их способностью поддерживать спазм сосудов путем секреции вазоактивных веществ – адреналина, норадреналина, серотонина, АДФ и др., а также образовывать, накапливать и секретировать вещества, стимулирующие адгезию и агрегацию.
Адгезия (прилипание) тромбоцитов к участку повреждения сосудистой стенки – процесс обратимый. Агрегация тромбоцитов протекает одновременно с адгезией.
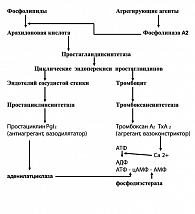
В значительной степени механизм агрегации тромбоцитов стал понятен после открытия простагландинов в тромбоцитах и сосудистой стенке. Выяснилось, что различные агрегирующие агенты активируют фосфолипазу А2, которая вызывает отщепление фосфолипидов от арахидоновой кислоты – мощного агрегирующего вещества (рисунок 1). Под влиянием простагландинсинтетазы образуются циклические эндоперикиси простагландинов I2 и Н2, стимулирующие сокращение микрофибрилл тромбоцитов и оказывающие агрегирующее действие. Под влиянием тромбоксансинтетазы в тромбоцитах синтезируется тромбоксан А2. Последний способствует транспорту Са2+ в тромбоците, что приводит к образованию АДФ – основного эндогенного стимулятора агрегации. Уровень Са2+, а также уровень цАМФ – универсального биологического переносчика – регулируется аденилатциклазой, катализирующей реакцию АТФ – цАМФ.
В эндотелии под влиянием простагландинсинтетазы арахидоновая кислота превращается в эндоперекиси простагландинов (аналогично этим процессам в тромбоцитах). Далее под влиянием простациклинсинтетазы образуется простациклин (простагландин I2), который обладает мощным дезагрегирующим действием и, кроме того, активизирует аденилатциклазу (4).
Таким образом, формируется т.н. тромбоксан-простациклиновый баланс – один из основных регуляторов состояния тонуса сосудистой стенки и агрегации тромбоцитов.
По функциональным и структурным свойствам факторы свертывания крови можно подразделить на:
1. Сывороточные энзимы:
- витамин К-зависимые: II, VII, IХ, Х;
- факторы системы контакта: ХI, ХII, прекалликреин;
2. Трансамидазы: ХIII.
3. Система кофакторов свертывания:
- плазменные: V, VIII, высокомолекулярный кининоген (ВМК), фибриноген;
- тканевые: т.н. тканевой фактор (ТФ).
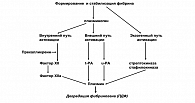
Условно различают внешний и внутренний механизмы активации свертывания крови (рисунок 2).
Процесс свертывания крови можно условно разделить на 3 стадии:
Комплекс последовательных реакций, приводящий к образованию протромбиназы, или протромбинактиваторного комплекса, в состав которого входят: фактор Ха, III фактор тромбоцитов (фосфолипид), Vа и VIIIа факторы и ионы Са2+. Это наиболее сложная и длительная фаза.
Под влиянием протромбиназы происходит переход протромбина в тромбин.
Под влиянием тромбина фибриноген переходит в фибрин. Затем наступает стабилизация фибрина.
Основным компонентом внешнего пути свертывания является тканевой фактор (ТФ). ТФ является протеином внутренней мембраны, синтезируется макрофагами и эндотелиальными клетками. Синтез ТФ индуцируют эндотоксины и ряд цитокинов. Важное значение в активации ТФ придается фосфолипидам, в первую очередь, фосфотидилсерину. ТФ выполняет функцию кофактора VII фактора свертывания крови. Активированный VIIа фактор, в свою очередь, переводит в деятельное состояние фактор Х. Внешний путь свертывания крови осуществляется значительно быстрее, чем внутренний, в связи с чем, его можно рассматривать в качестве «скоропомощного» варианта коагуляции (5).
Внутренний путь свертывания крови начинается с активации ХII фактора.
ХIа фактор превращает IХ фактор в IХа в присутствии ионов Са2+. Активация Х фактора катализируется Са2+-зависимым мембранным комплексом, состоящим из факторов IХа, Vа и VIIIа (внутренний путь) и/или факторов VIIа и ТФ (внешний путь).
Vа и VIIIа факторы являются коферментами активации ХI фактора.
После образования протромбинактиваторного комплекса начинается второй этап гемокоагуляции – переход протромбина (II фактора) в свою активную форму – тромбин. Интересно отметить, что протромбин, помимо коагулянтной функции, участвует в дифференцировке нервных клеток. Переход протромбина в тромбин происходит в 2 этапа: образование мезотромбина и образование фрагментов F1+2 протромбина. Последний используется для диагностики гиперкоагуляционных состояний. Тромбин является конечным продуктом второй стадии гемокоагуляции, кроме того, вызывает активацию кофакторов и тромбоцитов. Тромбин принимает активное участие в репаративных процессах поврежденных тканей.
Образование фибрина и его стабилизация представляют собой третий, финальный, этап формирования тромба. Этот процесс включает 3 фазы:
- отщепление от фибриногена (фактор I) фибринопептидов под влиянием тромбина;
- полимеризация фибрина;
- стабилизация фибрина под влиянием ХIIIа фактора (фибринстабилизирующий фактор).
В первой фазе под влиянием тромбина происходит расщепление фибриногена на фибринопептиды А и В. В дальнейшем образуются растворимые комплексы мономеров фибрина (РКМФ). Эти субстанции используются на практике в качестве теста, определяющего степень активности фибринообразования. Параллельно происходит полимеризация фибрина и далее – стабилизация фибрина с участием ХIIIа фактора. Важно отметить, что ХIII фактор играет большую роль в качестве матрикса, обеспечивающего рост и пролиферацию трофобласта и плаценты.
Фибринолитическая система является неотъемлемой частью системы гемостаза ибо всегда сопутствует свертыванию крови и даже активируется теми же факторами, что и процесс гемокоагуляции.
В процесс фибринолиза принимают участие элементы плазмы, тромбоциты и другие клетки. Основным ферментом, разрушающим фибрин, является плазмин, который в процессе активации образуется из неактивного плазминогена (рисунок 3). Процесс активации плазминогена включает
3 пути:
- внутренний;
- внешний;
- экзогенный.
Основным является внешний путь, однако и внутренний, и экзогенный пути играют важную роль. На внутренний путь фибринолиза приходится около 15% всей фибринолитической активности. Активация плазминогена по внутреннему пути происходит при участии ХII фактора, прекалликреина, высокомолекулярного кининогена (ВМК) и ХI фактора.
Внешний путь активации плазминогена происходит при участии двух основных активаторов: тканевого (t-РА) и урокиназного (u-РА) типов.
Экзогенный путь активации фибринолиза ассоциируется с бактериальными белками, в частности стрептокиназой и стафилокиназой. На первом этапе фибринолиза происходит отцепление Х-фрагмента, который затем расщепляется на Y- и D-фрагменты. Х- и Y-фрагменты получили название «ранних», или высокомолекулярных, продуктов деградации фибрина и фибриногена (ПДФ). Y-фрагмент в дальнейшем разрушается на Е-фрагмент и еще один D-фрагмент. D- и Е-фрагменты являются «поздними», или низкомолекулярными, ПДФ (рисунок 4). В результате полной деградации фибринового сгустка образуются D-димеры (D-D).
ПДФ обладают выраженным антикоагулянтным действием. Они не только блокируют фибрин, но и препятствуют образованию протромбина и полимеризации фибрин-мономеров, снижают или подавляют адгезивную и агрегационную функцию тромбоцитов. Определение характера и содержания ПДФ имеет значение в оценке форм синдрома ДВС, поскольку определяет масштабы внутрисосудистого свертывания. Важно отметить, что ПДФ значительно подавляют сократительную активность матки (1).
Естественные антикоагулянты можно разделить на первичные и вторичные. Первичные находятся в плазме и форменных элементах крови и действуют независимо от того, происходит образование или растворение кровяного сгустка. Вторичные антикоагулянты возникают в процессе свертывания крови и фибринолиза благодаря протеолитическому действию фермента на субстрат.
Антитромбин III (АТ III) является основным физиологическим ингибитором коагуляционных факторов, способен блокировать протромбиназу как по внешнему, так и по внутреннему механизму, включая факторы ХIIа, ХIа, VIIIа, IХа, Ха, тромбин и калликреин. АТ III синтезируется в печени и эндотелии микроциркуляторного русла. Гепарин повышает степень ингибиции АТ III-факторов свертывания в несколько тысяч раз. Помимо АТ III, ингибирующими свойствами по отношению исключительно к тромбину обладает кофактор гепарина II (НС II).
Мощным физиологическим антикоагулянтом является ингибитор внешнего пути свертывания (ТFPI), или липопротеин-ассоциированный ингибитор коагуляции (LACI). ТFPI в основном синтезируется в эндотелии микроваскулярного русла, в меньшей степени мегакариоцитами и фибробластами. ТFPI является кофактором низкомолекулярного гепарина (НМГ). НМГ способен повышать уровень ТFPI в крови на 500%. ТFPI является важнейшим ингибитором комплекса VIIа – тканевой фактор (VIIа – ТФ). Кроме того, ТFРI ингибирует Ха-фактор и в меньшей степени – IХа–фактор.
Другими ингибиторами гемокоагуляции являются С1-ингибитор эстеразы, α2-макроглобулин, α1-антитрипсин.
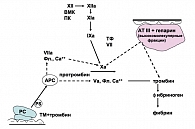
Протеин С (РС) синтезируется в печени совместно с протеином S (РS) и тромбомодулином (ТМ), является важным регулятором коагуляционного каскада, функционирующего по принципу отрицательной обратной связи (рисунок 5).
Для осуществления антикоагулянтной функции РС необходима его активация, приводящая к образованию активированного протеина С (АРС). Этот процесс осуществляется с участием Ха-фактора, тромбина, тромбомодулина (ТМ). Основное значение АРС заключается в инактивации V, Vа и VIIа факторов, что препятствует генерации протромбинактиваторного комплекса. Эти реакции усиливаются в присутствии ионов Са2+, анионных мембран и протеина S (РS) (6).
АРС также усиливает фибринолиз, что связано с его способностью нейтрализовать ингибитор активатора плазминогена (РАI-1). Противовоспалительное действие АРС связано с ингибированием продукции провоспалительных цитокинов, АРС ингибируется РАI-1, α1-антиплазмином, α2-макроглобулином.
Тромбомодулин (ТМ) локализуется на поверхности эндотелия, выполняет антикоагулянтную функцию и обеспечивает тромборезистентность сосудистой стенки. ТМ позитивно влияет на процессы внутриутробного развития плода. В процессе деградации ТМ в кровотоке появляется растворимый ТМ, расцениваемый как маркер повреждения эндотелия и ранний доклинический признак преэклампсии.
Помимо первичных естественных антикоагулянтов в процессе свертывания крови образуются вторичные антикоагулянты. К ним относятся ПДФ, «отработанные», т.е. прошедшие фазы активации, факторы свертывания крови.
Патологические антикоагулянты отсутствуют в крови в нормальных условиях, но появляются при различных иммунных нарушениях. К ним относятся антитела к факторам свертывания крови, чаще всего к факторам VIII и V (нередко возникающие после родов и массивных гемотрансфузий), и иммунные комплексы – волчаночный антикоагулянт.
Таким образом, система регуляции агрегатного состояния крови (РАСК) подчинена законам положительной и отрицательной обратной связи, когда практически каждый компонент этой системы, выполнив свою первоначальную функцию, переходит в состояние, обеспечивающее противоположные эффекты. В то же время, по мнению Б. И. Кузника (7), эта система «настроена таким образом, чтобы обеспечить свертывание крови, ибо нет такого состояния, при котором организму было бы необходимо кровотечение».
В настоящее время доминирует точка зрения, согласно которой в организме беременной женщины создаются определенные условия для развития синдрома диссеминированного внутрисосудистого свертывания. Это выражается в повышении общего коагулянтного потенциала (суммарная активность факторов свертывания), повышении функциональной активности тромбоцитов при некотором снижении их количества, в снижении фибринолитической активности при увеличении ПДФ, снижении активности АТ III при некотором уменьшении его содержания. Эти особенности носят компенсаторно-приспособительный характер и необходимы как для нормального формирования фето-плацентарного комплекса, так и для ограничения кровопотери в родах.
В активации системы гемостаза большую роль играют изменения общей гемодинамики в организме беременной женщины. Для нормального функционирования фето-плацентарной системы в условиях высокого коагуляционного потенциала крови вступают в действие компенсаторно-приспособительные механизмы: увеличение количества терминальных ворсин малого калибра с гиперплазией и периферическим расположением капилляров, уменьшение толщины плацентарного барьера с истончением синцития, образование синцитиокапиллярных мембран, синцитиальных узелков.
Особенности функционирования системы гемостаза связаны с определенными изменениями в системе спиральных артерий матки, это инвазия клеток трофобласта в стенку спиральных артерий, замещение внутренней эластичной мембраны и внутренней медии толстым слоем фибрина, нарушение целостности эндотелия и обнажение коллагеновых субэндотелиальных структур. В этом процессе имеет значение и развертывание межворсинчатого пространства с присущими ему морфологическими и гемодинамическими особенностями (8).
При физиологически протекающей беременности изменения в системе гемостаза идут пропорционально сроку гестации. Эти изменения являются физиологической адаптацией и имеют 2 основные функции – поддержание нормального функционирования фето-плацентарного комплекса и остановка кровотечения из плацентарной площадки после отделения плаценты.
Уровень тромбоцитов при неосложненном течении беременности остается практически неизмененным. При беременности наблюдается возрастание всех факторов свертывания, за исключением факторов ХI и ХIII. Увеличение уровня фибриногена начинается с 3-го месяца беременности. Важно отметить, что содержание фибриногена в периферической крови выше, чем в маточно-плацентарном кровотоке.
Коагуляционный потенциал крови возрастает также в связи с тем, что снижается уровень антитромбина III. Протеин С повышается в основном в послеродовом периоде, а протеин S снижен при беременности и значительно снижен после родов.
Отмечено снижение фибринолиза в конце беременности и в процессе родов, происходит повышение концентрации РКМФ с 8 недель беременности параллельно с повышением содержания фибриногена. Уровень некоторых фрагментов продуктов деградации фибрина повышается с 16 недель беременности и достигает плато в 36–40 недель.
Уровень плазминогена повышается во время беременности. Тканевой активатор плазминогена (t-РА) нейтрализуется ингибиторами активации плазминогена. При беременности ведущее значение имеет плацентарный тип ингибитора (РАI-2), уровень которого увеличивается к концу беременности в 25 раз. Концентрация эндотелиального ингибитора (РАI-1) увеличивается с 25 недель беременности. Полагают, что РАI-2 играет роль в процессах инвазии, а также имеет функцию защиты от преждевременной отслойки плаценты (9).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.