Клинико-анамнестические факторы риска гестационного уросепсиса
- Аннотация
- Статья
- Ссылки
- English
Цель – определить клинико-анамнестические факторы риска гестационного уросепсиса.
Материал и методы. Проведен сравнительный анализ клинико-анамнестических характеристик беременных трех исследуемых групп. Первую группу составили 24 женщины с подтвержденным гестационным уросепсисом, вторую – 20 беременных с острым пиелонефритом без признаков системной инфекции, третью – 80 беременных без инфекций мочевых путей.
Результаты. На основании проведенного сравнительного анализа установлено, что у беременных с гестационным уросепсисом и острым пиелонефритом значительно выше распространенность врожденных аномалий мочеполовой системы. Кроме того, у пациенток с осложненными формами инфекций мочевых путей выявлены повышенные показатели заболеваемости мочекаменной болезнью, хроническим пиелонефритом, циститом, а также сопутствующими воспалительными заболеваниями органов малого таза и хроническим воспалением верхних дыхательных путей. Полученные данные подчеркивают необходимость комплексного диагностического подхода к выявлению и коррекции соматических и урогенитальных заболеваний у беременных для профилактики осложнений и улучшения перинатальных исходов.
Цель – определить клинико-анамнестические факторы риска гестационного уросепсиса.
Материал и методы. Проведен сравнительный анализ клинико-анамнестических характеристик беременных трех исследуемых групп. Первую группу составили 24 женщины с подтвержденным гестационным уросепсисом, вторую – 20 беременных с острым пиелонефритом без признаков системной инфекции, третью – 80 беременных без инфекций мочевых путей.
Результаты. На основании проведенного сравнительного анализа установлено, что у беременных с гестационным уросепсисом и острым пиелонефритом значительно выше распространенность врожденных аномалий мочеполовой системы. Кроме того, у пациенток с осложненными формами инфекций мочевых путей выявлены повышенные показатели заболеваемости мочекаменной болезнью, хроническим пиелонефритом, циститом, а также сопутствующими воспалительными заболеваниями органов малого таза и хроническим воспалением верхних дыхательных путей. Полученные данные подчеркивают необходимость комплексного диагностического подхода к выявлению и коррекции соматических и урогенитальных заболеваний у беременных для профилактики осложнений и улучшения перинатальных исходов.


Введение
Акушерский сепсис остается одной из ведущих причин материнской и перинатальной заболеваемости и смертности [1, 2]. Несмотря на это, большинство исследователей рассматривают сепсис у беременных с обобщенных позиций, не выделяя отдельные этиологические факторы и источники инфекции. Недостаточно внимания уделяется анализу конкретных локализаций первичного инфекционного очага, в частности инфекциям мочевыводящих путей (ИМП). Аналогичная тенденция прослеживается и в отношении факторов риска сепсиса, которые нередко рассматриваются без учета локализации первичного процесса [3, 4].
Гестационный уросепсис – тяжелое инфекционно-воспалительное осложнение, возникающее вследствие инфицирования мочевыводящей системы и сопровождающееся системной воспалительной реакцией, увеличением риска развития полиорганной недостаточности и летального исхода как для матери, так и для плода [5].
Следует отметить, что в Международной классификации болезней 10-го пересмотра термин «уросепсис» отсутствует как самостоятельная нозологическая единица. В клинической практике случаи гестационного уросепсиса чаще всего кодируются как острый пиелонефрит при беременности (О23.0–О23.9), сепсис, связанный с беременностью (О85), либо как другие инфекции мочевыводящих путей (N39.0). Это затрудняет систематизацию и диагностику данного состояния, особенно в условиях акушерских стационаров, где сепсис урологической природы может быть расценен как гнойно-воспалительное осложнение без точного указания источника.
К факторам риска развития гестационного уросепсиса относят хронические ИМП в анамнезе (пиелонефрит, цистит), аномалии развития мочевой системы, мочекаменную болезнь, анемию, избыточную массу тела – индекс массы тела (ИМТ) > 25 кг/м2 – и др. Тем не менее их роль в развитии гестационного уросепсиса не до конца изучена [6].
Таким образом, выявление и систематизация факторов риска развития гестационного уросепсиса у беременных с заболеваниями мочевых путей крайне важны для разработки эффективных профилактических мероприятий, своевременной диагностики и раннего начала терапии, что в конечном итоге способствует снижению материнской и перинатальной смертности.
Материал и методы
Ретроспективное исследование с участием 124 беременных выполнено на базе кафедры акушерства и гинекологии с курсом перинатологии ФГАОУ ВО «Российский университет дружбы народов им. Патриса Лумумбы» – ГБУЗ «ГКБ им. А.К. Ерамишанцева» ДЗМ в 2020–2024 гг. Пациентки были разделены на три группы. Первую группу составили 24 женщины с подтвержденным гестационным уросепсисом, вторую – 20 беременных с острым пиелонефритом без признаков системной инфекции, третью – 80 беременных без ИМП.
Статистическую обработку данных осуществляли в программной среде IBM SPSS v. 26.0, StatTech v. 4.8.5 (разработчик – ООО «Статтех», Россия). Количественные показатели оценивали на соответствие нормальному распределению с помощью критерия Колмогорова – Смирнова. При нормальном распределении количественные данные представлены в виде среднего (М) и стандартного отклонения (SD), в отсутствие нормального распределения – в виде медианы (Me) и межквартильного размаха (Q1–Q3). Категориальные данные описаны с указанием абсолютных значений и процентных долей. Процентные доли при анализе многопольных таблиц сопряженности сравнивали исходя из критерия хи-квадрат Пирсона. Апостериорные сравнения выполняли с помощью критерия хи-квадрат Пирсона с поправкой Холма.
При сравнении количественного показателя, распределение которого отличалось от нормального, использовали критерий Краскела – Уоллиса. В качестве количественной меры эффекта при сравнении относительных показателей рассчитывали отношение шансов (ОШ) с 95%-ным доверительным интервалом (ДИ). Различия считали статистически значимыми при p < 0,05.
Результаты
Все исследуемые были сопоставимы по возрасту, медиана которого в первой группе составила 26,0 [23,8; 29,8] года, во второй – 27,0 [22,3; 31,8], в третьей – 29,0 [25,5; 33,0] года (p = 0,084). ИМТ до беременности также не различался – 21,0 [20,6; 25,1], 21,5 [20,0; 23,4] и 20,9 [15,9; 23,7] кг/м2 в первой, второй и третьей группе соответственно (p = 0,569).
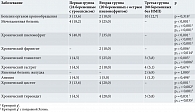
При анализе экстрагенитальной заболеваемости (табл. 1) выявлены статистически значимые различия между группами по некоторым нозологиям. Так, мочекаменная болезнь диагностирована у каждой пятой (18,2%) пациентки первой группы и каждой четвертой (25%) – второй группы. У пациенток третьей группы заболевание не выявлено (p < 0,001). Хронический пиелонефрит встречался почти у каждой второй (40,9%) пациентки первой группы и каждой третьей (35,0%) – второй группы. У женщин третьей группы данное заболевание отсутствовало (p < 0,001). Хронический цистит диагностирован у каждой седьмой (13,6%) беременной первой группы, у каждой пятой (20,0%) – второй группы. В третьей группе хронический цистит не встречался (p = 0,002 и p < 0,001 соответственно).
Хронический фарингит и хронический тонзиллит достоверно чаще обнаруживались во второй группе: у каждой десятой (10,0%) и каждой четвертой (25,0%) пациентки соответственно по сравнению с женщинами третьей группы (0 и 3,8%; p = 0,014 и p = 0,006). Хронический тиреоидит также чаще отмечался во второй группе – в каждом пятом (20,0%) случае, что значимо превышало аналогичный показатель в третьей группе (3,8%; p = 0,035).
По частоте встречаемости болезней органов кровообращения, хронического гастрита, язвенной болезни желудка и анемии статистически значимых различий между группами не установлено (p > 0,05).
Врожденные аномалии мочевой системы (табл. 2) диагностированы у каждой пятой (18,2%) пациентки первой группы и каждой десятой (10,0%) – второй группы, тогда как в третьей группе подобные отклонения отсутствовали (p < 0,001 и p = 0,009 соответственно). Из особенностей анатомического строения мочевой системы у беременных первой группы зафиксировано неполное удвоение левой почки (9,1%), которое не наблюдалось у женщин других групп (p = 0,010). Подковообразная почка выявлена у каждой десятой (10,0%) пациентки второй группы. В первой и третьей группах данная особенность развития мочевой системы не зарегистрирована (p = 0,006).
При изучении гинекологического анамнеза (табл. 3) установлены статистически значимые различия между группами по нескольким показателям. Внематочная беременность в анамнезе отмечалась у 9,1% пациенток первой группы, у пациенток второй и третьей групп она отсутствовала (р = 0,010). Бактериальный вагиноз во время беременности имел место у каждой десятой (10,0%) беременной второй группы – статистически значимо чаще, чем в первой и третьей группах (p = 0,014). Аналогичная картина наблюдалась в отношении гиперплазии эндометрия: патология отмечалась у 10,0% пациенток второй группы (p = 0,006). Хронический сальпингит и оофорит чаще диагностировались у женщин второй группы – 10,0%, реже у пациенток первой группы – 4,5%, не встречались у беременных третьей группы (p = 0,029).
По частоте встречаемости других гинекологических заболеваний и осложнений предыдущих беременностей (самопроизвольный выкидыш, неразвивающаяся беременность) статистически значимых различий между группами не выявлено (p > 0,05).
При расчете ОШ с 95%-ным ДИ установлено, что увеличение риска развития гестационного уросепсиса ассоциируется с такими факторами, как:
- мочекаменная болезнь – в 4,178 раза (95% ДИ 1,022–17,081);
- хронический пиелонефрит – в 9,099 раза (95% ДИ 2,893–28,616);
- врожденные аномалии мочевой системы – в 10,778 раза (95% ДИ 1,835–63,296).
Обсуждение
Полученные данные свидетельствуют о наличии достоверных ассоциаций между развитием гестационного уросепсиса и рядом клинико-анамнестических характеристик, включая заболевания и инфекции мочевых путей в анамнезе, врожденные аномалии мочевых путей, сопутствующую гинекологическую патологию. Отсутствие межгрупповых различий по основным показателям (возраст, ИМТ до беременности) свидетельствует о сопоставимости групп и позволяет исключить влияние этих факторов на интерпретируемые различия.
Наши результаты подтверждают важную роль предшествующей патологии мочевой системы в формировании неблагоприятных инфекционно-воспалительных осложнений беременности. Установлено, что мочекаменная болезнь повышает риск развития гестационного уросепсиса в 4,2 раза, а хронический пиелонефрит – почти в девять раз. Эти данные соотносятся с результатами исследований последних лет, согласно которым наличие структурных или воспалительных изменений мочевой системы у беременных значительно увеличивает вероятность возникновения восходящей инфекции и септических осложнений [7]. Особое внимание следует уделять врожденным аномалиям мочевых путей, которые, как показано в нашем исследовании, ассоциированы с наибольшим риском инфицирования и развития уросептических осложнений. Так, врожденные аномалии мочевой системы, например неполное удвоение почки и подковообразная почка, повышают риск возникновения гестационного уросепсиса. Таким образом, крайне важен прегравидарный скрининг женщин с аномалиями мочевой системы, на что указано в ряде современных исследований [7, 8]. Ранее сообщалось, что удвоение мочеточника и лоханки может приводить к застою мочи и формированию хронической инфекции, особенно во время беременности на фоне физиологических изменений уродинамики [7, 9]. Различия в частоте возникновения бактериального вагиноза, хронического сальпингита и оофорита у беременных с острым пиелонефритом подтверждают гипотезу о потенциальном влиянии микробиоты влагалища и хронических воспалительных процессов в женских половых органах на развитие восходящей урогенитальной инфекции. Это соответствует современным данным о роли влагалищного микробиома и его дисбиотических изменений в развитии инфекционно-воспалительных заболеваний мочеполовой системы [10].
Интересно, что достоверно чаще хронический тонзиллит, фарингит и тиреоидит обнаруживался у беременных с острым пиелонефритом. Возможно, это свидетельствует о наличии генерализованного воспалительного фона или аутоиммунной предрасположенности у пациенток данной группы, однако необходимы дальнейшие исследования. Ранее сообщалось о связи хронических очагов инфекции лор-органов с активацией системного иммунного ответа при беременности и возможной реактивацией латентных инфекционных процессов [11].
Следует также подчеркнуть отсутствие статистически значимых различий между группами по частоте возникновения заболеваний системы кровообращения, анемии и заболеваний желудочно-кишечного тракта, что лишний раз подтверждает релевантность сделанных выводов и исключает возможность влияния подобных состояний на риск развития уросепсиса в исследованных когортах.
Заключение
Полученные данные подчеркивают необходимость комплексного диагностического подхода к выявлению и коррекции соматических и урогенитальных заболеваний у беременных. Выявление беременных с высоким риском позволит своевременно реализовать профилактические мероприятия, направленные на предупреждение тяжелых инфекционных осложнений, в том числе уросепсиса.
S.V. Apresyan, PhD, Prof., L.B. Tamazova, Z.V. Zyukina, A.O. Lugovoy, PhD, M.T. Khubetsova
Peoples' Friendship University of Russia
City Clinical Hospital named after A.K. Eramishantsev, Moscow
Contact person: Lyana B. Tamazova, l_kushkhatueva@mail.ru
Background. In modern obstetrics, sepsis remains a significant cause of maternal and perinatal morbidity. At the same time, current scientific works are dominated by a generalized approach to the study of sepsis in pregnant women, which does not take into account the diversity of infection sources and etiological factors.
Aim is to identify clinical and anamnestic risk factors for gestational urosepsis.
Material and methods. A comparative analysis of the clinical and anamnestic characteristics of pregnant women in three study groups was conducted. The first group consisted of 24 women with confirmed gestational urosepsis, the second – 20 pregnant women with acute pyelonephritis without signs of systemic infection, the third – 80 pregnant women without urinary tract infections.
Results. Based on the comparative analysis, it was found that the prevalence of congenital anomalies of the genitourinary system is significantly higher in pregnant women with gestational urosepsis and acute pyelonephritis. In addition, in patients with complicated forms of urinary tract infections, increased incidence rates of urolithiasis, chronic pyelonephritis, cystitis, as well as concomitant inflammatory diseases of the pelvic organs and chronic inflammatory processes of the upper respiratory tract were revealed. The data obtained highlight the need for a comprehensive diagnostic approach to identifying and correcting somatic and urogenital diseases in pregnant women to prevent complications and improve perinatal outcomes.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.