Гестационный сахарный диабет
- Аннотация
- Статья
- Ссылки
- English

История вопроса
История изучения гестационного сахарного диабета (ГСД) началась 95 лет назад. Именно тогда H.G. Bennewitz впервые описал ассоциированную с беременностью гипергликемию, а в 1923 г. была опубликована его работа «De Diabete Mellito Graviditatis Symptomate» [1]. В 1949 г. P. White разработала классификацию нарушений углеводного обмена во время беременности, в которой учитывалось время начала заболевания, его продолжительность и наличие сосудистых осложнений [2].
Первое проспективное исследование углеводного обмена у беременных проведено в 1954 г. С этого времени стали использовать тест с 50 г глюкозы и определять гликемию венозной крови через час после углеводной нагрузки [3, 4].
J.B. O’Sullivan впервые применил термин ГСД, под которым подразумевалось повышение гликемии у беременных [5].
В 1980 г. эксперты Всемирной организации здравоохранения (World Health Organization – WHO) ввели понятие «диабет беременной женщины». ГСД был выделен в отдельный тип заболевания [6]. Под ГСД стали понимать повышение гликемии, впервые выявленное во время беременности [7].
В 1992 г. M.B. Landon и S.G. Gabbe предложили другую классификацию ГСД. Данная классификация позволяла выявлять легкие нарушения углеводного обмена во время беременности без использования количественных критериев гликемии [8, 9].
В 1994 г. эксперты WHO ввели термин «гестационные нарушения толерантности к глюкозе», а в 1999 г. пересмотрели классификацию СД и, приняв во внимание рекомендации Американской диабетической ассоциации (American Diabetes Association – ADA), разграничили ГСД и СД у беременных [10].
В 1997 г. Экспертный комитет по диагностике и классификации сахарного диабета США (Expert Committee Diagnosis Classification Diabetes Mellitus – ECDCDM) опубликовал сообщение о негативном влиянии ГСД в перинатальный период, а также о существенном повышении риска развития сахарного диабета у перенесших ГСД [11].
В настоящее время большое внимание уделяется генетическому анализу, патологии секреции энтероинсулярных гормонов (глюкагона, глюкозозависимого инсулинотропного полипептида), вероятности манифестации моногенной формы диабета (Maturity-Onset Diabetes Young – MODY) в период беременности.
Определение и эпидемиология
Гестационный сахарный диабет – заболевание, характеризующееся гипергликемией, впервые выявленной во время беременности, но не соответствующей критериям манифестного сахарного диабета [12]. Частота его встречаемости неуклонно увеличивается во всех странах, что может быть связано с более тщательным обследованием беременных, увеличением распространенности ожирения, возраста беременных.
Согласно данным литературы, за последние 20 лет встречаемость ГСД во всех странах увеличилась с 2–4 до 7–22%. Если рассматривать общее число беременных с СД, то 90% случаев приходится именно на ГСД [13–16].
После родоразрешения у большинства пациенток толерантность к глюкозе нормализуется. Однако при обследовании в отдаленные сроки (спустя 10–12 лет) у 40–60% женщин развивается СД, преимущественно 2 типа [17]. Согласно результатам исследований, проведенных в 2012 г., в послеродовом периоде у женщин с ГСД сохраняются изменения секреции инсулина и пониженная чувствительность к нему, что более типично для СД 2 типа [18].
Беременность и диабет
Беременность сама по себе является диабетогенным фактором. При ее наступлении существенно изменяются обменные процессы. Увеличивается секреция гипофизом пролактина, меланоцитстимулирующего гормона. До полного формирования плаценты повышается секреция эстрогенов и прогестерона. Это обеспечивает рост и развитие эмбриона на данном этапе (первый триместр беременности, полное созревание плаценты к 16-й неделе беременности). Уровень кортизола изменяется на протяжении всего периода гестации и к его окончанию может увеличиться в три раза [19].
Плацента – это эндокринная железа с ограниченным временем жизни. Являясь связующим звеном между плодом и организмом матери, она секретирует в материнский кровоток белковые и стероидные гормоны: хорионический гонадотропин, обладающий биологическими свойствами лютеинизирующего гормона, плацентарный лактогенный гормон, сходный по ряду биологических свойств с пролактином гипофиза и гормоном роста, эстрогены, прогестерон, кортикостероиды. Активность синтеза и секреции большинства гормонов плаценты со временем усиливается и достигает максимума в третьем триместре. Эти гормоны обладают контринсулярным эффектом – снижают чувствительность периферических тканей к эндогенному инсулину. Во второй половине беременности связывание инсулина с рецепторами и его супрессивное действие на глюконеогенез снижаются. Как следствие, повышается постпрандиальная гликемия. Дополнительным фактором, объясняющим данный процесс, является более быстрое достижение пика всасывания углеводов на фоне увеличившегося времени всасывания вследствие снижения сократительной (двигательной) активности желудочно-кишечного тракта. При физиологически нормальном углеводном обмене нарастающая инсулинорезистентность компенсируется повышением секреции инсулина – в два-три раза за счет первой и второй фаз. В период гестации отмечается компенсаторное физиологическое увеличение (в среднем на 10–15%) массы бета-клеток. При беременности ухудшается связывание инсулина адипоцитами, но не связывание инсулина миоцитами. На 37–38-й неделе беременности снижается выработка плацентарных гормонов, что может приводить к развитию гипогликемических состояний. В этот период отмечается увеличение глюконеогенеза и снижение усвоения глюкозы. При нарушении механизмов регуляции гликемии возрастает поступление глюкозы к плоду, что вызывает гиперинсулинемию и гиперплазию бета-клеток. Эти процессы приводят к макросомии.
При беременности компенсаторно-регуляторным механизмом для снижения гликемии можно считать уменьшение почечного порога для глюкозы.
Кроме того, плацента является основным органом, через который плод получает питательные вещества: глюкозу, аминокислоты, липиды (холестерин (ХС), свободные жирные кислоты (СЖК)). Проникновение глюкозы через плацентарный барьер происходит путем ускоренной диффузии (в зависимости от градиента концентрации). Плод утилизирует глюкозу в два-три раза быстрее, чем взрослый человек. У женщин начиная с ранних сроков беременности гликемия снижается на 0,5–1,0 ммоль/л и составляет 3,8–4,2 ммоль/л [20]. Таким образом, в норме среднесуточный уровень глюкозы в крови физиологически здоровой беременной ниже, чем у небеременной. Путем диффузии через плаценту также попадают кетоновые тела, аминокислоты имеют активный транспортный механизм. Инсулин не проникает через плацентарный барьер. В плаценте происходит его усиленный распад [21].
Инсулинорезистентность приводит к избыточной массе тела/ожирению у матери, что в свою очередь усугубляет компенсаторную гиперинсулинемию. Необходимо отметить, что изменение чувствительности к инсулину до беременности может наблюдаться и у женщин с нормальной или пониженной массой тела. При прогрессировании беременности и развитии ГСД чувствительность к инсулину будет снижаться еще больше [18]. Исследование соотношения «инсулиночувствительность/инсулиносекреция» у пациенток с ГСД показало, что только у 20–30% из них бета-клетки функционируют нормально. При увеличении инсулинорезистентности и уменьшении секреции инсулина в плазме крови повышается концентрация глюкозы, СЖК, некоторых аминокислот и кетонов [22].
Увеличение уровня СЖК может привести к развитию печеночной инсулинорезистентности у матери. У детей, рожденных от матерей с высоким уровнем СЖК и триглицеридов, отмечается большая масса тела и толщина кожной складки, а также величина сывороточных СЖК [23]. Уровень СЖК и триглицеридов в третьем триместре беременности имеет положительную корреляцию как с индексом массы тела (ИМТ) матери, так и с массой плода [24]. В норме уровень сывороточного ХС и триглицеридов снижается в первом триместре беременности (к седьмой неделе), затем прогрессивно повышается до родоразрешения. В дальнейшем уровень триглицеридов в сыворотке крови уменьшается. Однако в случае грудного вскармливания он остается высоким.
Гиперпролактинемия приводит к гипоэстрогении, изменениям липидного спектра, аналогичным у здоровых женщин в период менопаузы. Речь, в частности, идет об увеличении содержания общего ХС, липопротеинов низкой плотности и липопротеинов очень низкой плотности и одновременном снижении липопротеинов высокой плотности. Повышается атерогенность плазмы крови. Это ассоциируется с увеличением риска развития ишемической болезни сердца, артериальной гипертензии, ожирения и СД 2 типа [25].
Синтез белка в организме женщины изменяется на протяжении всей беременности. В первом триместре он соответствует уровню у небеременных, во втором – повышается на 15%, в третьем – на 25% [26]. У беременных без нарушений углеводного обмена показатели гликированных белков снижены относительно нижних референсных значений для общей популяции, перед родоразрешением развивается гипоаминоацидемия [27].
Кетоновые тела используются плодом как энергетический материал, субстрат для липидов мозга. В третьем триместре на фоне увеличения продукции плацентарного лактогена усиливается липолиз в адипоцитах, снижается утилизация глюкозы инсулиночувствительными тканями, стимуляция синтеза плацентой инсулиноподобного фактора роста 1. Уровень последнего коррелирует с массой плода [28].
При повышении массы жировой ткани увеличивается и секреция адипоцитокинов. Количество висфатина и лептина возрастает в каждом триместре, усугубляя инсулинорезистентность, при этом уровень адипонектина снижается. Именно адипонектин повышает чувствительность к инсулину и снижает выработку глюкозы печенью [29, 30]. Таким образом происходит усугубление и нарастание инсулинорезистентности к моменту родоразрешения.
Вследствие изменения углеводного обмена нарушается сосудисто-тромбоцитарный гемостаз, что приводит к формированию плацентарной недостаточности. С последней связывают значительные расстройства адаптации новорожденных в раннем постнатальном периоде. Инсулинорезистентность приводит к снижению активности фибринолитической системы. Это обусловлено повышением содержания в крови ингибитора тканевого активатора плазминогена 1, который усиленно вырабатывается в эндотелии, адипоцитах, печени, клетках мышечной ткани и высвобождается из тромбоцитов. В норме тканевый активатор плазминогена 1 ингибирует апоптоз и активирует плазминоген. Апоптозные клетки представляют собой фосфолипидные матрицы, необходимые для формирования протромбиназного комплекса и, следовательно, образования тромбина. Нарушение функционирования тканевого активатора плазминогена 1 приводит к тромбозам, ремоделированию сосудов и образованию атеросклеротических бляшек [31]. Это может обусловливать тяжелые формы преэклампсии у матери и тяжелый дистресс плода [32, 33]. Следовательно, степень риска гиперкоагуляции у беременных с СД зависит от степени нарушения углеводного обмена (гликированный гемоглобин (HbA1c) более 7,0%), липидного обмена (ХС более 6,5 ммоль/л) и наличия альбуминурии (30–300 мг/сут) [34].
A.G. Gader и соавт. (2011) сравнили систему гемостаза у 152 женщин с ГСД и 100 женщин с физиологической беременностью в третьем триместре. При ГСД отмечался более высокий уровень фибриногена и протеина С [35]. Кроме того, при ГСД на фоне гипергликемии в ворсинах плаценты запускается синтез аннексина А2, влияющего на фибринолиз. У женщин с ГСД аннексин А2 повышает активность плазмина и препятствует тромбообразованию путем связывания тканевого активатора плазминогена [36].
При ГСД отмечаются патологическая секреция энтероинсулярных гормонов (глюкагона, глюкозозависимого инсулинотропного полипептида, глюкагоноподобных пептидов (ГПП) 1 и 2) и нарушения энтероинсулярной гормональной системы. В первом триместре беременности на фоне ГСД фиксируется более высокая базальная и стимулированная глюкагонемия. Ухудшение метаболического контроля инициирует в альфа-клетках транскрипцию проглюкагона в ГПП-1. Этим объясняется повышение уровня ГПП-1 при ГСД. Увеличение концентрации ГПП-1 также может свидетельствовать об инкретинорезистентности, аналогичной по механизму развития компенсаторной гиперинсулинемии при инсулинорезистентности, которая наблюдается на ранних стадиях СД 2 типа [37].
У детей, рожденных от матерей с ГСД, повышен уровень эндотелина 1 и снижена генерация метаболитов оксида азота в сыворотке крови, которые прогрессируют в течение первых месяцев жизни. Нарушение продукции эндотелиальных факторов, гиперинсулинемия и повышенное содержание инсулиноподобного фактора роста 1 превалируют у пациентов со среднетяжелым перинатальным поражением центральной нервной системы и детей с сохранившейся к концу первого года жизни неврологической симптоматикой. Установленные между эндотелином 1, инсулином и инсулиноподобным фактором роста 1 корреляции подтверждают взаимообусловленность метаболических и сосудистых расстройств, способствующих развитию цереброваскулярных нарушений у детей, матери которых страдали ГСД [38]. Так, при применении инсулина для коррекции углеводного обмена при ГСД наблюдалось выраженное повышение уровня эндотелина 1 – в полтора раза. Необходимо отметить, что при выявлении диабета его концентрация напрямую зависит от состояния углеводного обмена и уровня глюкозы в крови. Однако при ГСД концентрация адгезивных молекул в сыворотке крови достоверно не повышается [39].
Поскольку плацента обеспечивает плод питательными веществами, кислородом, а также синтезирует ряд гормонов и факторов роста, ее состояние очень важно на протяжении всего периода гестации. Основными патоморфологическими изменениями плаценты являются несоответствие ворсин гестационному сроку, фиброз стромы стволовых ворсин, повышенная степень инволютивно-дистрофических изменений и компенсаторно-приспособительных реакций, массивное отложение фибриноида в межворсинчатом пространстве. Это приводит к плацентарной недостаточности. На фоне инсулинотерапии выраженность данных изменений увеличивается. При диетотерапии отмечается усиление экспрессии сосудисто-эндотелиального фактора роста и эндотелиальной синтазы оксида азота в ответ на срыв компенсаторных механизмов. Развитие макросомии связано с увеличенной продукцией инсулиноподобного фактора роста 1, что еще более выражено при инсулинотерапии. Повышение концентрации тучных клеток в плаценте не зависит от степени коррекции углеводного обмена [40]. В то же время отмечена зависимость строения плаценты от длительности, степени компенсации и осложнений ГСД. При некомпенсируемом ГСД плацента увеличена в размерах, полнокровна, морфологически определяются незрелость ворсинчатого дерева или изменение ветвления ворсин, сужение просвета сосудов в результате склеротических изменений их стенок, отложения фибрина в синцитиотрофобласте и гиперплазия цитотрофобласта. Дисрегуляция ангиогенных факторов может способствовать аномальной васкуляризации, в том числе аберрации в разветвлении и продольному росту капилляров с формированием хаотично склерозированных ворсин. У 16% беременных с ГСД наблюдаются аномалии развития пупочной артерии (нарушение оксигенации плода и гипоксия). В случае сочетания ГСД и ожирения в плаценте отмечаются выраженные воспалительные изменения. Это может быть связано с повышением уровней интерлейкина 1-бета и фактора некроза опухоли альфа, которые увеличиваются на 200 и 50% соответственно в ответ на гипергликемию. Кроме того, при макросомии в плаценте снижается транспортная аминокислотная активность, что усугубляет развитие диабетической фетопатии [23].
В регуляции развития плацентарной системы и плода участвуют материнские гормоны и факторы роста (инсулин, инсулиноподобные факторы роста 1 и 2, белки, связывающие инсулиноподобный фактор роста, соматотропный гормон). Необходимо отметить, что соматотропный гормон относится к семейству пролактинподобных белков – по структуре и биологическим свойствам он сходен с пролактином, плацентарным лактогеном и пролиферином [41]. S. Setia и M.G. Sridhar (2009) установили, что соматотропный гормон незначительно или вообще не влияет на рост плода. В то же время снижение концентрации плацентарного гормона ассоциировалось с задержкой внутриутробного развития [42]. U. Hiden и соавт. (2009) доказали связь между макросомией и повышенным уровнем белка 3, связывающего инсулиноподобный фактор роста, а также уровнем инсулиноподобного фактора роста 1 во время беременности [43].
Патологическая инсулинорезистентность развивается при генетических дефектах и дефектах белков, передающих сигналы инсулина. В первом случае речь идет о мутации генов субстрата инсулинового рецептора 1, гликогенсинтетазы, гормончувствительной липазы, во втором – о снижении концентрации и активности внутриклеточного транспортера глюкозы 4 в мышечной ткани. Ф.Ф. Бурумкулов и соавт. обнаружили у 38% беременных с ГСД специфические моноклональные антитела к глутаматдекарбоксилазе, бета-клеткам, инсулину и его рецепторам, а также человеческие лейкоцитарные антигены DR3, DR4, что характерно для лиц с генетической предрасположенностью к развитию СД 1 типа [44].
У женщин с ГСД выявлен ряд генетических особенностей, ассоциирующихся с нарушением чувствительности тканей к инсулину и его секреции клетками поджелудочной железы. Мутации в гене KCNJ11 обусловливают изменения в структуре белка Kir6.2, в результате чего не происходит секреции инсулина. При беременности выявлена достоверная связь генотипа Lys/Lys полиморфного маркера Gly23K гена KSNJ11 аллеля Pro и Ala, полиморфного маркера Pro12Ala гена PPARG2, а также аллеля полиморфного маркера A214T гена ADIPOQR2 [45, 46].
MODY встречается приблизительно у 50% женщин с ГСД. Согласно классификации WHO (1999) патология относится к другим специфическим типам СД, в частности к группе «Генетические дефекты функции бета-клеток». Для MODY характерны аутосомно-доминантный тип, первичный дефект функции бета-клеток поджелудочной железы, дебют в возрасте менее 25 лет.
В настоящее время описано 13 типов MODY, большинство из которых вызваны мутациями в показателях транскрипции. В отличие от них развитие MODY-2 связано с мутациями в гене, кодирующем глюкокиназу [47].
Глюкозурия у пациенток с ГСД может быть обусловлена MODY-3, а гипергликемия (тощаковая и относительно нормальная постпрандиальная) – MODY-2. Анализ литературы свидетельствует, что у 80% пациенток с ГСД имеет место мутация в гене, кодирующем глюкокиназу [48].
Диагностика
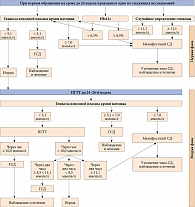
На сегодняшний день единой диагностической системы ГСД не существует. В России для диагностики применяются критерии, приведенные в клинических рекомендациях Эндокринологического научного центра 2017 г. [49]. Так, если при проведении перорального глюкозотолерантного теста (ПГТТ) глюкоза венозной плазмы крови натощак < 5,1 ммоль/л, через час при его повторном проведении < 10,0 ммоль/л, а через два часа ≥ 7,8, но < 8,5 ммоль/л, у небеременных это является признаком нарушения толерантности к глюкозе, у беременных – вариантом нормы. Алгоритм диагностики нарушений углеводного обмена во время беременности представлен на рисунке.
Согласно клиническим рекомендациям «Гестационный сахарный диабет: диагностика, лечение, послеродовое наблюдение» Министерства здравоохранения РФ (2013) наблюдение за беременной должно проводиться в две фазы.
Первая фаза – при первичном обращении к врачу (гинекологу, терапевту, врачу общей практики). На сроке до 24 недель проводится одно из следующих исследований:
- глюкозы венозной плазмы крови натощак. Данное исследование можно провести при сдаче первого биохимического анализа крови;
- гликированного гемоглобина. Используются методы, сертифицированные в соответствии с Национальной программой по стандартизации HbA1c (National Glycohemoglobin Standardization Program – NGSP) и стандартизованные в соответствии с референсными значениями, принятыми в исследовании контроля диабета и его осложнений (Diabetes Control and Complications Study – DCCT). Исследование проводится в соответствии с Алгоритмами специализированной помощи больным сахарным диабетом [12];
- глюкозы венозной плазмы крови в любое время дня вне зависимости от приема пищи.
Глюкоза венозной плазмы крови определяется после предварительного голодания (последний прием пищи не менее чем за восемь и не более чем за 14 часов). В течение трех дней до взятия анализа рацион питания не должен кардинально меняться. Беременная должна употреблять минимум 150 г углеводов в сутки, в последний перед исследованием прием пищи – от 30 до 50 г.
Во время процедуры запрещается курить, активно двигаться, рекомендуется сидеть. Как перед, так и во время проведения ПГТТ разрешается пить воду. По возможности накануне и во время тестирования необходимо исключить прием препаратов, способных повлиять на уровень глюкозы в крови. К таким препаратам относятся поливитамины и препараты железа, в состав которых входят углеводы, а также глюкокортикостероиды, бета-блокаторы, бета-адреномиметики. Необходимо напомнить, что при выраженном токсикозе показатели гликемии натощак могут быть ошибочными (нет периода голодания, рвота – обезвоживание, тошнота – нарушение питания и т.д.).
При уровне глюкозы венозной плазмы крови натощак ≥ 7,0 ммоль/л (126 мг/дл), или глюкозы венозной плазмы крови вне зависимости от времени суток и приема пищи ≥ 11,1 ммоль/л (200 мг/дл) и наличии симптомов гипергликемии, или HbA1c ≥ 6,5% (при исключении негликемических причин его увеличения) необходимо подтвердить/исключить манифестный СД и провести дифференцированную диагностику в отношении СД 1 и 2 типов, MODY.
У беременных в отсутствие нарушений углеводного обмена уровень HbA1c, так же как уровень глюкозы в крови, ниже, чем вне гестации – 4,79% (минус 0,40%) [13].
Определение HbA1c не заменяет выполнения диагностических тестов. Данный показатель значим при выявлении у беременных манифестного СД (уточнение длительности гипергликемии). Уровень HbA1c ≥ 6,5% служит дополнительным фактором для начала инсулинотерапии. По уровню HbA1c можно оценить эффективность проводимого лечения. HbA1c ≥ 5,6% на фоне диетотерапии также является дополнительным фактором для назначения инсулина. Выявлена корреляция между уровнем HbA1c и массой тела новорожденного, частотой гестоза, преждевременных родов, оперативного родоразрешения [13].
Проведение ПГТТ не показано при выраженном токсикозе, строгом постельном режиме, обострении хронического панкреатита или синдроме резецированного желудка, на фоне острого воспалительного заболевания. Абсолютным противопоказанием является манифестация СД, индивидуальная непереносимость глюкозы.
К особенностям проведения ПГТТ у беременных относится немедленное определение уровня гликемии в венозной плазме крови натощак. При получении результатов, указывающих на манифестный (впервые выявленный) СД, дальнейшая нагрузка глюкозой не проводится и тест прекращается. При невозможности экспресс-определения уровня глюкозы выполнение теста продолжается и доводится до конца.
Вторая фаза. В случае продолжения выполнения теста пациентка должна в течение пяти минут выпить раствор глюкозы. 75 г сухой (безводной) глюкозы разбавляется в 250–300 мл теплой (37–40 °С) питьевой негазированной (дистиллированной) воды. Если используется моногидрат глюкозы, для проведения теста необходимо 82,5 г вещества. Начало приема раствора считается началом теста. После этого беременная может пить негазированную воду. Следующие пробы крови берутся через один и два часа после нагрузки глюкозой. После второго забора крови при получении результатов, свидетельствующих о ГСД, тест прекращается, третий забор крови не производится.
Вопрос об информативности и необходимости проведения теста на толерантность к глюкозе (50 г) остается дискуссионным. Тест может быть выполнен на любом сроке беременности, не натощак, без предварительной подготовки. Однако в настоящее время достаточной доказательной базы в отношении его информативности не получено.
Интерпретацию результатов проводят акушеры-гинекологи, терапевты, врачи общей практики. Специальной консультации эндокринолога для установления нарушений углеводного обмена во время беременности не требуется.
Терапия
При ГСД рекомендуется определенная диета (не режим питания!). Это связано с временными особенностями применения данных рекомендаций – только в период беременности и лактации.
Коррекция рациона питания зависит от массы тела и роста женщины. Рекомендуется полностью исключить легкоусвояемые углеводы и ограничить количество жиров. Углеводы с высоким содержанием пищевых волокон должны составлять не более 38–45% суточной калорийности пищи, белки – 20–25% (1,3 г/кг), жиры – до 30%. Пищу следует распределять равномерно между четырьмя – шестью приемами (в зависимости от количества часов бодрствования). В умеренных количествах могут быть использованы некалорийные подсластители.
Женщинам с нормальной массой тела (ИМТ – 18,00–24,99 кг/м2) рекомендуется 30 ккал/кг/сут, с избыточной (масса тела превышает идеальную на 20–50%, ИМТ – 25,00–29,99 кг/м2) – 25, с ожирением (масса тела превосходит идеальную более чем на 50%, ИМТ ≥ 30 кг/м2) – 12–15 ккал/кг/сут [50] или снижение среднесуточного калоража на 30–33 %. Доказано, что такая мера позволит уменьшить гипергликемию и уровень триглицеридов плазмы крови [51].
Кроме того, необходимы аэробные нагрузки: ходьба не меньше 150 минут в неделю, плавание. Это делается под контролем артериального давления и частоты сердечных сокращений.
Изменение режима питания, двигательной активности может привести к кетонурии. В таком случае рекомендуется дополнительный прием углеводов (≈ 15 г) перед сном или в ночное время.
Беременная несет ответственность не только за свое здоровье, но и за здоровье будущего ребенка. Поэтому она должна самостоятельно контролировать гликемию натощак, перед и через час после основных приемов пищи, кетонурию утром натощак, артериальное давление, шевеление плода, массу тела. Оптимальным считается ведение дневника самоконтроля и пищевого дневника, так как анализ данных помогает корректировать терапию.
На сегодняшний день в России для коррекции углеводного обмена при ГСД разрешен к применению только инсулин. В ряде стран Европы, Америки таким пациенткам назначают метформин и глибенкламид. Широкое их применение при ГСД пока невозможно из-за недостаточности доказательной базы.
Показаниями к назначению инсулинотерапии являются:
- два и более нецелевых значений гликемии в течение одной-двух недель самоконтроля (целевые значения самоконтроля представлены в таблице);
- признаки фетопатии по данным ультразвукового исследования (крупный плод (диаметр живота плода ≥ 75%-ного перцентиля), гепатоспленомегалия, кардиомегалия/кардиопатия, двухконтурность головки плода, отек и утолщение подкожно-жирового слоя, утолщение шейной складки). Таким пациенткам необходимо проводить суточное мониторирование глюкозы (iPro, CGMS);
- впервые выявленное или нарастающее многоводие при установленном диагнозе ГСД (при исключении других причин многоводия).
При ГСД рекомендуются инсулины, ассоциированные с минимальным проникновением антител к инсулину через плаценту и низкой антигенной активностью. Наименее антигенным признан человеческий инсулин типа регуляр (например, Актрапид, Хумулин). Три аналоговых инсулина быстрого действия: лизпро (Хумалог), аспарт (НовоРапид) и глулизин (Апидра) – сравнимы по антигенной активности с человеческим инсулином типа регуляр. Лизпро и аспарт исследовались при беременности. Доказаны их безопасность, минимальное проникновение через плацентарный барьер и отсутствие признаков тератогенности. В отличие от человеческих регуляр-инсулинов применение этих двух препаратов ассоциировалось с сокращением риска высоких постпрандиальных колебаний и отсроченной гипогликемии после еды. Аналоги инсулина продленного действия гларгин (Лантус) и детемир (Левемир) также разрешены к применению у беременных с ГСД [52–54].
Инсулинотерапия может осуществляться в разных режимах: болюс, базис, базис-болюс – в зависимости от потребностей беременных. При постпрандиальной гликемии более 6,7 ммоль/л назначается ультракороткий инсулин в болюсном режиме по 4–6 Ед за 15–20 минут до основных приемов пищи. Подбор дозы проводится под контролем постпрандиальной гликемии (через час – полтора после еды). Уровень глюкозы не должен превышать 6,7 ммоль/л, что соответствует таковому у беременных без нарушений углеводного обмена. Потребность в количестве вводимого инсулина может меняться каждые один – три дня.
Гликемия натощак должна быть не выше 5,0–5,1 ммоль/л. При 5,3 ммоль/л на фоне постпрандиальной нормогликемии рекомендован инсулин пролонгированного действия. Инсулин следует вводить по 4–6 Ед в 22.00 или 23.00. Доза вводимого препарата зависит от индивидуальных потребностей, длительности гестации и определяется по уровню гликемии натощак и в течение суток [53, 55].
При постпрандиальной гипергликемии на фоне нормальных значений гликемии натощак вследствие введения пролонгированного инсулина необходимо добавить ультракороткий инсулин в болюсном режиме. В случае интенсификации инсулинотерапии самоконтроль гликемии следует проводить не менее восьми раз в день (натощак, перед едой, через час после еды, перед сном, в три часа утра и при плохом самочувствии).
Потребность в инсулинотерапии у пациенток с ГСД чаще развивается на 26–32-й неделе, более раннее ее начало может свидетельствовать о наличии другого типа СД.
После родоразрешения инсулинотерапия отменяется при сохранении диетотерапии (на весь период грудного вскармливания). Если гликемия натощак более 6,0 ммоль/л и постпрандиальная более 7,2 ммоль/л, необходимо ее возобновить и проводить в течение всего периода лактации [56].
Особенности родоразрешения
Согласно Алгоритмам специализированной медицинской помощи 2017 г. роды у пациенток с ГСД проводятся так же, как у женщин с СД [49].
ГСД не является показанием к досрочному родоразрешению и плановому кесареву сечению.
Родоразрешение рекомендовано не позднее 38–39-й недели гестации. Способ родоразрешения определяет акушер-гинеколог.
К плановому кесареву сечению применяются общепринятые в акушерстве показания. При наличии у плода выраженных признаков диабетической фетопатии во избежание родовой травмы (дистоция плечиков) показания для планового кесарева сечения целесообразно расширить.
У женщин с ГСД, компенсированных по углеводному обмену, и в отсутствие признаков фетопатии следует рассмотреть возможность родоразрешения на 38–39-й неделе. Проводить стимуляцию родов у данной категории лиц не следует.
Последующее наблюдение и ведение
Пациентки, перенесшие ГСД, относятся к группе высокого риска развития СД 2 типа. Следовательно, эти женщины должны находиться под постоянным контролем эндокринолога и акушера-гинеколога.
Через 6–12 недель после родов всем женщинам с уровнем глюкозы венозной плазмы крови натощак < 7,0 ммоль/л для реклассификации степени нарушения углеводного обмена проводится ПГТТ с 75 г глюкозы (исследование глюкозы натощак и через два часа после нагрузки). Рекомендуются также диета, направленная на снижение массы при ее избытке, и расширение физической активности.
Важно информировать педиатров и подростковых врачей о необходимости контроля за состоянием углеводного обмена и профилактики СД 2 типа у детей, матери которых перенесли ГСД [49].
Заключение
В настоящее время многие вопросы, связанные с ГСД, решены. Однако остаются вопросы и для дискуссии, в частности в отношении минимально допустимой гликемии у беременных, диапазона суточной вариабельности гликемии для будущей матери и плода, оптимальных уровней ИМТ, ХС, триглицеридов у матери перед наступлением беременности, фактора наследуемости ожирения, СД (как по линии матери, так и по линии отца). В перспективе необходимо рассмотреть возможность внесения рекомендаций о проведении ПГТТ с 75 г глюкозы на 27–28-й неделе беременности (более зрелая плацента по активности гормональной секреции), генетического обследования пациенток на MODY, особенно при наличии отягощенной наследственности по СД 2 типа и ожирению, ПГТТ с 75 (50) г глюкозы на третьи сутки после родоразрешения, перед выпиской из роддома (в отсутствие результатов генетического анализа и стойкой гипергликемии в послеродовом периоде).
A.N. Oranskaya
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Alevtina Nikolayevna Oranskaya, anor2004@list.ru
The article analyzes the international experience in the diagnosis and treatment of gestational diabetes, monitoring and management of such patients and their children after childbirth. Provided issues for discussion and further analysis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.