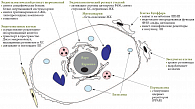
В настоящее время неалкогольная жировая болезнь печени (НАЖБП) считается одним из основных факторов риска ССЗ. При этом НАЖБП серьезно ограничивает возможности проведения адекватной гиполипидемической терапии, поскольку статины могут способствовать прогрессированию стеатоза печени (рис. 2). В связи с этим при лечении атерогенной дислипидемии статинами и фибратами целесообразно назначение гепатопротекторов. Выбор гепатопротекторов зависит от стадии НАЖБП. Формирование и прогрессирование дислипидемии необходимо рассматривать в тесной взаимосвязи с состоянием микробиоты пищеварительного тракта. При этом значению микробной экологии пищеварительного тракта в реализации физиологических функций и патологических нарушений при дислипидемии до настоящего времени уделяется необоснованно мало внимания.
Предположение, что кишечная микрофлора участвует в холестериновом обмене, было выдвинуто еще в 1935 г. С тех пор накоплено много доказательств того, что резидентная и транзиторная микрофлора в организме человека активно участвует в стериновом метаболизме (синтез, трансформация или разрушение экзогенных и эндогенных стеринов). В 2001 г. Карнейро Де Мура предложил теорию, которая рассматривает дисбаланс микробного сообщества в толстой кишке как один из путей реализации нарушений липидного метаболизма [9, 19, 21, 22, 26, 27, 28].
Атерогенные дислипидемии могут развиваться в результате аномалий генов, которые регулируют функции рецепторов, ферментов или транспортных белков, участвующих в липидном обмене. В этих случаях они проявляются как семейные (наследственные) нарушения липидного метаболизма и относятся к первичным [1]. Дислипидемии, сопровождающие ряд заболеваний, связанные с гормональными нарушениями или возникающие при приеме лекарственных препаратов (тиазиды, Оксодолин, неселективные бета-блокаторы (пропранолол), иммунодепрессанты, половые стероиды, барбитураты и циметидин), классифицируются как вторичные.
В настоящее время в качестве стандартной номенклатуры гиперлипидемии используется классификация Фредриксена 1967 г., утвержденная ВОЗ в качестве международной в 1970 г. (табл. 1). В повседневной практике врачи чаще имеют дело с дислипидемией IIa, IIb и IV типов [4, 15]. Оптимальные значения липидных параметров, которые были приняты секцией атеросклероза ВНОК в соответствии с Европейскими рекомендациями по профилактике ССЗ, представлены в таблице 2. Эти значения оптимальны для взрослых, практически здоровых людей.
Для больных с ИБС, облитерирующими заболеваниями артерий нижних конечностей, а также сонных артерий, аневризмой брюшного отдела аорты, сахарным диабетом оптимальными уровнями общего холестерина (ОХС), ХС ЛПНП являются: ОХС ≤ 4,5 ммоль/л (175 мг/дл) и ХС ЛПНП 2,5 ммоль/л (100 мг/дл) [5]. В клинической практике нарушение липидного обмена диагностируется на основании оценки липидного профиля: ОХС, триглицеридов (ТГ), ХС-липопротеинов низкой плотности (ХС ЛПНП) и ХС-липопротеинов высокой плотности (ХС ЛПВП) [18]. Пациентам с дислипидемиями показано наблюдение и при необходимости специфическая гиполипидемическая терапия. Ограничивающим фактором в терапии дислипидемии является поражение печени. Согласно современным представлениям, поражения печени при дислипидемии проявляются в виде НАЖБП [3, 7, 12, 17, 23, 24]. Понятие НАЖБП включает группу патогенетически связанных поражений печени, которые представляют собой различные стадии заболевания:
- жировая дистрофия печени (стеатоз);
- жировая дистрофия печени с воспалением и повреждением гепатоцитов – неалкогольный стеатогепатит (НАСГ);
- НАСГ с фиброзом (с возможностью прогрессии и исходом в цирроз печени (ЦП)).
НАСГ – вторая стадия развития заболевания – опасна тем, что может перейти в ЦП и рак печени (в 60–80% наблюдений ЦП неясной этиологии развивается из нераспознанного НАСГ). Выделяют первичный и вторичный НАСГ. К основным причинам развития первичного НАСГ относятся: висцеральное ожирение, сахарный диабет 2 типа, дислипидемия [3, 13, 17, 20]. Причины развития вторичного НАСГ: прием лекарственных препаратов (глюкокортикоиды, амиодарон, эстрогены, тамоксифен, тетрациклин, ацетилсалициловая кислота, индометацин, ибупрофен), других противовоспалительных средств; недостаточное питание, дефицит белка (при обширных операциях на желудке и тонкой кишке, при резком, более 1,5 кг в неделю, снижении веса, при некоторых врожденных аномалиях обмена – болезнь Вильсона – Коновалова, болезнь Вебера – Крисчена).
Патогенез НАСГ до конца не изучен. Существующая модель патогенеза НАСГ – теория «двух толчков» – заключается в следующем: при прогрессировании ожирения увеличивается поступление в печень свободных жирных кислот (СЖК) и развивается стеатоз печени («первый толчок»). В результате происходит усиление процессов окисления СЖК и образование продуктов перекисного окисления липидов (ПОЛ) и реактивных форм кислорода (РФК) с развитием оксидативного стресса («второй толчок»). В развитии стеатогепатита более важное клиническое и прогностическое значение имеет оксидативный стресс. Непосредственными факторами, вызывающими воспаление, являются нарушение функций внутриклеточных структур (митохондрий), а факторами, вызывающими гибель гепатоцитов и развитие фиброза, – ПОЛ, секреция цитокинов [3, 17].
Одной из возможных причин, способствующих развитию воспаления при НАСГ, является эндотоксемия, связанная с дисбиозом кишечника [29]. Считается, что возникновение эндотоксемии при стеатогепатите характеризуется увеличением выработки провоспалительных цитокинов (ФНО-альфа, ИЛ-6, ИЛ-8) и повышенной экспрессией рецепторов к провоспалительным цитокинам. Диагностика НАСГ у больных с дислипидемией имеет принципиально важное значение в связи с тем, что применение гиполипидемических препаратов при наличии функциональных и морфологических изменений в печени увеличивает риск развития лекарственных поражений печени [12].
Медикаментозная терапия дислипидемии
Терапия дислипидемии включает немедикаментозные мероприятия по профилактике атеросклероза и лекарственную терапию [1, 2, 4, 5]. Немедикаментозные меры профилактики атеросклероза включают диету (ограничение жиров животного происхождения), коррекцию массы тела, увеличение физической активности, прекращение курения. В проспективных исследованиях было показано, что комплексные меры по изменению образа жизни способствуют снижению смертности от ССЗ на 40%, что сопоставимо с эффективностью медикаментозной коррекции [14]. В медикаментозной терапии нарушений липидного обмена используют следующие группы препаратов:
- ингибиторы ГМГ-КоА-редуктазы (статины);
- комбинированная терапия: статины + ингибитор абсорбции холестерина (эзетимиб), статины + фибраты;
- производные фиброевой кислоты (фибраты);
- никотиновая кислота (ниацин);
- секвестранты желчных кислот (ионообменные смолы);
- омега-3 полиненасыщенные жирные кислоты;
- кишечные антисептики, пре- и пробиотики.
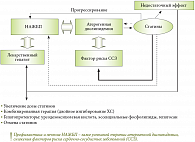
В настоящее время наиболее распространенными препаратами в лечении дислипидемии являются статины [16, 18]. В рандомизированных клинических исследованиях (4S (1994); WOSCOP (1995); CARE (1996); Post-CABG (1997); LIPID (1998); AFCAPS/TexCAPS (1998); HPS (2002)) была показана высокая эффективность статинов в снижении ОХС и ХС ЛПНП. В этих исследованиях наблюдалось снижение риска ССЗ, а в некоторых из этих исследований – общей смертности. В современных исследованиях с использованием аторвастатина и розувастатина была продемонстрирована возможность стабилизации (REVERSAL) и обратного развития (ASTEROID) атеросклеротических бляшек в коронарных артериях [16]. Традиционно статины считаются безопасными препаратами, что обусловлено опытом применения их у большого числа пациентов [6, 7]. Тем не менее препарат может вызывать побочные эффекты, одним из которых является повышение уровня трансаминаз (гепатотоксический эффект).
В связи с этим статины противопоказаны при болезнях печени. Учитывая распространенность хронических заболеваний печени, можно предположить, что значительное число пациентов не могут принимать статины, несмотря на наличие показаний к их применению и хороший профилактический эффект. Кроме того, атерогенная дислипидемия также приводит к изменениям функционального состояния печени [6, 11, 13]. Таким образом, при назначении статинов пациентам с НАЖБП необходимо учитывать не только наличие индивидуальной непереносимости препаратов, но и стадию заболевания.
У больных с дислипидемией и НАЖБП в стадии стеатоза возможно использование препаратов из группы статинов: ловастатин, симвастатин, правастатин, аторвастатин, розувастатин, флувастатин. В настоящее время наиболее широко применяются: ловастатин в дозе 20–40 мг в сутки, симвастатин – 20–40 мг в сутки (максимальная доза до 80 мг), аторвастатин – 20–40 мг в сутки (максимальная доза до 80 мг), флувастатин – 40– 80 мг в сутки. Наибольший гиполипидемический эффект отмечается через 2–3 недели с момента начала лечения, следовательно, повышать дозу любого статина следует с интервалом в 2–3 недели [16]. Плейотропные эффекты статинов и результаты терапии по снижению сердечно-сосудистых осложнений начинают проявляться не ранее 6–9 месяцев с момента начала терапии.
Длительность терапии обусловливает необходимость тщательного контроля уровня активности печеночных ферментов. Для предотвращения гепатотоксических реакций при приеме статинов у больных с НАЖБП целесообразно проводить курсы гепатопротективной терапии эссенциальными фосфолипидами (Эслидин) и препаратами урсодезоксихолевой кислоты (УДХК). Применение эссенциальных фосфолипидов (Эссливер Форте, Эссенциале, Фосфоглив) по 2 капсулы 3 раза в день в течение 2 месяцев, 2–3 курса в год, способствует нормализации липидного спектра крови, показателей ПОЛ и системы антиоксидантной защиты. Длительное применение эссенциальных фосфолипидов предотвращает развитие фиброза печени и дальнейшее прогрессирование заболевания.
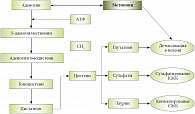
Препаратом выбора среди гепатопротекторов группы эссенциальных фосфолипидов в настоящее время является Эслидин. Входящий в состав препарата метионин представляет собой незаменимую аминокислоту, которая является источником метильных групп. Метионин необходим для синтеза холина. Увеличение содержания холина способствует увеличению синтеза эндогенных фосфолипидов и уменьшению отложения нейтрального жира в печени. При атеросклерозе метионин снижает концентрацию холестерина и повышает концентрацию фосфолипидов в крови. Метионин также участвует в обмене серосодержащих аминокислот, в синтезе эпинефрина, креатинина и других биологически активных соединений, активизирует действие гормонов, витаминов (В12, аскорбиновой, фолиевой кислот), ферментов, белков, участвует в реакциях переметилирования, дезаминирования, декарбоксилирования. Метионин и эссенциальные фосфолипиды усиливают действие друг друга. Таким образом, Эслидин восстанавливает дезинтоксикационную и синтетическую функции печени, а также нормализует жировой, углеводный и белковый обмен (рис. 3). Некоторые из них при длительном применении в качестве терапии сопровождения снижают гепатотоксичный эффект статинов. Побочные эффекты от приема эссенциальных фосфолипидов выражены минимально, проявляются в виде аллергических реакций.
Препараты УДХК в стандартной дозировке 15 мг/кг могут применяться не только как гепатопротекторы, но и использоваться в качестве альтернативной гиполипидемической терапии у больных с сопутствующей НАЖБП в стадии стеатогепатита. Широкий спектр применения препаратов УДХК обусловлен комплексным механизмом действия [10, 12, 25]: УДХК не только изменяет липидный обмен, но и обладает прямым гепатопротективным, желчегонным, холелитолитическим, а также иммуномодулирующим действием. Обладая высокими полярными свойствами, УДХК образует нетоксичные смешанные мицеллы с аполярными (токсичными) желчными кислотами, что уменьшает повреждающее действие желудочного рефлюктата на клеточные мембраны при билиарном рефлюкс-гастрите и рефлюкс-эзофагите. Кроме того, УДХК образует двойные молекулы, способные включаться в состав клеточных мембран гепатоцитов, холангиоцитов, эпителиоцитов желудочно-кишечного тракта, обеспечивая их стабилизацию и невосприимчивость к действию токсичных мицелл.
Уменьшая концентрацию токсичных для гепатоцитов желчных кислот и стимулируя холерез, богатый бикарбонатами, УДХК способствует разрешению внутрипеченочного холестаза, уменьшает насыщенность желчи холестерином за счет угнетения его абсорбции в кишечнике, подавления синтеза в печени и понижения секреции в желчь; повышает растворимость холестерина в желчи, образуя с ним жидкие кристаллы; уменьшает литогенный индекс желчи. Результатом является растворение холестериновых желчных камней и предупреждение образования новых конкрементов. Иммуномодулирующее действие обусловлено угнетением экспрессии антигенов HLA-1 на мембранах гепатоцитов и HLA-2 на холангиоцитах, стимуляцией активности Т-киллеров и др. УДХК препятствует прогрессированию фиброза у больных первичным билиарным циррозом, муковисцидозом и алкогольным стеатогепатитом; уменьшает риск развития варикозного расширения вен пищевода. УДХК также замедляет процессы преждевременного старения и гибели клеток (гепатоцитов, холангиоцитов). Минимальный курс терапии – 3 месяца (2–3 раза в год) или длительно (в течение 6–12 месяцев).
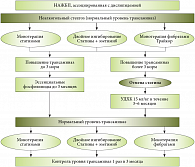
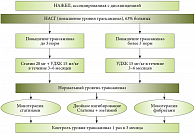
Пациентам с НАЖБП в стадии стеатогепатита (более чем 3-кратное повышение уровня трансаминаз), которые относятся к группе высокого риска развития атеросклероза, и/или больным с высокими уровнями общего ХС и ХС ЛПНП назначается комбинированная терапия: статин 20 мг + УДХК 15 мг/кг курсом от 3 до 6 месяцев до достижения нормализации уровня трансаминаз. В последующем осуществляется переход на монотерапию статинами с контролем уровня активности печеночных ферментов 1 раз в месяц. При необходимости проводят курсы гепатопротективной терапии эссенциальными фосфолипидами (Эссливер Форте, Эссенциале, Фосфоглив): 2 капсулы 3 раза в день в течение 2 месяцев, 2–3 курса в год, или препаратами УДХК в стандартной дозировке в течение 3–6 месяцев. Возможные принципы коррекции дислипидемии у больных с НАЖБП представлены на рисунках 4, 5.
У многих пациентов при монотерапии статинами не удается достичь целевых уровней общего ХС и ХС ЛПНП и снижения риска развития ССЗ и их осложнений. В последних исследованиях используют более агрессивный подход к гиполипидемической терапии, основанный на принципе «чем ниже – тем лучше». Для решения этой проблемы раньше прибегали к увеличению дозы статина. Однако известно, что эффект снижения уровня ХС ЛПНП достигается в основном за счет начальной дозы статинов, увеличение же дозы обеспечивает дополнительное снижение уровня ХС ЛПНП примерно на 6% («правило 6»). При этом увеличение дозы статина повышает риск развития побочных эффектов, в том числе и гипертрансаминаземии. Интенсификация терапии статинами сопровождается увеличением частоты токсических поражений печени. В частности, в исследовании TNT в группе пациентов, получавших 80 мг аторвастатина, в 6 раз чаще регистрировалось более чем 3-кратное повышение уровня трансаминаз по сравнению с группой больных, принимавших 10 мг препарата. Следует также отметить, что усиление гепатотоксического эффекта статинов может быть связано с недиагностированной НАЖБП.
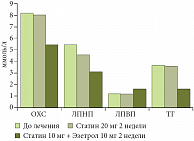
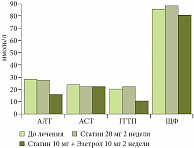
Современные методы лечения атерогенной дислипидемии основываются на двойном ингибировании синтеза ХС и его абсорбции, применении селективного ингибитора кишечной абсорбции ХС – эзетимиба (Эзетрол). Использование комбинации эзетимиба и статина увеличивает снижение уровня ХС ЛПНП на 40% (рис. 6), не вызывая повышения уровня трансаминаз (рис. 7). Поэтому у больных с высоким риском развития ССЗ в терапии, направленной на достижение целевых уровней ХС ЛПНП и снижение риска побочных эффектов, целесообразно использовать наиболее эффективную и безопасную комбинацию статина (Симгал 10 мг) с ингибитором абсорбции ХС (Эзетрол 10 мг). При проведении комбинированной терапии уже в течение 2 недель удается достичь целевых значений ХС ЛПНП. При изолированной гипертриглицеридемии предпочтительно назначение фибратов: Трайкор 145 мг ежедневно, поддерживающий курс после достижения целевых уровней ТГ – 145 мг через день.
Цель и методы исследования
В последнее время все большее внимание уделяется участию кишечной микрофлоры, ее метаболитов, эндотоксина и оксида азота в патогенезе атерогенной дислипидемии и НАЖБП. На базе ЦНИИ гастроэнтерологии (Москва) проведено исследование, целью которого являлось изучение роли коррекции дисбиоза в лечении больных с атерогенной дислипидемией и НАЖБП. В исследование были включены 108 больных с абдоминальным ожирением, атерогенной дислипидемией и НАЖБП, из них 72 женщины и 36 мужчин в возрасте от 35 до 70 лет (средний возраст 53,0 ± 9,32 года). Проводилась оценка липидного спектра (ОХС, ХС ЛПНП, ХС ЛПВП, ТГ), биохимических показателей функции печени (АЛТ, АСТ, ГГТП, ЩФ), уровня эндотоксина и оксида азота в крови, а также пункционная биопсия печени с определением индекса гистологической активности и индекса стеатоза. Больные были разделены на 2 группы по уровню печеночных ферментов (1-я группа: нормальный уровень (n = 55); 2-я группа: повышенный уровень (n = 53)) и на 3 подгруппы по назначенной терапии (А – 33 больных получали статин, Б – 35 больных принимали пробиотик (Бактистатин), В – 40 больных получали комбинированную терапию: статин с пробиотиком).
Бактистатин является биологически активной добавкой пробиотического действия; стимулирует рост и активность собственной нормальной микрофлоры; селективно выводит токсины, тяжелые металлы, радионуклиды; действует на всем протяжении кишечника; активен в течение суток. В состав препарата Бактистатин включены три взаимоусиливающих компонента: стерилизованная культуральная жидкость природного микроба Bacillus subtilis штамма 3 с высокими медико-биологическими свойствами, содержащая пробиотические вещества (лизоцим, бактериоцины, каталазы), ферменты и аминокислоты. Бактерицидное и бактериостатическое влияние на патогенные и условно-патогенные микробы обусловлено содержанием пробиотических веществ, синтезируемых в процессе вегетативного роста бактерий Bacillus subtilis штамма 3, и концентрированием их в культуральной жидкости во время ферментации.
Цеолиты (микрогидрины) обладают сорбционными, ионообменными, молекулярно-ситовыми и каталитическими свойствами. Наличие в составе уникального природного минерала – цеолита – обусловливает нормализацию моторно-эвакуаторной функции толстой кишки. Цеолит способен проявлять сорбционные свойства преимущественно по отношению к соединениям с низкой молекулярной массой, не вступая в прямое взаимодействие с витаминами, аминокислотами, белками, оставляя их в желудочно-кишечном тракте. Ионы, содержащиеся в организме, могут включаться в кристаллическую структуру минерала, и наоборот, из минерала организм получает те неорганические элементы, в которых испытывает потребность. Происходит так называемый селективный ионообмен. Цеолиты способствуют нормализации жирового, белкового, углеводного обмена, повышению иммунитета; повышают устойчивость к стрессу, улучшают репродуктивную функцию, функции печеночных клеток. Гидролизат соевой муки обеспечивает максимально благоприятные условия для бесконкурентного роста нормофлоры и восстановления микробного пейзажа организма. Бактистатин способствует пролонгированному действию – постепенному высвобождению из экскорпорального депо высокоактивных компонентов, что позволяет не менее 24 часов поддерживать терапевтический эффект в зоне их аппликации.
Выводы
Результаты, полученные в ходе исследования, позволили сделать следующие выводы.
1. У больных НАЖБП с повышенной активностью печеночных ферментов наблюдается увеличение уровня эндотоксина в 1,5 раза и оксида азота в 1,2 раза по сравнению с группой больных с нормальным уровнем печеночных ферментов (р < 0,05). Выявлена прямая корреляция содержания эндотоксина и оксида азота с уровнем АСТ (rэндотоксина = 0,34, rоксида азота = 0,34), ГГТП (rэндотоксина = 0,88, rоксида азота = 0,86) (р < 0,05), что доказывает участие данных метаболитов кишечной микрофлоры в патогенезе НАЖБП.
2. Эндотоксин и оксид азота могут быть использованы в качестве маркеров развития неалкогольного стеатогепатита как стадии НАЖБП. При повышении эндотоксина и оксида азота выявлено прогрессирование воспалительной инфильтрации печени, о чем свидетельствует повышение индекса гистологической активности (rэндотоксина = 0,84, rоксида азота = 0,69).
3. Применение пробиотиков у больных НАЖБП в стадии стеатогепатита способствует снижению активности печеночных ферментов (АЛТ – на 38,5%, АСТ – на 30%, ГГТП – на 33,2%). За счет снижения уровня эндотоксина и оксида азота уменьшается системное воспаление, в том числе активность печеночных трансаминаз, отражающих регресс цитолитического синдрома. Эти изменения отмечены примерно у 1/3 больных, однако нормализации липидного спектра при монотерапии пробиотиками не наступает.
4. При назначении монотерапии пробиотиками у больных НАЖБП и атерогенной дислипидемией отмечена тенденция к снижению общего холестерина
у 12% больных, ХС ЛПНП – у 10%, триглицеридов – у 7% (р > 0,05).
5. Комбинированная терапия статинами и пробиотиками оказывает достоверный гиполипидемический эффект в обеих группах (в 1-й группе общий холестерин снижался на 28%, ХС ЛПНП – на 33%, триглицериды – на 36%, во 2-й группе – на 23%, 46% и 49% соответственно, р < 0,05), сопровождается снижением эндотоксина (на 32% в 1-й группе и 38,9% во 2-й группе, р < 0,05), оксида азота (на 18,9% в 1-й группе и 23,1% во 2-й группе, р < 0,05). Отмечено уменьшение гепатотоксического эффекта статинов (в 1-й группе статистически значимого повышения печеночных ферментов не отмечено, во 2-й группе выявлена тенденция к снижению АЛТ на 19%, ГГТП на 12%, р > 0,05).
Таким образом, можно заключить, что пациентам с НАЖБП для улучшения гиполипидемического эффекта статинов показана коррекция микрофлоры. Препаратом выбора является Бактистатин, который следует принимать по 1–2 капсуле 2 раза в день во время еды, длительность терапии в среднем составляет 4 недели. При выраженном дисбиозе кишечника необходима предварительная санация толстой кишки. В настоящее время широко применяют препарат Альфа Нормикс – бактерицидный антибиотик широкого спектра действия, производное рифамицина. Альфа Нормикс необратимо связывает бета-субъединицы фермента бактерий ДНК-зависимой РНК-полимеразы, ингибирует синтез РНК и белков бактерий, вызывает их гибель. Проявляет бактерицидные свойства в отношении чувствительных бактерий. Альфа Нормикс активен в отношении большинства грамположительных и грамотрицательных, аэробных и анаэробных микроорганизмов, вызывающих желудочно-кишечные инфекции, включая диарею путешественников. Рифаксимин не всасывается из желудочно-кишечного тракта и оказывает противомикробное действие в кишечнике (до 1% может всасываться при наличии язв слизистой кишечника). Альфа Нормикс принимают по 2 таблетки (2 мг) 2 раза в день, продолжительность лечения составляет 7–10 дней.
Заключение
НАЖБП является основным фактором риска ССЗ. С целью ранней диагностики поражения печени у больных с атерогенной дислипидемией рекомендуется проведение комплексного клинико-инструментального обследования для уточнения стадии НАЖБП. Гиполипидемическую терапию следует проводить с учетом стадии НАЖБП в комплексе с гепатопротекторами. При НАЖБП в стадии стеатоза целесообразно применение комбинации гиполипидемической терапии с эссенциальными фосфолипидами. При НАЖБП в стадии НАСГ необходимо сочетать прием препаратов, снижающих ХС, с препаратами УДХК. Больным с высоким уровнем гиперхолестеринемии для достижения целевых уровней ХС ЛПНП и снижения побочных эффектов рекомендован прием комбинации статинов с ингибитором абсорбции ХС. При изолированной гипертриглицеридемии препаратами выбора являются фибраты. В комплекс гиполипидемической терапии у больных с НАЖБП необходимо включать препараты, нормализующие кишечную микрофлору (кишечные антисептики, пре- и пробиотики).