История изучения холестероза желчного пузыря (ХЖП) охватывает несколько десятилетий исследований зарубежных и отечественных ученых. Отложение липидов в стенке желчного пузыря (ЖП) впервые описано патоморфологами более 145 лет назад [1, 2]. Было предложено много терминов для обозначения этой патологии, что свидетельствует как о значительном интересе к этой проблеме, так и о разнообразии взглядов на симптоматику, патогенез и морфологию ХЖП, например, такие термины, как «землянично-ягодный желчный пузырь» [3], «крапчатый», «чешуйчатый» [4], «холестериновый полипоз» [5], «рыбье-чешуйчатый», «медовый», «малиновый», «липоидный желчный пузырь», «холестеатоз», «холестеролоз», «липоидоз», «ксантомный холецистит», «катаральный папилломатозный холецистит» [6, 7]. До настоящего времени сохранился термин «холестероз», предложенный в 1925 г. S.H. Mentzer [8].
Классификация и клинические проявления
Морфологические проявления холестероза наблюдаются в виде желтоватой сетки на слизистой оболочке, а также мелких полиповидных разрастаний за счет отложения липидов. В основу классификации ХЖП положены макроскопические изменения слизистой оболочки ЖП. Выделяют следующие формы ХЖП: очаговая сетчатая, диффузная сетчатая, смешанная сетчато-полипозная и полипозная [9–13]. Четкие критерии для постановки клинического диагноза «холестероз желчного пузыря» не определены. Многие авторы считают, что ХЖП дает о себе знать только при развитии холецистита, желчнокаменной болезни (ЖКБ) [9, 14]. Другие полагают, что ХЖП может проявляться самостоятельной симптоматикой в виде коликообразных болей в правом подреберье в течение длительного времени, диспепсических явлений [15, 16]. По данным Р.А. Иванченковой и соавт., основанным на наблюдении 180 больных с ХЖП, характерными клиническими признаками заболевания были астеноневротический синдром, диспепсический синдром, боль ноющего характера в эпигастрии или в правом подреберье. Были выделены 3 варианта клинического течения ХЖП: бессимптомный, неосложненный, осложненный [9].
Распространенность
Анализ литературы свидетельствует о широкой распространенности ХЖП: встречается во всех возрастных группах (от 13 до 94 лет), при этом наибольший процент заболеваемости приходится на лиц молодого и среднего возраста (20–40 лет) [17, 18]. По заключению У. Лейшнера, ХЖП выявляется у 5–45% оперированных больных [19]. По данным ряда авторов, частота встречаемости ХЖП колеблется от 4,6 до 40,1%; в 39% случаев ХЖП выявляется при холецистэктомии и в 46% случаев – при аутопсии [20–23]. Существуют разные мнения о частоте поражения ЖП холестерозом у мужчин и женщин: одни авторы утверждают, что ХЖП чаще встречается у женщин [6, 14, 24], другие полагают, что ХЖП одинаково часто выявляется как у женщин, так и у мужчин [9, 10, 19, 25–27]. Подобная разница в выводах, возможно, связана с отсутствием четких диагностических критериев ХЖП и улучшением диагностики с появлением методов высокого разрешения, в том числе эндоскопической ультрасонографии. По результатам последних исследований установлено, что среди пациентов с заболеваниями ЖП холестероз встречается в 40,3% случаев, причем чаще среди мужчин (44,3%), чем среди женщин (38,5%), в возрасте от 40 до 59 лет [28]. Представляют интерес приводимые в литературе сведения о наибольшей распространенности ХЖП в Чили, а наименьшей – в странах Средней Азии, что связывают с особенностями питания в этих регионах [29–31].
Патогенез
Среди причин развития ХЖП чаще всего выделяют нарушение метаболизма холестерина в организме и локальные изменения со стороны ЖП [8, 32, 33]. За последние десятилетия появилось много новых данных о механизмах регуляции обмена холестерина. В настоящее время гиперхолестеринемия уже не может рассматриваться в качестве основного критерия нарушения обмена липидов. Концепция формирования ХЖП вследствие гиперхолестеринемии не отражает современных представлений об основных патогенетических механизмах его развития. Нормальный уровень холестерина сыворотки крови не исключает возможности нарушений в системе его внутриклеточного транспорта, а именно в концентрации различных фракций липопротеидов (ЛП), количестве и соотношении аполипопротеинов сыворотки крови (транспорт холестерина в организме регулируется соединениями белковой природы – аполипопротеинами А и В) [9, 17, 34, 35].
Аполипопротеины А1 и А2 входят в состав плазменных антиатерогенных липопротеидов высокой плотности (ЛПВП). АпоВ-содержащие липиды выполняют функцию доноров или резервуара холестерина, транспортируемого из печени, где синтезируется основное его количество. АпоА-содержащие липопротеиды являются средством обратного транспорта холестерина в печень, причем не только из клеток, но и из апоВ-содержащих липопротеидов [36–39]. В формировании холестероза имеет значение также всасывательная способность стенки ЖП. Установлено, что помимо солей и воды в норме стенка ЖП абсорбирует определенное количество свободного холестерина желчи и его циклических предшественников (свободных жирных кислот) [36, 40]. Треть абсорбированного холестерина поступает в слизистую оболочку ЖП, две трети возвращается в желчь, таким образом, депонирования липидов в стенке желчного пузыря не происходит [39].
Ряд авторов считают, что существует предел насыщения желчи холестерином, после которого начинается развитие холестероза, если сохранена способность желчи солюбилизировать холестерин, или – при снижении этой способности – холелитиаза. Исходя из этой гипотезы, можно предположить, что солюбилизация холестерина желчи зависит от баланса между активностью пронуклеаторов и ингибиторов нуклеации, изучению которых в последнее время уделяется особенно пристальное внимание [17, 34, 36, 41–46]. Поскольку транспорт воды осуществляется через поверхность слизистой, концентрация различных составляющих желчи будет выше в слоях, прилежащих к слизистой оболочке, чем в просвете ЖП. Вследствие этого градиент концентрации липидов желчи способствует дальнейшему наслоению и преципитации, что объясняет отложение холестерина преимущественно на поверхности слизистой оболочки [44, 47, 48].
Холестерин поглощается клетками эпителия ЖП и эстерифицируется в эндоплазматическом ретикулуме. В дальнейшем эфиры связываются с аполипопротеинами, которые служат для транспортировки холестерина по лимфатическим сосудам в общий кровоток и печень [49]. При нарушении транспорта липидов из эндотелия в кровь (вследствие ингибирования или недостаточного синтеза аполипопротеинов) эпителиальные клетки накапливают холестерин в виде липидных капель, располагающихся преимущественно в подъядерной части цитоплазмы [40]. Далее эти липидные конгломераты выходят в межклеточное пространство, фагоцитируются макрофагами, которые трансформируются таким образом в пенистые клетки, подобно тому как это происходит в артериях при атеросклерозе. Есть мнение, что ХЖП является местным проявлением атеросклероза вследствие нарушения липидного обмена [50]. Макрофаги увеличиваются до такой степени, что не могут пройти через эндотелий лимфатических сосудов, блокируют лимфатические капилляры, что приводит к их деструкции. Этот механизм в значительной степени объясняет накопление пенистых клеток и эфиров холестерина в подслизистом слое по ходу лимфатических сосудов [51–53]. Таким образом, в патогенезе ХЖП можно выделить следующие звенья:
- нарушение метаболизма холестерина;
- уменьшение ХС ЛПВП, появление модифицированных ЛПВП;
- снижение акцепции свободного холестерина с мембран периферических клеток;
- изменение фосфолипидного состава поверхностного монослоя ЛП-частиц;
- модификация апобелков (изменение соотношения АпоВ/АпоА1 – увеличение поступления холестерина в клетку);
- усиление пассивного и активного (в составе везикул с модифицированным и немодифицированным апобелком) транспорта холестерина из перенасыщенной желчи в цитоплазму эпителиальной клетки слизистой желчного пузыря;
- интенсивное поглощение липидов макрофагами в результате модификации их апобелкового компонента. Уровень АпоС3 – маркер метаболизма липопротеидов (ЛП), богатых триглицеридами. Апобелки Е3/3, Е4/4 ответственны за модификацию белков-переносчиков и их рецепторов, что приводит к перенасыщению липопротеидами макрофагов, превращая их в пенистые клетки [9];
- трансформация макрофагов в пенистые клетки → накопление в слизистой ЖП → замедленное выведение холестерина из стенки ЖП;
- нарушение моторно-эвакуаторной функции ЖП.
До недавнего времени основным методом лечения ХЖП являлась холецистэктомия [7]. Попытки воздействия на липидный обмен с помощью гиполипидемических препаратов у больных с нарушением функции печени приводили к развитию гепатотоксических реакций. Хорошие результаты получены при применении препаратов урсодезоксихолевой кислоты [28]. Показаны также препараты, улучшающие моторику желчного пузыря. Поскольку основным органом, в котором осуществляется синтез холестерина и формируются основные нарушения метаболизма липидов, является печень, необходимо продолжать изучение механизмов развития ХЖП на уровне гепатоцита.
Цель, материалы и методы исследования
Целью исследования, проведенного в ЦНИИ гастроэнтерологии (Москва), было выявление специфических морфологических признаков поражения печени у больных с ХЖП на фоне стеатогепатита. Обследовано 150 пациентов со стеатогепатитом в возрасте от 35 до 68 лет, из них 121 женщина (средний возраст 63,3 ± 4,7 лет) и 29 мужчин (средний возраст 59,2 ± 3,6 лет). Обследование включало сбор анамнеза, осмотр, лабораторные методы: биохимический анализ крови (общий белок, холестерин, билирубин, аспартатаминотрансаминаза (АСТ), аланинаминотрансаминаза (АЛТ), щелочная фосфатаза (ЩФ), гамма-глютаминтранспептидаза (ГГТП), глюкоза, тест на толерантность к глюкозе, липидный спектр крови (общий холестерин (ХС), липопротеиды низкой плотности (ЛПНП), липопротеиды высокой плотности (ЛПВП), триглицериды (ТГ)), анализ методом ПЦР на гепатит В, С, ТТ, G; инструментальные методы: ультразвуковое исследование (УЗИ) органов брюшной полости с измерением сократительной функции желчного пузыря (СФЖП); морфологические исследования: гистологическое исследование печени и ЖП.
ХЖП диагностирован на основании данных УЗИ, критерием являлось сочетание двух и более признаков: увеличение плотности стенки ЖП, неоднородность стенки ЖП, утолщение стенки ЖП, повышение плотности пузырной желчи (билиарный сладж), снижение сократимости ЖП (менее 50%). При обследовании пациентов с нарушением обмена холестерина было отмечено, что у многих больных с атерогенной дислипидемией выявляется стеатогепатит. При обследовании больных (150 пациентов) с атерогенной дислипидемией и стеатогепатитом в 51,33% случаев был выявлен ХЖП. Высокий процент ХЖП у больных со стеатогепатитом является поводом для дальнейшего изучения проблемы с точки зрения взаимосвязи патологии печени, атерогенеза и ХЖП. Последовательность событий можно представить следующим образом: патология гепатоцита → атерогенная дислипидемия → стеатоз печени → ХЖП.
Следует отметить, что у больных с ХЖП наиболее часто встречается дислипидемия IIа и IIб типа, что соответствует типам атерогенной дислипидемии (по классификации Фредриксона). На основании анамнестических данных было установлено, что длительность заболевания (проявление клинических симптомов ХЖП) превышала в среднем 6 лет ± 2,1 года. Основные клинические симптомы у больных с ХЖП: боли, тяжесть в правом подреберье, диспепcические расстройства: горечь во рту, тошнота, снижение аппетита, метеоризм, нарушения стула (запоры, чередование поноса и запоров, диарея). Выявлены факторы риска: атерогенная дислипидемия, нарушение толерантности к глюкозе, абдоминальное ожирение, наследственность, пол, возраст (табл. 1). В биохимическом анализе крови отмечалось повышение уровня трансаминаз, ЩФ, ГГТП и билирубина в среднем в 1,5–2 раза относительно нормы (табл. 2).
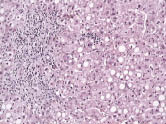
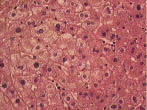
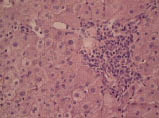
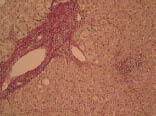
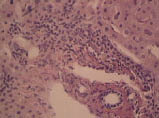
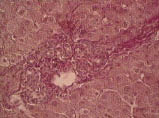
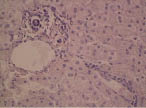
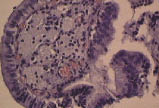
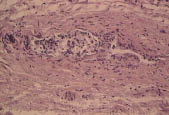
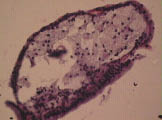
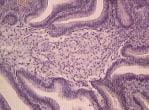
Нарушения в липидном спектре крови представлены в таблице 3. У всех пациентов выявлен атерогенный тип дислипидемии. Из нарушений моторно-эвакуаторной функции ЖП преобладал гипомоторный тип дискинезии (табл. 4). По данным УЗИ выявлено преобладание очагово-сетчатой формы ХЖП (табл. 5). У всех пациентов было выявлено нарушение сократительной функции ЖП, коэффициент сокращения ЖП был снижен в среднем до 38%. При гистологическом исследовании печени выявлены следующие изменения: жировая инфильтрация – 90%, портальная и внутридольковая инфильтрация – 83,33% (рис. 1), гидропическая дистрофия, двуядерные гепатоциты – 43,33% (рис. 2), лобулярный гепатит – 76,66% (рис. 3), фиброз портальных трактов – 63,33% (рис. 4), перидуктулярный фиброз – 53,33% (рис. 5), пролиферация дуктул, отслойка эпителия дуктул – 33,33% (рис. 6, 7). Данные гистологического исследования желчного пузыря: выявлены пенистые клетки в слизистом и подслизистом слое (рис. 8), аналогичные изменения выявляются в стенке печеночной артерии (рис. 9). Обнаружены холестериновые полипы, деструкция эпителия (рис. 10). В одном из случаев впервые были обнаружены пенистые клетки в строме папиллярной аденомы (рис. 11).
Результаты и их обсуждение
Восьми пациентам была проведена лапароскопическая холецист-эктомия в связи с полипозной формой ХЖП и произведена интраоперационная биопсия печени с последующей гистологической верификацией полученных материалов. 22 пациентам проведена чрескожная пункционная биопсия печени под местной анестезией по стандартной методике одноразовым набором. 30 больным проводилась терапия препаратом урсодезоксихолевой кислоты (Урсосан, PRO.MED.CS) в стандартной дозировке 15 мкг/кг однократно в течение 3 месяцев с последующим контролем биохимического анализа крови и УЗИ желчного пузыря.
В результате лечения больных препаратом Урсосан улучшение самочувствия отметили 26 больных: ослабление болей и дискомфорта в правом подреберье, уменьшение ощущения горечи во рту, тошноты. У 2 пациентов препарат был отменен из-за появления болевых ощущений в правом подреберье, усиления болей в эпигастральной области и диареи. На основании анализа изменений биохимических показателей крови после 3-месячной терапии отмечено снижение уровня общего холестерина крови на 8,6% от исходных значений (в основном за счет уровня ХС ЛПНВ: уменьшение на 10,1%), достоверное снижение уровня печеночных ферментов (АСТ – на 33,7%; АЛТ – на 47%; уменьшение уровня ГГТП – на 30,5%), показатели общего билирубина и ЩФ оставались в пределах нормальных значений как до, так и после лечения, уровень ХС ЛПВП достоверно не изменялся (табл. 6).
Заключение
На основании полученных данных можно заключить, что ХЖП не может рассматриваться как самостоятельное заболевание. По-видимому, ХЖП следует рассматривать как цепь последовательных событий: нарушение липидного метаболизма на уровне гепатоцита, развитие стеатоза, стеатогепатита, фиброза, вовлечение в патологический процесс всех анатомо-морфологических структур печени, в том числе билиарного тракта (пролиферация дуктул и последующий перидуктулярный фиброз), ХЖП. ХЖП – патология, которая в первую очередь связана с нарушением липидного метаболизма в печени, изменением литогенных свойств желчи и нарушением моторно-эвакуаторной функции ЖП.
«Золотым стандартом» лечения ХЖП является применение урсодезоксихолевой кислоты (Урсосан). Препарат назначается в дозе 15 мг на 1 кг веса – 750–1000 мг/сут на протяжении 6–12 месяцев. По требованию применяются билиарные прокинетики, спазмолитики, ферменты. Урсосан является препаратом выбора в лечении ХЖП у больных с НАЖБП и атерогенной дислипидемией. Препарат обладает уникальным гепатопротективным действием, восстанавливает структуру гепатоцитов, нормализует липидный обмен, незаменим при лечении холестатических заболеваний печени.