В настоящее время метаболический синдром (МС) является одной из основных проблем общественного здоровья. Распространенность МС в мире, в том числе и в России, достигает 25–50% взрослого населения [1, 2, 3]. Это состояние предшествует возникновению и развитию сахарного диабета, а также заболеваний, основным этиологическим фактором которых является атеросклероз (ишемическая болезнь сердца, сосудистые заболевания головного мозга и др.) [4, 5, 6]. Для уменьшения выраженности основных проявлений МС и его обратимости необходимо комплексное лечение, которое должно предусматривать изменение образа жизни больного, коррекцию ожирения, нарушений углеводного обмена, артериальной гипертонии, дислипидемии.
В проспективных исследованиях показано, что комплексные меры по изменению образа жизни (соблюдение гиполипидемической диеты, нормализация массы тела, увеличение физической активности, отказ от курения) способствуют снижению смертности от сердечно-сосудистых заболеваний на 40%, что сопоставимо с эффективностью медикаментозного лечения [7]. Медикаментозная терапия нарушений липидного обмена предусматривает применение ингибиторов ГМК-КоА-редуктазы (статины), ингибиторов абсорбции холестерина в кишечнике (эзетимиб), секвестрантов желчных кислот (ионообменные смолы), производных фиброевой кислоты (фибраты), никотиновой кислоты (ниацин), полиненасыщенных жирных кислот и др. [8, 9].
В настоящее время наиболее часто применяемыми препаратами для лечения дислипидемии являются статины [4, 10]. Считается, что они имеют высокую клиническую эффективность и безопасность [11, 12]. Однако следует отметить, что одним из распространенных осложнений терапии статинами, даже в случае с исходными нормальными показателями аминотрансфераз, является токсическое поражение печени с развитием так называемого «статинового» гепатита, который встречается у 1–5% больных [1, 11, 13, 14, 15, 16].
Для ликвидации этого неблагоприятного побочного эффекта требуется назначение ряда других лекарственных средств: ингибиторов абсорбции холестерина в кишечнике (эзетимиб) [17], урсодезоксихолевой кислоты [15], препаратов, содержащих эссенциальные фосфолипиды, липосомальных препаратов, полифенолов растительного происхождения, синтетических гепатопротекторов, органопротекторов и др. [18, 19, 20, 21, 22].
Медицинской науке с давних пор известны биологически активные вещества растительного и животного происхождения, употребление которых может нормализовать различные, в том числе жизненно важные, функции человеческого организма. Среди этих веществ наиболее значимыми являются биологически активные продукты пчеловодства (БАПП): мед, пыльца (обножка), перга, прополис, маточное молочко, воск.
БАПП представляют собой естественное сочетание веществ растительного происхождения и продуктов жизнедеятельности пчел, обладающих разнообразными ценными свойствами. Их биоактивность определяют, главным образом, уникальные природные сочетания отдельных компонентов [23, 24, 25, 26, 27, 28]. Благодаря наличию в меде, пыльце и перге незаменимых аминокислот (аргинин, гистидин, метионин, лейцин, лизин и др.), насыщенных и ненасыщенных жирных кислот (линолевая, арахидоновая, олеиновая и др.), фосфолипидов, фитостеринов, флавоноидов, комплекса минеральных веществ и витаминов, моносахаридов, БАПП участвуют в регулировании окислительно-восстановительных процессов, а также углеводного и липидного обменов в организме.
БАПП обеспечивают гепатопротекторное действие, что особенно важно при терапии МС, так как печень вследствие многообразия выполняемых ею функций определяет характер течения и степень тяжести МС, одновременно являясь основным органом-мишенью при этом патологическом состоянии [1, 29]. Актуальным для практической медицины является вопрос о гиполипидемическом действии продуктов пчеловодства при МС. Его изучение явилось целью нашего исследования.
Материалы и методы
Целью работы явилось определение эффективности гиполипидемической терапии продуктами пчеловодства (мед, пыльца, перга) у больных с атерогенной дислипидемией и ожирением. В исследование было включено 157 больных (64 мужчины и 93 женщины) в возрасте от 39 до 72 лет (средний возраст 61,7 ± 8,5 лет) с атерогенной дислипидемией (уровень общего холестерина (ОХС) > 5,0 ммоль/л, холестерина липопротеидов низкой плотности (ХС ЛПНП) > 3,0 ммоль/л, триглицеридов (ТГ) > 1,7 ммоль/л, холестерина липопротеидов высокой плотности (ХС ЛПВП) < 1,0 ммоль/л у мужчин и < 1,2 ммоль/л у женщин). В исследование включались только те больные, которые соблюдали гиполипидемическую диету (ГД), рекомендуемую Европейским обществом атеросклероза (EAS) для профилактики сердечно-сосудистых заболеваний, обусловленных атеросклерозом, проводили коррекцию массы тела, увеличивали физическую активность и принимали продукты пчеловодства в течение 12 недель.
В исследование не включались больные с гепатитами вирусной, алкогольной и лекарственной этиологии, болезнями накопления, кардиальным фиброзом и циррозом печени, повышением ферментов печени в 1,5 раза по сравнению с нормальными показателями, сахарным диабетом, хронической почечной недостаточностью, нарушениями кровообращения. Продукты пчеловодства назначались в случае отсутствия аллергии и индивидуальной непереносимости к ним. Все больные были распределены на 5 групп, сопоставимых по возрасту, полу, патологии желудочно-кишечного тракта, сердечно-сосудистой системы:
- 1-я группа – соблюдали только ГД (50 человек, из них 20 мужчин и 30 женщин; средний возраст 60,9 ± 8,6 лет);
- 2-я группа – соблюдали ГД и дополнительно принимали мед до 100 г/сут в 3 приема (30 г, 30 г, 40 г на прием) (20 человек, из них 9 мужчин и 11 женщин; средний возраст 59,7 ± 7,2 лет);
- 3-я группа – соблюдали ГД и дополнительно принимали пыльцу по 40 г/сут в 2 приема в первой половине дня (17 человек, из них 7 мужчин и 10 женщин; средний возраст 65,5 ± 5,9 лет);
- 4-я группа – соблюдали ГД и дополнительно принимали мед до 100 г/сут в 3 приема в комбинации с пыльцой по 40 г/сут в первой половине дня в 2 приема (52 человека, из них 20 мужчин и 32 женщины; средний возраст 58,7 ± 11,5 лет);
- 5-я группа – соблюдали ГД и дополнительно принимали пергу по 40 г/сут в 2 приема в первой половине дня (18 человек, из них 8 мужчин и 10 женщин; средний возраст 61,2 ± 4,3 года).
Лечение и наблюдение больных проводились в течение 12 недель с контрольным обследованием через 4, 8 и 12 недель. Определялись рост, масса тела пациентов, проводились клинический анализ и биохимическое исследование крови с определением следующих показателей: общий холестерин (ОХС), триглицериды (ТГ), ХС-липопротеины высокой плотности (ХС ЛПВП), ХС-липопротеины низкой плотности (ХС ЛПНП), глюкоза, билирубин, аспаргиновая аминотрансфераза (АСТ), аланиновая аминотрансфераза (АЛТ), щелочная фосфатаза (ЩФ), гамма-глютамилтранспептидаза (ГГТП). До лечения у больных отмечались следующие колебания уровней показателей биохимического анализа в сыворотке крови: ОХС – от 5,8 до 10,4 ммоль/л (N = 1,4–5,2), ХС ЛПВП – от 0,6 до 1,2 ммоль/л (N = 1,1–2,3), ХС ЛПНП – от 3,5 до 7,3 ммоль/л (N = 2,1–3,3), ТГ – от 2,7 до 4,1 ммоль/л (N = 0–1,7), глюкозы – от 4,7 до 7,1 ммоль/л (N = 4,1–6,4). После 12-недельного лечения и наблюдения колебания составили: ОХС – от 5,1 до 8,0 ммоль/л, ХС ЛПВП – от 1,0 до 2,2 ммоль/л, ХС ЛПНП – от 2,1 до 4,5 ммоль/л, ТГ – от 1,3 до 4,0 ммоль/л, глюкозы – от 4,3 до 6,2 ммоль/л.
Результаты исследования
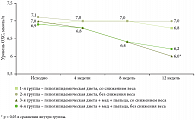
К 12-й неделе лечения в 1-й группе больных (на фоне соблюдения только ГД) снижение уровня ОХС в сыворотке крови было незначительным (на 2,9% от исходного уровня). Во 2-й группе (на фоне соблюдения ГД и приема меда) отмечено снижение показателей ОХС на 8,8% по сравнению с исходным уровнем, в 3-й группе (на фоне соблюдения ГД и приема пыльцы) – на 11,4%. Эти изменения не имели статистически достоверной разницы (р > 0,05). Наиболее значимое снижение уровня ОХС в сыворотке крови (на 18,3%) отмечено в 4-й группе (на фоне соблюдения ГД и приема пыльцы с медом), и эти изменения были статистически значимы: с 7,1 ± 0,6 до 5,8 ± 0,4 ммоль/л (р < 0,05). В 5-й группе (на фоне соблюдения ГД и приема перги) выявлено снижение ОХС на 15,7% от исходного уровня: с 7,0 ± 0,7 до 5,9 ± 0,4 ммоль/л (р = 0,05) (рис. 1).
При анализе изменений других показателей липидного спектра крови через 12 недель лечения по сравнению с исходным уровнем выявлено статистически значимое снижение (р < 0,05) уровня ХС ЛПНП в 4-й группе (с 4,6 ± 0,7 до 3,5 ± 0,3 ммоль/л; на 23,9%) и при значении р = 0,05 в 5-й группе (с 4,4 ± 0,5 до 3,5 ± 0,49 ммоль/л; на 20,5%). Снижение показателей ТГ и повышение ХС ЛПВП также оказались более существенными в 4-й (на 13,6 и 16,7% соответственно) и в 5-й группе (на 12,5 и 14,3% соответственно), но эти изменения не имели статистически достоверной разницы (р > 0,05) (табл. 1). При анализе уровня глюкозы в сыворотке крови в процессе лечения не отмечено существенных колебаний (р > 0,05) даже в группах больных, принимавших мед (2-я и 4-я группы); на протяжении всех периодов наблюдения во всех группах отмечалось снижение показателей к 12-й неделе лечения (рис. 2). Случаев повышения уровня печеночных ферментов зафиксировано не было. Переносимость продуктов пчеловодства (мед, пыльца, перга) была хорошей.
Таким образом, у больных с атерогенной дислипидемией на фоне приема продуктов пчеловодства (мед, пыльца, перга) происходила нормализация показателей липидного спектра крови (ОХС, ХС ЛПВП, ХС ЛПНП, ТГ), особенно в группе принимавших мед в комбинации с пыльцой или пергу на фоне соблюдения ГД. Уровень глюкозы крови вследствие употребления меда не повышался. Следует отметить, что ни в одном случае не произошло повышения уровня билирубина, активности АСТ, АЛТ, ЩФ, ГГТП. Непереносимость, аллергические реакции на продукты пчеловодства у больных отмечены не были. Одним из факторов, способствующих развитию атерогенной дислипидемии, является ожирение. С целью анализа гиполипидемического действия продуктов пчеловодства было проведено исследование их эффективности у больных с различной массой тела: нормальной (индекс массы тела (ИМТ) 18,5–25,0), избыточной (ИМТ 25,0–30,0) и с ожирением (ИМТ более 30,0). Суточный калораж определялся индивидуально для каждой группы с учетом ИМТ. Необходимыми условиями включения больных в исследование были коррекция массы тела и увеличение физической нагрузки. Больные с нормальной массой тела (ИМТ 18,5–25,0) были распределены на 2 группы:
- 1-я группа – соблюдали только ГД, составляющую 2500–2300 ккал/сут (18 больных, из них 8 мужчин и 10 женщин; средний возраст 58,9 ± 8,0 лет);
- 2-я группа – на фоне соблюдения ГД (2500–2300 ккал/сут) принимали мед в комбинации с пыльцой (15 больных, из них 7 мужчин и 8 женщин; средний возраст 61,2 ± 4,2 года).
В 1-й группе больных с нормальной массой тела, соблюдавших только ГД, уровень ОХС через 12 недель наблюдения снижался всего на 3,1% от исходного (р > 0,05) (табл. 2, рис. 3). Также в этой группе отмечены незначительные изменения в показателях липидного спектра крови: ХС ЛПНП, ХС ЛПВП, ТГ. Во 2-й группе больных, принимавших мед в комбинации с пыльцой на фоне соблюдения ГД, снижение уровня ОХС в сыворотке крови к 12-й неделе лечения было более существенным (с 6,3 ± 0,5 до 5,4 ± 0,3 ммоль/л; на 14,3%; р < 0,05). Статистически достоверно (р < 0,05) снижался также уровень ХС ЛПНП (с 4,0 ± 0,2 до 3,5 ± 0,2 ммоль/л; на 12,5%). Снижение показателей ТГ (с 2,2 ± 0,8 до 1,9 ± 0,6 ммоль/л; на 13,6%) и повышение уровня ХС ЛПВП (с 1,0 ± 0,6 до 1,2 ± 0,3 ммоль/л; на 16,7%) не имели статистической значимости (р > 0,05) (табл. 2). Таким образом, у больных с нормальной массой тела при применении меда в комбинации с пыльцой на фоне соблюдения ГД произошло значительное улучшение показателей липидного спектра крови (ОХС, ХС ЛПВП, ХС ЛПНП, ТГ) через 12 недель лечения по сравнению с группой больных, соблюдавших только ГД. Больные с избыточным весом (ИМТ 25,0–30,0) были распределены на 4 группы в зависимости от потери массы тела (начиная с 1 кг за 12 недель), соблюдения ГД (суточный калораж 1800–2000 ккал) и приема меда с пыльцой:
- 1-я группа – на фоне соблюдения ГД отмечено снижение веса от 1,0 до 1,9 кг (среднее значение 1,6 ± 0,3 кг) за 12 недель (7 больных, из них 3 мужчин и 4 женщины, в возрасте 56,0 ± 12,8 лет);
- 2-я группа – соблюдали ГД, но снижение веса за 12 недель не отмечено (11 больных, из них 4 мужчин и 7 женщин; средний возраст 61,3 ± 9,2 года);
- 3-я группа – на фоне соблюдения ГД и приема меда с пыльцой отмечено снижение веса от 1 до 3,6 кг (среднее значение 2,5 ± 0,8 кг) за 12 недель (8 больных, из них 4 мужчин и 4 женщины; средний возраст 55,2 ± 8,2 года);
- 4-я группа – соблюдали ГД, принимали мед и пыльцу, но снижение веса не отмечено (12 больных, из них 4 мужчин и 8 женщин; средний возраст 58,4 ± 10,6 лет).
Через 12 недель наблюдения во всех группах отмечено снижение уровня ОХС в сыворотке крови по сравнению с исходным: в 1-й группе – на 1,5%, во 2-й группе – на 1,5%, в 3-й группе – на 17,1%, в 4-й группе – на 13,2%, но статистически значимо (р < 0,05) – лишь в 3-й группе (с 7,0 ± 0,7 до 5,8 ± 0,4 ммоль/л) (рис. 4, табл. 3). Была выявлена нормализация других показателей липидного спектра крови, но статистически достоверное (р < 0,05) снижение уровня ХС ЛПНП (с 4,4 ± 0,5 до 3,5 ± 0,3 ммоль/л; на 20,5%) отмечено лишь в 3-й группе. Незначительное снижение уровня ТГ выявлено в 1-й группе (на 3,7%), во 2-й группе динамики не наблюдалось (0%), а в 3-й и 4-й группах изменения были более существенные, но статистически достоверной разницы не отмечено (р > 0,05): с 2,6 ± 0,9 до 2,3 ± 0,5 ммоль/л (на 11,5%) и с 2,8 ± 0,6 до 2,6 ± 0,4 ммоль/л (на 7,1%) соответственно. Повышение уровня ХС ЛПВП во всех группах было статистически незначимо (р > 0,05), в том числе в 3-й группе (с 1,0 ± 0,9 до 1,2 ± 0,3 ммоль/л; на 16,7%) и в 4-й группах (с 1,0 ± 0,7 до 1,1 ± 0,4 ммоль/л; на 9,1%) (табл. 3). Таким образом, через 12 недель лечения у больных с избыточной массой тела при приеме меда в комбинации с пыльцой на фоне соблюдения ГД (суточный калораж 1800–2000 ккал) выявлено достоверное уменьшение уровня ОХС и ХС ЛПНП в случае снижения веса. Больные с ожирением (ИМТ более 30) были распределены на 4 группы в зависимости от потери массы тела (начиная с 1 кг за 12 недель), соблюдения ГД (суточный калораж 1600–1800 ккал) и приема меда с пыльцой:
- 1-я группа – соблюдали ГД, отмечено снижение веса от 1,0 до 1,4 кг (среднее значение 1,2 ± 0,2 кг) за 12 недель (5 больных, из них 2 мужчин и 3 женщины, средний возраст 61,7 ± 10,6 лет);
- 2-я группа – соблюдали ГД, но снижение веса не отмечено (9 больных, из них 3 мужчин и 6 женщин; средний возраст 65,1 ± 7,3 года);
- 3-я группа – на фоне соблюдения ГД и приема меда в комбинации с пыльцой отмечено снижение веса от 1,0 до 2,4 кг (среднее значение 1,8 ± 0,6 кг); 3 больных, из них 2 мужчин и 1 женщина (средний возраст 62,5 ± 9,0 лет);
- 4-я группа – соблюдали ГД, принимали мед и пыльцу, но снижение веса не отмечено (14 больных: 3 мужчин и 11 женщин; средний возраст 64,5 ± 9,8 лет).
У больных с ожирением через 12 недель лечения отмечено снижение уровня ОХС в сыворотке крови:
- в 1-й группе – на 1,5% (с 6,9 ± 0,7 до 6,8 ± 0,4 ммоль/л; р > 0,05),
- во 2-й группе – на 1,4% (с 7,1 ± 1,0 до 7,0 ± 0,6 ммоль/л; р > 0,05);
- в 3-й группе – на 14,3% (с 7,0 ± 0,5 до 6,0 ± 0,4 ммоль/л; р < 0,05);
- в 4-й группе – на 10,2% (с 6,9 ± 1,1 до 6,2 ± 0,3 ммоль/л; р > 0,05) (рис. 5).
В отличие от больных с избыточным весом, в группе больных с ожирением при применении меда в комбинации с пыльцой на фоне соблюдения ГД со снижением веса изменение уровня ОХС менее выражено, и эти показатели остаются высокими. Что касается других показателей липидного спектра крови, все изменения были статистически незначимы (р > 0,05), в том числе в 3-й и 4-й группах: снижение уровня ХС ЛПНП (с 4,3 ± 0,7 до 3,7 ± 0,6 ммоль/л; на 14,0% и с 4,8 ± 1,0 до 4,2 ± 0,5 ммоль/л; на 12,5%), ТГ (с 2,9 ± 0,7 до 2,6 ± 0,4 ммоль/л; на 10,4% и с 2,5 ± 0,7 до 2,3 ± 0,4 ммоль/л; на 8,0%) и повышение уровня ХС ЛПВП (с 1,0 ± 0,8 до 1,2 ± 0,5 ммоль/л; на 16,7% и с 0,8 ± 1,0 до 0,9 ± 0,8 ммоль/л; на 11,1%). Таким образом, у больных с ожирением (ИМТ более 30) через 12 недель лечения улучшение показателей липидного спектра крови отмечено в группе соблюдавших ГД (1600–1800 ккал/сут) и принимавших мед с пыльцой, особенно в случае снижения веса. Но у больных с избыточной и нормальной массой тела по сравнению с группами пациентов с ожирением эти изменения были менее выражены.
Заключение
Продукты пчеловодства (мед, пыльца, перга), благодаря наличию в своем составе биологически активных веществ, обладающих системными эффектами, способствуют улучшению показателей липидного спектра крови (ОХС, ХС ЛПНП, ХС ЛПВП, ТГ) у больных с атерогенной дислипидемией. Наибольший гиполипидемический эффект оказывает применение меда в комбинации с пыльцой (снижение ОХС на 18,3%, ХС ЛПНП на 23,9%, ТГ на 13,6%, повышение ХС ЛПВП на 16,7% по сравнению с исходным уровнем) и перги (снижение ОХС на 15,7%, ХС ЛПНП на 20,5%, ТГ на 12,5%, повышение ХС ЛПВП на 14,3%). При соблюдении ГД без применения продуктов пчеловодства эти изменения незначительны и выявляются только у больных с нормальной массой тела (снижение ОХС на 3,1%, ХС ЛПНП на 2,6%, ТГ на 4,4%, повышение ХС ЛПВП на 9,1%). Улучшение показателей липидного спектра крови при применении меда в комбинации с пыльцой наблюдается у больных с избыточной массой тела (ИМТ от 25 до 30) и ожирением (ИМТ более 30) в случае снижения веса. Гипергликемии и других нежелательных побочных эффектов при 12-недельном приеме продуктов пчеловодства (мед, пыльца, перга) не отмечено.