Глутаровая ацидурия 2-го типа у новорожденного
- Аннотация
- Статья
- Ссылки
- English
Глутаровая ацидурия (ГА) 2-го типа (множественная недостаточность ацил-КоА-дегидрогеназы; код по Международной классификации болезней 10-го пересмотра – E71.3) – редкое наследственное заболевание, характеризующееся нарушением обмена аминокислот и жирных кислот. Основные клинические симптомы варьируются от тяжелых метаболических нарушений в неонатальном периоде до мышечной слабости и дыхательной недостаточности легкой степени у детей и взрослых [1–6].
Болезнь развивается при недостатке специфических митохондриальных ферментов – электронпереносящего флавопротеина (ETF) и ETF-дегидрогеназы (ETF-QO). Дефицит любого из этих ферментов приводит к накоплению в биологических жидкостях и тканях токсичных метаболитов, обусловливающих повреждение внутренних органов.
Молекулярные механизмы
Электронпереносящий флавопротеин (ETF) и ETF-дегидрогеназа (ETF-QO; ETF:убихинон-оксидоредуктаза) – специальные ферменты, ответственные за перенос электронов в дыхательной цепи митохондрий. Они участвуют в окислении жирных кислот и аминокислот, обеспечивая организм энергией в условиях, когда ее невозможно получить из молекул глюкозы.
Причиной развития ГА 2-го типа являются мутации в генах ETFA и ETFB, кодирующих альфа- и бета-субъединицы фермента ETF, а также в гене ETFDH, кодирующем ETF-QO [7, 8].
Недостаток любого из указанных ферментов приводит к накоплению в биологических жидкостях и тканях токсичных продуктов обмена веществ: глутаровой, изовалериановой, дикарбоновых и других органических кислот.
Заболевание связано с мутациями в генах ETFA, ETFB и ETFDH, наследуется аутосомно-рецессивным путем. Чтобы болезнь проявила себя, ребенок должен унаследовать патологический аллель и от матери, и от отца. Если оба родителя – носители мутантного аллеля, риск возникновения заболевания у детей составляет 25%, риск носительства мутации – 50%, вероятность рождения здорового ребенка – 25% [9–12].
Глутаровую ацидурию 2-го типа впервые исследовал в 1976 г. врач Х. Пширембель (H. Przyrembel) с коллегами. Они описали младенца с гипогликемией и метаболическим ацидозом, от кожи которого исходил характерный запах «потных ног». В анализе мочи пациента отмечалась высокая концентрация глутаровой и молочной кислот [13].
В 1991–1994 гг. установлена связь заболевания с мутациями в генах ETFA, ETFDH и ETFB [4, 14].
Распространенность и тип наследования
Частота встречаемости ГА 2-го типа в мире – один случай на 200–300 тыс. живых новорожденных [15]. Эпидемиологических данных по России нет.
Выделяют формы ГА 2-го типа с ранним (неонатальная) и поздним началом. В свою очередь первая подразделяется на форму с врожденными пороками и без них.
Неонатальная форма с врожденными пороками манифестирует в первые 24 часа жизни младенца, сопровождается тяжелым метаболическим ацидозом, гипотонией мышц, увеличением печени и почек. Ее отличительными чертами являются врожденные пороки развития внутренних органов, лицевые аномалии, а также специфический запах «потных ног» [5, 16].
Неонатальная форма без врожденных пороков проявляется в течение первых 48–72 часов жизни. Характерны те же симптомы, что и при первой форме, а также поражение сердца и печени. Однако пороков развития других органов и лицевых аномалий нет [17].
Поздняя форма может дебютировать как в детстве, так и во взрослом возрасте. Течение болезни носит волнообразный характер. Возможны острые приступы, сопровождающиеся рвотой, гипогликемией, метаболическим ацидозом, поражением печени, и хроническое течение, при котором наблюдаются мышечная слабость, утомляемость, боль в мышцах, снижение толерантности к физической нагрузке.
Диагностика
Диагностика ГА 2-го типа включает [18–21]:
- сбор анамнеза и осмотр пациента;
- определение уровня органических кислот (глутаровой, этилмалоновой и др.) в моче и ацилкарнитина в крови с помощью тандемной масс-спектрометрии или хромато-масс-спектрометрии;
- исследование уровня ацилкарнитинов в фибробластах;
- применение нейрорадиологических методов – магнитно-резонансной томографии (МРТ) головного мозга;
- молекулярную диагностику – выявление мутаций в генах ETFA, ETFB, ETFDH.
В России обследование на ГА 2-го типа не входит в программу обязательного неонатального скрининга. Семьям с больными детьми при планировании новой беременности рекомендуется медико-генетическое консультирование врача-генетика, а также пренатальная диагностика.
Лечение
При ГА 2-го типа назначают патогенетическую диетотерапию и симптоматическую терапию. Лечение направлено на коррекцию метаболических нарушений. Для этого пациенту подбирают оптимальную диетотерапию с высоким содержанием углеводов и низким содержанием белков и жиров. Важно исключить голодание.
Медикаментозное лечение включает применение рибофлавина, коэнзима Q10, а также L-карнитина. Терапия острых состояний проводится в условиях стационара [6, 13, 22].
Прогноз заболевания зависит от тяжести симптомов. Как правило, при неонатальных формах он неблагоприятный. Поздняя форма при соблюдении врачебных рекомендаций и диетотерапии протекает более благоприятно.
В работе перинатального центра особое значение имеет диагностика наследственных заболеваний. Прежде всего это касается ситуаций с внезапным ухудшением состояния здоровья новорожденного. Оперативно выявленная патология позволяет скорректировать терапию, дать прогноз жизни и развития ребенка, а также предоставить семье ребенка необходимую информацию для дальнейшего планирования рождения детей с учетом полученных данных о заболевании. Нередко при заболеваниях, связанных с нарушением обмена веществ, симптоматика развивается стремительно, и выявленный диагноз не может повлиять на изменение терапии и прогноз жизни ребенка, но очень важен для репродуктивного прогноза семьи.
Клинический случай
Ребенок от третьей беременности. Родился 3 декабря 2023 г. Мать на учете в женской консультации не состояла. Течение беременности без особенностей. Роды третьи срочные на сроке гестации 39 недель. Безводный период 10 часов 30 минут. Вес ребенка при рождении 2730 г, рост 51 см. Окружность головы 35 см. Окружность грудной клетки 30 см. Оценка по шкале Апгар 8/9 баллов. Состояние при рождении удовлетворительное. Отмечалось повышение уровня С-реактивного белка до 27 мг/л. Была назначена антибактериальная терапия. В возрасте двух суток жизни отмечалось нарастание иктеричности кожного покрова при контроле уровня билирубина крови выше нормы. Начата фототерапия.
В возрасте трех суток жизни состояние с отрицательной динамикой за счет гипербилирубинемии, гипогликемия до 1,7 ммоль/л. Состояние ребенка с отрицательной динамикой 6 декабря 2023 г. в 21.00. По газам крови смешанный ацидоз. Принято решение о подключении ребенка к аппарату искусственной вентиляции легких и дальнейшей транспортировке в отделение реанимации и интенсивной терапии новорожденных (ОРИТН).
Назначены инфузионная терапия в физиологической потребности с учетом патологических потерь, стартовая антибактериальная терапия (ампициллин сульбактам + гентамицин). Проведена коррекция гипогликемии. Уровень сахара в крови нормализовался. С 7 по 11 декабря выполнена иммунотерапия (габриглобин). 8 декабря зафиксированы мультифокальные тонико-клонические судороги. На амплитудно-интегрированной электроэнцефалограмме зарегистрирована судорожная активность. Консультирован неврологом, противосудорожная терапия согласована. На фоне некупирующихся судорог назначили титрование лидокаина. Отмечалось нарастание неврологической симптоматики, кома 1-й степени.
С 8 декабря проведена ротация антибактериальной терапии (стартовая терапия отменена, назначены меронем + ванкомицин в возрастной дозе) и назначена противовирусная терапия (ацикловир) с учетом ухудшения состояния ребенка в виде судорожного синдрома (нельзя исключить нейроинфекцию), нестабильности гемодинамики, увеличения лейкоцитоза. Наблюдались электролитные нарушения, нарушения кислотно-щелочного баланса. Проводилась коррекция инфузионной терапии.
Гемодинамика нестабильна, поддерживается вазоактивными препаратами.
Нейросонография: признаки диффузного повышения эхогенности паренхимы головного мозга. Нарушение мозгового кровотока по типу гиперперфузии. Ультразвуковое исследование: признаки следового количества выпота в брюшной полости, обеднения почечного кровотока. Энтеральное питание не получал до стабилизации состояния. Учитывая гипераммониемию, после телемедицинской консультации (ТМК) в Национальном медицинском исследовательском центре (НМИЦ) акушерства, гинекологии и перинатологии им. академика В.И. Кулакова 8 декабря в схему терапии ввели бензоат натрия 15% внутривенно в стартовой дозе 200 мг/кг/сут с увеличением по показаниям.
9 декабря отмечалось развитие ДВС-синдрома: повышенная кровоточивость из мест инъекций, по желудочному зонду патологическое отделяемое по типу «кофейной гущи», стул с примесью крови, по данным коагулограммы – гипокоагуляция. Проведена трансфузия свежезамороженной плазмы, геморрагический синдром купирован. С 10 по 11 декабря отмечалось увеличение уровня аммиака в крови до 527 мкмоль/л, дозу бензоата натрия пошагово увеличили до 400 мг/кг/сут внутривенно, дотацию жиров в парентеральном питании приостановили. К терапии добавили левокарнитин 200 мг/кг/сут внутривенно. В динамике уровень аммиака со снижением до 139 мкмоль/л. Из-за сохранявшегося повышенного уровня аммиака крови дозу бензоата натрия увеличили до 500 мг/кг/сут.
К 11 декабря гемодинамические показатели стабилизировались, кардиотоническая терапия отменена. В неврологическом статусе отрицательная динамика – угнетение сознания до комы 3-й степени. Судорог клинически нет. На осмотр не реагирует. Арефлексия, атония. Зрачки широкие, на свет не реагируют.
Результаты первичного обследования на наследственные болезни веществ (НБО) от 7 декабря – отрицательно. Принято решение начать энтеральное питание в трофическом объеме, возобновить дотацию белков и жиров под контролем уровня аммиака крови.
12 декабря проведена ТМК в НМИЦ акушерства, гинекологии и перинатологии им. академика В.И. Кулакова. Рекомендованы анализ спектра органических кислот в моче, молекулярно-генетическое исследование, панель НБО.
На фоне проводимого лечения состояние оставалось очень тяжелым. Неврологический статус прежний: кома 3-й степени. Кожные покровы иктеричные, по данным биохимического анализа крови – гипербилирубинемия за счет прямой фракции.
Получены данные из лаборатории селективного скрининга (газовая хроматография образцов мочи) Медико-генетического научного центра (МГНЦ) им. академика Н.П. Бочкова: значительное повышение ряда метаболитов, органические ацидурии – данные могли носить вторичный характер или быть обусловлены рядом наследственных заболеваний (митохондриальная патология, наследственные болезни с поражением печени и т.д.). Тандемная масс-спектрометрия (ТМС) и ДНК-диагностика крови в работе.
Осмотр невролога: церебральная ишемия 3-й степени. Кома 3-й степени.
В плане обследования рекомендована МРТ головного мозга в условиях ОРИТН Московского областного перинатального центра.
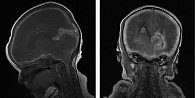
МРТ от 28 декабря: отек головного мозга с вклинением на уровне краниовертебрального перехода. Внутрижелудочковое кровоизлияние 3-й степени. Субарахноидальное кровоизлияние (САК) (рисунок).
28 декабря специалисты МГНЦ им. академика Н.П. Бочкова направили в ОРИТН-2 Видновского перинатального центра заключение ТМС (спектр ацилкарнитинов, аминокислот): повышение концентрации ацетилкарнитина (С2), изо-/бутирилкарнитина (С4) и гексаноилкарнитина (С6). Данные изменения могут наблюдаться при множественной недостаточности ацил-КоА дегидрогеназ. Проводится ДНК-диагностика.
Выявлена патология – глутаровая ацидурия 2-го типа.
С учетом анамнестических, клинических, инструментальных данных 29 декабря проведена врачебная комиссия о присвоении паллиативного статуса. В возрасте 52 суток жизни наступила смерть при явлениях нарастающего отека головного мозга. Родители отказались от вскрытия по религиозным причинам.
Диагноз клинический:
- основной: P91.0 – ишемия мозга 3-й степени. Гипоксически-геморрагическое поражение головного мозга. Отек головного мозга с вклинением на уровне краниовертебрального перехода. САК;
- осложнения: P91.5 – неонатальная кома 3-й степени;
- P90 – судороги новорожденного в анамнезе;
- P52.2 – внутрижелудочковое (нетравматическое) кровоизлияние 3-й степени у плода и новорожденного;
- P28.5 – дыхательная недостаточность у новорожденного 3-й степени;
- P29.8 – другие сердечно-сосудистые нарушения, возникшие в перинатальном периоде, купированы;
- конкурирующий: E88.8 – другие уточненные нарушения обмена веществ (глутаровая ацидурия 2-го типа, гипераммониемия);
- сопутствующие: P37.9 – врожденная инфекционная болезнь неуточненная (с поражением головного мозга, легких) в стадии разрешения:
- P60 – диссеминированное внутрисосудистое свертывание крови у плода и новорожденного, купировано (криопреципитат свежезамороженной плазмы – 9 и 15 декабря 2023 г.);
- P70.9 – преходящее нарушение углеводного обмена у плода и новорожденного неуточненное. Врожденный гиперинсулинизм (?);
- P05.0 – маловесный для гестационного возраста плод;
- P61.8 – анемия тяжелой степени (гемотрансфузия – 26 декабря 2023 г.)
Заключение
К сожалению, в представленном случае причина наследственного заболевания была выявлена, когда структуры мозга были подвержены тяжелым изменениям, а состояние ребенка не удалось компенсировать. Тем не менее определение причин подобных изменений позволило установить диагноз и провести в семье медико-генетическое консультирование для планирования беременности.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа выполнена без спонсорской поддержки.
Соблюдение прав пациентов и правил биоэтики. Родители ребенка не возражали против публикации данных из истории развития ребенка и его фотографии.
G.S. Golosnaya, PhD, T.N. Belousova, PhD, M.Yu. Novikov, PhD, N.Yu. Knyazeva, PhD, D.Yu. Podkopaev, Ye.G. Trifonova, D.A. Holichev, PhD, N.A. Yermolenko, PhD, Prof., O.N. Krasnorutskaya, PhD, Prof., K.A. Seleznev, A.A. Skobeltsyn
I.M. Sechenov First Moscow State Medical University
Vidnov Perinatal Center
N.N. Burdenko Voronezh State Medical University
Moscow Regional Perinatal Center
Contact person: Galina S. Golosnaya, ggolosnaya@yandex.ru
Glutaric aciduria type 2 (multiple acyl-CoA dehydrogenase deficiency; code according to the International Classification of Diseases of the 10th revision – E71.3) is a rare hereditary disease characterized by impaired metabolism of amino acids and fatty acids. The main clinical symptoms range from severe metabolic disorders in the neonatal period to mild course in the form of muscle weakness and respiratory failure in children and adults. The neonatal form without congenital malformations manifests itself during the first 48–72 hours of life. Presented a clinical case of type 2 glutaric aciduria diagnosed in the conditions of the Vidnovsky Perinatal Center. Considered the clinical picture of the disease from the first minutes of life, the course of the disease and complications.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.