Глюкозамин и хондроитина сульфат в терапии остеоартроза
- Аннотация
- Статья
- Ссылки
- English
Остеоартроз (ОА) – заболевание, которое клинически проявляется болью в суставах и неуклонным прогрессированием функциональных нарушений. ОА является основной причиной инвалидизации среди взрослого населения. В возрасте 60 лет и старше распространенность симптомного ОА коленных суставов составляет около 10% у мужчин и 13% у женщин. Риск развития клинически выраженного ОА возрастает до 60% у пациентов с индексом массы тела ≥ 30 кг/м². Общепризнанным считается факт влияния сопутствующих заболеваний на развитие и прогрессирование ОА с последующей инвалидизацией.
Нередко OA относят к дегенеративным заболеваниям суставов. Это не отражает истинной природы заболевания, поскольку ОА – процесс аномального ремоделирования тканей сустава, управляемый множеством медиаторов воспаления в пределах пораженного сустава. К наиболее распространенным факторам риска ОА относят возраст, пол, травмы, ожирение, генетическую предрасположенность, аномалии развития скелета.
Изменение структуры матрикса хряща рассматривается как приоритетное нарушение, определяющее степень снижения толерантности к нагрузке и исход заболевания. В настоящее время основные дискуссии разворачиваются вокруг первичности морфологических изменений при ОА и соответственно выбора точки приложения медикаментозного воздействия. Первое клиническое проявление ОА – нагрузочная боль. Поскольку хрящ не содержит нервных окончаний, причину боли при ОА принято объяснять поражением субхондральной кости, синовии и параартикулярных структур – связок и мышц. Морфологические изменения и прогрессирование ОА на много лет опережают клинические проявления болезни. Первичный рентгенологический признак ОА – сужение суставной щели, отражающее степень изменений в субхондральном хряще. Все структуры сустава последовательно вовлекаются в патологический процесс, что определяет полиморфизм заболевания. Характеристика суставного синдрома и степень прогрессирования ОА зависят от индивидуальных клинических, генетических особенностей пациента, калибра и количества суставов, вовлеченных в деструктивный процесс, сопутствующих заболеваний.
Многообразие клинических проявлений, быстрота формирования функциональных нарушений и инвалидизации больных ОА определяют интенсивность исследований в данной области ревматологии. Ведущие ревматологические ассоциации рекомендуют врачам общей практики и ревматологам использовать на ранних стадиях болезни нефармакологические методы лечения в комбинации с обезболивающей терапией. В основе терапии должны лежать изменение образа жизни и условий труда, укрепление мышц, использование вспомогательных устройств. Данный подход улучшает функцию суставов и качество жизни пациента за счет уменьшения боли и в минимальной степени способен изменить скорость прогрессирования ОА. Эффективная обезболивающая терапия (анальгетики или нестероидные противовоспалительные препараты (НПВП)) характеризуется высокой частотой побочных эффектов и может сопровождаться дестабилизацией сопутствующих заболеваний (артериальная гипертония, ишемическая болезнь сердца, функциональные и органические расстройства желудочно-кишечного тракта).
На поздних стадиях в качестве основных методов рассматриваются ортопедические и хирургические вмешательства, призванные изменить степень сформированных функциональных нарушений. Основными проблемами остаются скорость прогрессирования ОА и восстановление поврежденных структур сустава. Воздействию на метаболизм хряща и субхондральной кости принадлежит главная роль в медикаментозной терапии ОА. Согласно клиническим и наблюдательным исследованиям имеются неоспоримые доказательства эффективности препаратов медленного действия – так называемых хондропротекторов.
Как показали результаты клинических исcледований, глюкозамин [1, 2] и хондроитина сульфат [3, 4] облегчают симптомы ОА [5], что, вероятно, обусловлено их противовоспалительными свойствами. Тем не менее клиническая эффективность этих препаратов остается предметом дискуссий [4, 6]. Расхождения в оценке хондропротекторов связаны с развитием первичного и вторичного процессов, генетическими различиями включенных в анализ подгрупп населения, разнородностью клинических форм, объединенных в единую нозологию – ОА.
Эффективность использования глюкозамина в виде двух химических форм – сульфата и гидрохлорида исследовалась in vivo на моделях и в клинических исследованиях. Особое внимание уделялось фармакокинетике, побочным реакциям, сходству и различию эффектов представленных форм глюкозамина, а также их комбинаций с хондроитина сульфатом. Большинство эффектов глюкозамина наблюдалось при использовании глюкозамина сульфата. Обе соли глюкозамина ингибируют влияние интерлейкина (ИЛ) 1-бета, ядерного фактора каппа B (nuclear factor-kappa B, NF-κB), индуцируемой формы синтетазы оксида азота, циклооксигеназы-2, следствием чего являются противовоспалительные эффекты в культуре тканей [7]. Кроме того, глюкозамина гидрохлорид ингибирует активность металлопротеиназ, что определяет его противовоспалительные эффекты [8].
Глюкозамина гидрохлорид протестирован в комбинации с хондроитина сульфатом в эксперименте. Противовоспалительные эффекты и ингибирование катаболических реакций показаны при использовании как монотерапии глюкозамином, так и в комбинации с хондроитина сульфатом, что продемонстрировало их синергетический эффект [9].
Глюкозамина сульфат и гидрохлорид в модели коллагениндуцированного ОА оценивали по влиянию на деградацию хряща, воспаление синовиальной оболочки, костную резорбцию. Глюкозамина сульфат не влиял на формирование остеофитов при гистологической оценке. Между тем глюкозамина гидрохлорид значительно снижал прогрессирование формирования новых костных структур, ассоциированное с ингибированием продукции провоспалительного ИЛ-6 и индукцией противовоспалительного ИЛ-10 в синовиальной оболочке [10]. Влияние глюкозамина гидрохлорида в комбинации с хондроитина сульфатом на уменьшение боли и прогрессирование ОА в эксперименте подтверждено различными исследователями [11]. По результатам исследований in vitro и in vivo обе формы глюкозамина показали достоверное влияние на состояние тканей сустава при ОА. Однако на данном этапе невозможно сделать вывод о преимуществах отдельных химических форм препарата [7].
Систематический обзор, являющийся основой для рекомендаций OARSI (Osteoarthritis Research Society International – Международное научно-исследовательское общество по проблемам остеоартрита) по лечению ОА тазобедренных и коленных суставов, в последнем обновлении основан на результатах 19 плацебоконтролируемых исследований. В 16 из них использовали препараты глюкозамина сульфата (в 13 – пероральную форму, в 2 – внутримышечную и в 1 – внутрисуставную), в 3 – глюкозамина гидрохлорид. Обзор показал, что препараты глюкозамина обладали умеренной симптоматической эффективностью, значимые различия в эффекте между формами препарата отсутствовали [12]. Результаты исследований с использованием глюкозамина гидрохлорида были однородными, а исследования с применением глюкозамина сульфата имели несопоставимые для сравнения критерии протокола.
По результатам метаанализов глюкозамин признан безопасным лекарственным средством. Тем не менее о некоторых потенциальных побочных эффектах забывать не стоит. Первый и наиболее очевидный – аллергическая реакция при непереносимости моллюсков в анамнезе. Кроме того, глюкозамина сульфат присутствует в препарате в сочетании с натрия хлоридом, количество которого достигает 30% суточного потребления соли. Это касается прежде всего пациентов с артериальной гипертонией [13]. Наконец, глюкозамин способен влиять на метаболизм глюкозы и вызывать инсулинорезистентность [14]. Именно поэтому при длительном лечении пациентов с сахарным диабетом следует контролировать состояние углеводного обмена. Очевидно, что необходимы дальнейшие исследования для определения долгосрочных эффектов глюкозамина в отношении чувствительности к инсулину.
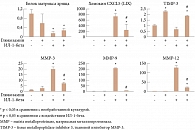
Предполагается, что эффективность терапии глюкозамином и хондроитина сульфатом более высокая при прогрессирующем течении ОА, у пациентов с выраженными болевыми ощущениями, которые определены эффектами ИЛ-1-бета. В исследовании J.N. Gouze и соавт. (2006) глюкозамин блокировал ИЛ-1-индуцированную экспрессию матричных протеаз, таких как ММР-3, ММР-9, ММР-10, ММР-12, ADAMTS-1, провоспалительных цитокинов, хемокинов, факторов роста, что может объяснять клинические эффекты препарата (рис. 1) [15].
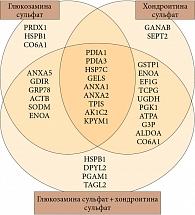
Для изучения предполагаемых внутриклеточных мишеней глюкозамина и хондроитина сульфата, а также влияния на метаболизм хряща V. Calamia и соавт. (2010) был проведен спектрометрический анализ белков в культуре хондроцитов в условиях экзогенного присутствия глюкозамина и/или хондроитина сульфата при ИЛ-1-бета-стимуляции [16]. Выделено 35 белков, отвечавших за передачу сигнала, энергетический потенциал клетки, синтез, окислительно-восстановительные и обменные процессы в хондроцитах. Отдельно выделены белки, модулируемые воздействием глюкозамина или хондроитина сульфата либо их совместным присутствием (рис. 2). В культуре хондроцитов при сочетанном воздействии глюкозамина и хондроитина сульфата отмечен синергетический эффект двух составляющих. Некоторые из белков – HSPB1, DPYL2, PGAM1, TAGL2 – синтезируются в хондроцитах только при совместном использовании глюкозамина и хондроитина сульфата. Показано, что 25% белков, модулируемых глюкозамином, участвуют в передаче сигнала, 15% – в окислительно-восстановительных реакциях и стресс-ответе, 25% – в синтезе белка. В то же время хондроитина сульфат влияет в основном на производство энергии (31%) и метаболические функции (13%), снижая уровень экспрессии анализируемых белков.
Исследование продемонстрировало не только возможность использования указанных белковых структур как маркеров эффективности лечения ОА, но и влияние данных препаратов на фундаментальные аспекты метаболизма хондроцитов.
Под влиянием хондроитина сульфата увеличивается синтез гиалуроновой кислоты в синовиоцитах [17]. Последние метаанализы подтвердили значимое влияние хондроитина сульфата на замедление темпов утраты хряща при ОА [18, 19].
В ряде клинических исследований проанализирована обоснованность комбинированного приема хондроитина сульфата и глюкозамина. Основным показателем эффективности терапии стало 20%-ное уменьшение боли в коленных суставах от исходного уровня в течение 24 недель. В отличие от комбинированного приема глюкозамина гидрохлорида и хондроитина сульфата, монотерапия этими препаратами достоверно не отличалась от терапии плацебо по влиянию на динамику минимальной боли. Но для пациентов с умеренной и сильной болью в начале исследования скорость наступления эффекта (критерии OMERACT-OARSI (Outcome Measures in Rheumatoid Arthritis Clinical Trials – оценка исходов ревматоидного артрита в клинических исследованиях)) была значительно выше при комбинированной терапии [20].
Скорее всего противоречия в результатах исследований по эффективности препаратов хондроитина сульфата и глюкозамина в клинической практике объясняются интерпретацией полученных данных. Так, в Северной Америке сульфат или гидрохлорид глюкозамина, хондроитина сульфат считаются нутрицевтиками, в то время как в большинстве европейских стран они продаются в качестве лекарственных средств. Таким образом, производство и реализация хондропротекторов в Европе осуществляется в соответствии со стандартами, разработанными для фармакологических препаратов. По результатам анализа сырья в Северной Америке были получены данные, свидетельствующие о различиях в содержании действующего вещества [21]. Наиболее значимые результаты (исследование GAIT (Glucosamine/chondroitin Arthritis Intervention Trial – Исследование применения глюкозамина/хондроитина при артрите)) были получены в клинических исследованиях комбинированных форм хондроитина сульфата натрия с глюкозамина гидрохлоридом. Авторы объясняют это увеличением биодоступности препаратов. Однако этот вопрос требует дальнейшего изучения.
Следует отметить, что некоторые препараты глюкозамина содержат дополнительные соли или соединения, способные влиять на метаболизм глюкозамина [22]. Кроме особенностей продукта исследования, на результаты исследования безусловно влияет его дизайн и популяция пациентов, включенных в анализ [23].
Кокрановская база данных систематических обзоров по глюкозамину включает 20 исследований с участием 2570 пациентов. Последовательная оценка качества доказательств, отношения «польза – риск» показала, что глюкозамин уменьшал боль и улучшал физическую функцию с очень низкой токсичностью и с уровнем доказательности от умеренной до высокой [24]. Результаты исследования рентгенологического прогрессирования ревматоидного артрита на фоне приема глюкозамина продемонстрировали положительную динамику ширины рентгеновской суставной щели через 36 месяцев терапии. У пациентов с менее тяжелыми рентгенологическими изменениями коленных суставов получена более значимая морфологическая динамика при приеме глюкозамина. Кроме того, как было показано ранее, глюкозамин облегчал симптомы ОА независимо от базовой ширины суставной щели у пациентов с остеоартритом коленных суставов I и II рентгенологической стадии [25]. Вместе с тем, если в течение 6 месяцев эффект от хондропротективной терапии отсутствует, следует пересмотреть необходимость ее дальнейшего проведения.
Использование глюкозамина и хондроитина сульфата не изменяет уровень эстрадиола в сыворотке крови больных раком молочной железы, в связи с чем оценивается как безопасный подход в контролировании боли в суставах, вызванной приемом ингибитора ароматазы [26]. Десятилетнее проспективное наблюдение когорты из 76 904 мужчин и женщин, использовавших глюкозамин и хондроитина сульфат, продемонстрировало 35–45%-ное снижение риска аденокарциномы. Причем максимальное снижение риска было связано с интенсивным использованием глюкозамина [27].
Эффективным и безопасным препаратом в лечении больных ОА признан препарат Терафлекс, 1 капсула которого содержит 500 мг глюкозамина гидрохлорида и 400 мг хондроитина сульфата. В состав препарата Терафлекс Адванс кроме глюкозамина гидрохлорида и хондроитина сульфата входит ибупрофен (в 1 капсуле – 100 мг). Комбинация глюкозамина и ибупрофена обеспечивает синергетический обезболивающий эффект, в связи с чем использование малых доз НПВП позволяет достигать выраженного клинического эффекта. Это крайне важно на начальных этапах терапии ОА, когда обезболивание является приоритетным направлением в улучшении качества жизни пациента. Снижение дозы НПВП с сохранением эффективности терапии особенно важно для популяции больных старших возрастных групп с высоким уровнем коморбидности. Применение препарата Терафлекс Адванс повышает приверженность лечению и снижает лекарственную нагрузку.
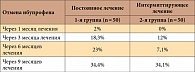
Терапевтическая активность препарата Терафлекс имеет собственную доказательную базу. Как показали результаты открытого исследования, проведенного в Институте ревматологии РАМН, к концу 3-го месяца лечения снижался уровень боли, скованности, улучшался функциональный статус больных. Треть пациентов к 12 месяцам терапии отказались от приема ибупрофена независимо от режима приема препарата Терафлекс (постоянного или курсового). Таким образом, интермиттирующая терапия препаратом Терафлекс (3 месяца – лечение, 3 месяца – перерыв) и постоянный прием препарата характеризовались одинаковой эффективностью в отношении влияния на боль, функцию суставов, снижение дозы применяемых НПВП и длительность последействия (таблица) [28]. Исследование комбинированной формы Терафлекса с ибупрофеном продемонстрировало хорошую переносимость, быстрое уменьшение боли, превышающее по скорости эффект изолированного использования Терафлекса или ибупрофена. Терафлекс Адванс рекомендован для лечения больных ОА в момент инициации терапии с последующим переводом пациентов на форму Терафлекса без НПВП [29].
Таким образом, возможности лечения больных с ОА включают препараты, улучшающие качество жизни с минимальным риском побочных эффектов. Класс хондропротекторов, рекомендованный Международными комитетами EULAR (European League Against Rheumatism – Европейская противоревматическая лига) и OARSI для лечения ОА, содержит хондроитина сульфат, соли глюкозамина в виде монотерапии или в комбинации. Использование этих лекарственных форм позволяет снизить боль, улучшить функциональные возможности больного ОА. Структурно-модифицирующий эффект выражается главным образом в замедлении рентгенологического прогрессирования заболевания.
Разработка новых лекарственных средств, позволяющих контролировать боль и влияющих на структурные составляющие сустава как органа при ОА, – задача крайне сложная. В настоящее время применение препаратов с высокой доказательной базой эффективности и безопасности на доклиническом уровне, в клинических исследованиях позволяет изменить исходы болезни и считается приоритетным.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.