Глютен-ассоциированная патология: в фокусе пациенты с синдромом раздраженного кишечника
- Аннотация
- Статья
- Ссылки
- English


Выращивание зерновых культур вошло в жизнь человека около 10 000 лет назад и постепенно приобрело глобальные масштабы. В настоящее время злаки являются важной составляющей рациона многих людей во всем мире и обеспечивают более 50% суточного потребления калорий. С продовольственной точки зрения наиболее распространенными зерновыми культурами считаются пшеница, кукуруза, рис. При этом возможность получать высокие урожаи в широком диапазоне географических условий (от 67° северной широты в Скандинавии до 45° южной широты в Аргентине) сделала пшеницу основным источником питания в конце 20-го столетия на фоне экспоненциального роста мирового населения. Интересен и тот факт, что аналогичная тенденция наблюдается во многих странах Азии, Ближнего Востока и Северной Африки, где традиционно отдавалось предпочтение рису [1, 2].
Высокое потребление пшеницы объясняется не только хорошей адаптивностью культуры к условиям окружающей среды, но и свойствами самого зерна, которые позволяют перерабатывать его для приготовления разнообразных продуктов питания. Хлеб, хлебобулочные и макаронные изделия на основе пшеницы вносят существенный вклад в потребление белка, пищевых волокон, минералов (особенно железа, цинка и селена), витаминов [2].
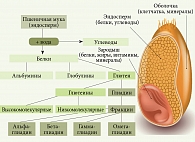
Зерно пшеницы состоит из углеводов (60–65%), липидов (1–2%), белков (10–14%) и воды (рис. 1). Среди углеводов 80% приходится на долю крахмала, 20% составляют неперевариваемые олигосахариды – фруктаны и галактаны. Глютен представлен сложной смесью различных белков, которые разделяют на структурные – глютенины и запасные – глиадины (пролины). Глютенины встречаются в двух формах – фракциях с высокой и низкой молекулярной массой, глиадины – в виде альфа-, бета-, омега- и гамма-глиадинов. По своей химической структуре глютен пшеницы очень похож на белки ржи (секалин) и ячменя (гордеин). Не случайно термин «глютен» в медицинской литературе часто используется как общий термин для обозначения белков этих злаков. Пшеница также содержит неглютеновые белки – ингибиторы амилазы и трипсина (ATI) [3].
Несмотря на многие полезные свойства продуктов из пшеницы, их употребление может быть ассоциировано с развитием целиакии, аллергии на пшеницу и глютеновой чувствительности, не связанной с целиакией (ГЧНЦ) (таблица). Согласно данным отдельных эпидемиологических исследований, распространенность глютен-ассоциированной патологии в популяции достигает 5–6%, причем истинная распространенность может быть намного выше [4, 5].
Клинические проявления глютен-ассоциированной патологии представлены широким спектром симптомов как со стороны пищеварительного тракта, так и со стороны других органов и систем. Как правило, такие симптомы связаны с употреблением в пищу продуктов из пшеницы и исчезают на фоне безглютеновой диеты. Основными жалобами пациентов с глютен-ассоциированной патологией являются абдоминальная боль, повышенное газообразование и нарушение стула. Указанные симптомы схожи с таковыми при синдроме раздраженного кишечника (СРК) [6–8]. В действующих национальных и международных рекомендациях по диагностике и лечению СРК предусмотрено проведение скрининга на целиакию у пациентов с преобладанием диареи или смешанным вариантом нарушения кишечной моторики [6, 8–10]. Однако очевидно, что этого не всегда достаточно, поскольку, во-первых, спектр заболеваний, ассоциированных с глютеном, не ограничивается целиакией, а во-вторых, серологические маркеры целиакии не обладают абсолютной чувствительностью и специфичностью.
В статье представлены имеющиеся в современной литературе сведения о глютен-ассоциированной патологии на примере пациентов с синдромом раздраженного кишечника и возможных способах дифференциальной диагностики данных состояний в реальной клинической практике.
Целиакия
Целиакия представляет собой аутоиммунное заболевание, характеризующееся диффузной атрофией слизистой оболочки тонкой кишки, которая возникает в ответ на употребление глютена у генетически предрасположенных лиц. 95% пациентов с целиакией имеют специфическую генетическую восприимчивость, которая связана с генами основного комплекса гистосовместимости (HLA) DQ2 и/или DQ8 [5, 11].
Глютен плохо ферментируется в пищеварительном тракте человека. Глютенины и глиадины подвергаются частичному пищеварению в верхних отделах пищеварительного тракта, в результате чего образуются различные нативные пептиды, устойчивые к действию эндогенных протеаз [3]. При употреблении пациентом с целиакией глютен-содержащего продукта непереваренные глютеновые пептиды проникают в подслизистую оболочку тонкой кишки, где подвергаются дезаминированию ферментом трансглутаминазой 2, также известной как тканевая трансглутаминаза (tTG). Дезаминированные глютеновые пептиды характеризуются высоким сродством с молекулами HLA-DQ2 и/или HLA-DQ8 на антигенпрезентирующих клетках, в результате чего происходит активация Т-лимфоцитов [12, 13]. В свою очередь из активированных Т-клеток высвобождается большое количество провоспалительных цитокинов (интерферон гамма, фактор некроза опухоли альфа, интерлейкин 2), которые повреждают энтероциты и приводят к поражению кишечника, типичному для целиакии (рис. 2) [12].
Глобальная распространенность целиакии составляет приблизительно 1% и продолжает неуклонно расти, что может быть связано не только с повышением потребления продуктов из пшеницы в связи с переходом на западный стиль жизни, но и с более высоким содержанием глютена в зернах современных сортов пшеницы, полученной в результате селекции [14]. Кроме того, изменение технологии приготовления хлебобулочных и кондитерских изделий, в частности, за счет сокращения времени брожения теста также привело к увеличению доли глютена в конечном продукте [13, 14].
Самая высокая распространенность целиакии в мире (5,6%) зарегистрирована среди африканского населения, проживающего в Западной Сахаре [1, 2]. Ранее целиакия считалась болезнью детского возраста. Сегодня имеются сведения о дебюте заболевания во всех возрастных группах. В 20% случаев диагноз впервые выставляется лицам, достигшим 60 лет.
Спектр клинических проявлений целиакии достаточно широк и варьируется от классической формы с типичными гастроинтестинальными жалобами в виде диареи, абдоминальной боли, вздутия живота, стеатореи, потери веса и признаков синдрома мальабсорбции до атипичной формы с преобладанием внекишечных симптомов, таких как усталость, анемия, остеопороз, герпетиформный дерматит, неврологические расстройства, депрессия, бесплодие и гипоплазия зубной эмали. Симптомы могут проявляться во всевозможных сочетаниях и различной степени выраженности, тогда как у ряда пациентов вообще отсутствуют какие-либо проявления заболевания. Целиакия может сочетаться с другими аутоиммунными заболеваниями – сахарным диабетом 1-го типа, аутоиммунным тиреоидитом, воспалительными заболеваниями кишечника, болезнью Аддисона, системной красной волчанкой [4, 5, 12]. Имеются также данные о повышении риска развития лимфомы и, как следствие, общей смертности в популяции больных целиакией [1, 12].
Нередко клинические симптомы у пациентов с целиакией соответствуют диагностическим критериям СРК. В ряде исследований показано, что распространенность целиакии среди лиц, у которых изначально диагностировали СРК, варьируется от 0 до 31,8%, но в большинстве случаев, по-видимому, находится в пределах 0,4–4,7% [15, 16]. На основании этих результатов многие научные сообщества рекомендовали исключать целиакию у всех больных с подозрением на СРК в случае преобладания диареи (СРК-Д) или смешанным вариантом нарушения моторики. В качестве скрининга на целиакию предложено проводить серологическое тестирование с определением антител иммуноглобулина (Ig) класса A или G к тканевой трансглутаминазе (tTG) и дезаминированному глиадиновому пептиду (DGP), обладающих наиболее высокой чувствительностью и специфичностью [6, 17, 18]. Нередко у пациентов при положительном результате на tTG наблюдается отрицательный результат на DGP или наоборот, что увеличивает время установления диагноза от начала появления симптомов, которое при целиакии составляет от 5,1 до 11,7 года. Антиглиадиновые антитела (AGA) имеют хорошую чувствительность, но низкую специфичность в отношении целиакии. AGA обнаруживаются у 12–15% здоровых лиц и 5–17% пациентов с СРК, не вызывая при этом никаких клинических проявлений [4, 18, 19]. Для подтверждения диагноза следует провести эндоскопическое исследование со взятием биоптатов залуковичного отдела двенадцатиперстной кишки. Типичными морфологическими признаками целиакии являются гиперплазия крипт и атрофия ворсинок тонкой кишки [5, 18].
Единственный метод лечения целиакии – строгое пожизненное соблюдение безглютеновой диеты, которая подразумевает отказ от продуктов из пшеницы, ржи и ячменя [5, 18]. Интересно, что у некоторых пациентов с целиакией, соблюдающих строгую безглютеновую диету, сохраняются СРК-подобные симптомы. По имеющимся данным, 20–38% пациентов с целиакией на фоне безглютеновой диеты предъявляют жалобы, соответствующие Римским критериям СРК [1, 3]. Несмотря на соблюдение безглютеновой диеты, у пациентов с целиакией, у которых сохраняются СРК-подобные симптомы, качество жизни более низкое, чем у тех, у кого симптомы контролируются диетой [20]. Было высказано предположение, что у части пациентов целиакия и СРК могут сосуществовать. Тем не менее более вероятно, что у ряда пациентов с целиакией даже на фоне безглютеновой диеты сохраняется воспаление слабой степени активности, подобное таковому при постинфекционном СРК (ПИ-СРК) [21].
Аллергия на пшеницу
Аллергия на пшеницу обусловлена IgE-опосредованной аллергической реакцией на белки пшеницы и нередко схожих с нею злаков – ячменя и ржи [2, 3]. Спектр белков пшеницы, которые могут быть вовлечены в развитие аллергической реакции, достаточно широк и охватывает глиадины, глютенины, серпины, тиоредоксин, агглютинин и ATI [22]. Употребление продуктов из пшеницы приводит к появлению типичных признаков пищевой аллергии, включая кожные, гастроинтестинальные и респираторные симптомы. Аллергия на пшеницу также может проявляться в форме профессиональной бронхиальной астмы (астмы пекаря), аллергического ринита, контактной крапивницы и тяжелых проявлений аллергии, вплоть до анафилаксии [23].
Распространенность аллергии на пшеницу во всех ее формах составляет приблизительно 4%, среди детей достигает 2–9% [24]. У детей аллергия на пшеницу обычно наблюдается в сочетании с атопическим дерматитом. У взрослых наиболее распространенной формой пищевой аллергии на пшеницу считается связанная с физической нагрузкой анафилаксия, когда симптомы возникают на фоне физической активности после употребления пшеницы. Гастроинтестинальные симптомы обычно слабо выражены и представлены диареей и вздутием живота [23].
Аллергия на пшеницу диагностируется на основании выявления повышенного уровня специфического IgE к компонентам пшеницы. Скарификационные или провокационные пробы в связи с риском развития тяжелых осложнений в настоящее время используются редко. Единственный способ лечения аллергии на пшеницу, как и при целиакии, – строгая безглютеновая диета, исключающая употребление белков, содержащихся в пшенице, ячмене и ржи [22].
Глютеновая чувствительность, не связанная с целиакией
ГЧНЦ определяется как синдром, характеризующийся различными кишечными и внекишечными симптомами после приема глютен-содержащих продуктов у лиц без целиакии или аллергии на пшеницу [25]. Данный термин считается несколько спорным из-за того, что глютен, вероятно, не единственный белок, участвующий в развитии симптомов. Нередко в литературе вместо термина ГЧНЦ используются другие: непереносимость глютена, непереносимость пшеницы, нецелиакийная чувствительность к глютену. Общая распространенность ГЧНЦ в популяции неизвестна. Причин несколько. Во-первых, многие люди самостоятельно отказываются от продуктов, содержащих глютен. При этом часть из них просто следуют моде, не имея на то клинических показаний, а часть, напротив, отмечают симптомы при употреблении глютена, но не обращаются к врачу для исключения другой глютен-ассоциированной патологии [18, 26]. Во-вторых, в настоящее время отсутствуют единые унифицированные подходы к диагностике ГЧНЦ. Предполагается, что лиц с ГЧНЦ значительно больше, чем тех, кому поставлен диагноз целиакии или аллергии на пшеницу [15, 21, 26]. ГЧНЦ, по-видимому, охватывает часть населения в диапазоне от 0,6 до 13% и чаще встречается у женщин молодого возраста [27].
Несмотря на то что ГЧНЦ получила широкое признание только в последнее время, впервые данный феномен был описан в журнале Lancet еще в 1978 г. [28]. A. Ellis и B.D. Linaker описали клиническую историю 43-летней женщины, которую в течение двух лет беспокоили диарея, абдоминальная боль и вздутие живота. Результаты лабораторных и инструментальных методов исследования, включая морфологическую оценку состояния кишечника, находились в пределах нормы. Неоднократные курсы проводимой симптоматической терапии с применением спазмолитиков, антибиотиков и даже транквилизаторов не давали стойкого положительного эффекта. Пациентке эмпирически была рекомендована безглютеновая диета. Диарея прекратилась в течение четырех дней, позже уменьшились проявления других симптомов. При повторном введении в рацион глютен-содержащих продуктов симптомы сразу же возобновлялись. Первое клиническое исследование, свидетельствующее о положительном эффекте безглютеновой диеты в купировании абдоминальной боли и диареи у восьми пациенток с отсутствием целиакии, было опубликовано в 1980 г. [29].
Патогенетические механизмы, лежащие в основе ГЧНЦ, в настоящий момент полностью не раскрыты, за исключением отсутствия типичных иммунологических или аллергических реакций и очевидного повреждения кишечника, характерных для целиакии и аллергии на пшеницу. Сообщается, что около 50% лиц с ГЧНЦ имеют генотипы HLA-DQ2/HLA-DQ8 [27]. Примерно у 50% пациентов с ГЧНЦ в сыворотке крови обнаруживаются AGA IgA, но, как упоминалось ранее, они не являются специфичными [30]. У пациентов с ГЧНЦ имеет место повышенная продукция гена, регулирующего синтез белка плотных контактов клаудина 4, связанная со снижением T-регуляторных клеток, а также повышенная экспрессия Toll-подобного рецептора 2. Эти механизмы подтверждают, что в развитии ГЧНЦ важную роль играет врожденный иммунитет без участия адаптивного иммунитета в отличие от целиакии [31].
Высказывается предположение, что триггерами развития ГЧНЦ помимо глютена могут быть неглютеновые белки (ATI), а также ферментируемые олиго-, ди-, моносахариды и полиолы (FODMAP), содержащиеся в пшенице, ячмене и ржи [32].
Опубликованный E. Lionetti и соавт. в 2017 г. метаанализ 11 рандомизированных слепых плацебоконтролируемых исследований, оценивающих эффект повторного введения глютена у пациентов с подозрением на ГЧНЦ, показал, что истинная распространенность ГЧНЦ после провокации намного ниже, а процент рецидивов симптомов в группе глютена сопоставим с таковым в группе плацебо [33]. Эти результаты подтверждаются данными еще одного метаанализа J. Molina-Infante, A. Carroccio, согласно которому только у 16% пациентов с ГЧНЦ наблюдаются симптомы, специфичные для глютена, а 40% из этих пациентов имеют симптомы, похожие на эффект плацебо [34].
Впервые концепция о том, что положительный эффект безглютеновой диеты при ГЧНЦ действительно обусловлен изъятием пшеницы в целом, а не глютена, была выдвинута P. Nijeboer и соавт. в 2013 г. [35]. Одновременно с этим J.R. Biesiekierski и соавт. в перекрестном плацебоконтролируемом исследовании с участием пациентов с СРК-подобными симптомами, соблюдавших безглютеновую диету, установили, что данные симптомы не усугубляются при введении глютена, а уменьшаются при сокращении потребления продуктов с высоким содержанием FODMAP [36].
FODMAP представляют собой ферментируемые и плохо усваиваемые углеводы с короткой цепью. Продукты с высоким содержанием FODMAP имеют повышенную концентрацию фруктозы (яблоки, груши), лактозы (молоко и молочные продукты), фруктанов и фруктоолигосахаридов (пшеница, рожь, ячмень, лук, чеснок), полиолов (искусственные подсластители, сорбит), галактоолигосахаридов (бобовые, капуста). FODMAP не перевариваются и медленно абсорбируются в тонкой кишке, при этом обладают осмотической активностью, увеличивают содержание внутрипросветной жидкости. Поступая в толстую кишку, FODMAP подвергаются бактериальной ферментации, в результате чего образуется большое количество газа, который способствует растяжению стенки кишки и, как следствие, возникновению гастроинтестинальных симптомов [23, 32, 37].
Исследования in vivo и in vitro позволяют предположить, что ATI пшеницы также могут быть триггерами врожденного иммунного ответа посредством активации Toll-подобного рецептора 4 на моноцитах, макрофагах и дендритных клетках тонкой кишки, что в конечном итоге способно привести к воспалению низкой степени активности и развитию ГЧНЦ [38].
ATI представляют собой группу из пяти (или более) гомологичных низкомолекулярных белков, высокоустойчивых к протеолизу в кишечнике. Как известно, ATI являются основной причиной развития аллергии при так называемой бронхиальной астме пекарей и могут ухудшать симптомы у пациентов с уже имеющимися аутоиммунными заболеваниями. Глютен составляет 80–90% общего белка в пшенице, в то время как на долю ATI приходится не более 2–4%. При среднем потреблении пшеничной муки (150–250 г/сут) количество поступающих в организм ATI не превышает 0,5–1 г. В эндосперме зерна пшеницы ATI сосуществуют с сетью глютеновых белков. Поэтому продукты, не содержащие глютен, не содержат и ATI [4, 35, 39]. Для подтверждения роли ATI в развитии ГЧНЦ необходимы дополнительные исследования.
Клинические проявления ГЧНЦ схожи с таковыми при СРК. Пациенты с ГЧНЦ часто предъявляют жалобы на абдоминальную боль, вздутие живота, изменение привычной деятельности кишечника (диарея, запор, чередование запора и диареи), а также различные внекишечные симптомы, включая головную боль, фибромиалгию, усталость, беспокойство, снижение внимания, боль в суставах, нарушение сна, депрессию, кожную сыпь и дерматит [25, 27, 30]. Внекишечные симптомы не связаны с известными механизмами действия FODMAP. Скорее всего они объясняются специфической реакцией на глютен [25, 27, 32]. Время появления симптомов после употребления глютен-содержащих продуктов обычно составляет от нескольких часов до нескольких дней [30].
Связь между ГЧНЦ и психоневрологическими расстройствами опосредована нарушением взаимодействия по оси «мозг – кишечник», где ключевая роль отводится повышенной кишечной проницаемости, когда глютеновые пептиды с кровотоком пересекают гематоэнцефалический барьер и негативно влияют на эндогенную опиоидную систему [30]. Взаимодействуя с опиоидными рецепторами головного мозга, глютеновые пептиды изменяют процессы нейротрансмиссии или запускают активацию иммунных клеток с развитием нейровоспаления. Имеются данные, что глютен может быть связан с депрессией, снижая выработку серотонина в кишечнике. Однако механизмы этого остаются неясными [40].
Из-за отсутствия специфических биомаркеров или морфологических критериев диагноз ГЧНЦ в настоящее время базируется прежде всего на субъективном мнении пациента о связи симптомов с употреблением глютен-содержащих продуктов при исключении целиакии и аллергии на пшеницу [27, 30]. Важно исключать целиакию, когда пациент еще не соблюдает безглютеновую диету [1, 5].
В октябре 2014 г. в г. Салерно (Италия) состоялась 3-я международная встреча экспертов по глютен-зависимой патологии для выработки консенсуса по диагностике ГЧНЦ. Наиболее обоснованным диагностическим подходом было признано тщательное стандартизированное наблюдение пациента на фоне исключения и последующего введения глютена в рацион питания. Диагноз подтверждается, когда у пациента на фоне отмены глютена отмечается улучшение по трем основным симптомам по крайней мере на 30% [30].
Для лечения пациентов с ГЧНЦ конкретных рекомендаций не существует. Как правило, рекомендуется безглютеновая диета. Однако очевидно, что индивидуальные уровни толерантности к глютену могут широко варьироваться [39].
Дискутабельным остается вопрос о продолжительности безглютеновой диеты. Следует отметить, что длительное соблюдение безглютеновой диеты без контроля специалиста может привести к дефициту потребления клетчатки и микронутриентов – тиамина, фолата, витамина А, магния, железа и кальция [41]. Нередко пациентам с ГЧНЦ назначают диету с низким содержанием FODMAP, которая также может привести к недостаточному потреблению пищевых волокон и кальция. Кроме того, ограничение поступления фруктанов и галактанов, обладающих пребиотическими свойствами, может изменить состав кишечной микробиоты и спровоцировать развитие гастроинтестинальных симптомов [23, 32].
Около 84% пациентов с СРК сообщают о связи симптомов с приемом определенных продуктов, а пищевая непереносимость рассматривается в качестве одного из ключевых факторов патогенеза заболевания [6–8, 42, 43]. M.I. Vazquez-Roque и соавт. в 2013 г. продемонстрировали, что гастроинтестинальные симптомы могут быть вызваны глютеном у больных СРК-Д [16]. У пациентов с СРК-Д при употреблении глютен-содержащих продуков отмечалось большее количество дефекаций, чем когда они придерживались безглютеновой диеты. При этом ухудшение симптомов было наиболее заметным у лиц с выявленным гаплотипом HLA-DQ2/HLА-DQ8. Пациенты, употреблявшие глютен, имели пониженную экспрессию zonula occludens 1 и более высокую проницаемость слизистой оболочки кишечника.
Последующие исследования также подтвердили, что ограничение потребления глютен-содержащих продуктов в течение 4–8 недель уменьшает кишечную проницаемость и количество дефекаций у пациентов с СРК-Д [3]. A. Fritcher-Ravens и соавт. c помощью конфокальной лазерной эндомикроскопии продемонстрировали увеличение расстояния между эпителиоцитами тонкой кишки после употребления глютена у 13 из 22 пациентов с СРК, у которых целиакия и аллергия на пшеницу были исключены. Кроме того, все пациенты, включенные в исследование, сообщили о длительном (более 12 месяцев) улучшении самочувствия на фоне безглютеновой диеты [44].
Современные данные свидетельствуют о том, что симптомы СРК улучшаются на фоне безглютеновой диеты примерно у половины пациентов. Однако механизмы, лежащие в основе благоприятного эффекта безглютеновой диеты при СРК, связаны в большей степени не с уменьшением количества глютена, а со снижением потребления FODMAP в составе продуктов, содержащих глютен (пшеница, рожь, овес). Показано, что диета с низким содержанием FODMAP уменьшает симптомы СРК в 80% случаев [3, 47]. Содержание фруктанов в 100 г безглютенового хлеба (из риса или кукурузы), хлеба из белой пшеничной муки и хлеба из спельтовой муки составляет 0,19, 0,68 и 0,14 г соответственно. Кроме того, в отличие от пшеницы спельтовая мука содержит на 16% меньше белка (в основном глютена). Высока вероятность, что углеводные компоненты пшеницы чаще вызывают симптомы при СРК. Поэтому именно продукты из спельты представляются лучшей альтернативой пшенице по сравнению с безглютеновой диетой, которая широко используется пациентами с СРК [45, 46].
Заключение
Клинические проявления заболеваний, ассоциированных с глютеном, представлены широким спектром симптомов как со стороны пищеварительного тракта, так и со стороны других органов и систем. Как правило, такие симптомы связаны с употреблением в пищу продуктов из пшеницы, ячменя или ржи и купируются на фоне безглютеновой диеты. Основными жалобами пациентов с глютен-ассоциированной патологией являются абдоминальная боль, повышенное газообразование и нарушения стула, сходные с таковыми при СРК. Применение основанных на симптомах Римских критериев диагностики функциональных гастроинтестинальных расстройств может привести к тому, что глютен-ассоциированная патология будет расценена как СРК.
В действующих рекомендациях по диагностике и лечению СРК у пациентов с преобладанием диареи или смешанного варианта нарушения стула подчеркивается целесообразность проведения серологического скрининга на целиакию. Однако в настоящее время спектр глютен-ассоциированных заболеваний расширился и помимо целиакии включает аллергию на пшеницу и ГЧНЦ. Кроме того, определения в сыворотке крови специфических антител иногда недостаточно для исключения целиакии. В ряде случаев для подтверждения диагноза требуется проведение морфологического исследования биоптатов залуковичного отдела двенадцатиперстной кишки. Аллергия на пшеницу также должна быть исключена перед установлением диагноза СРК. Вероятно, именно лица с ГЧНЦ представлены в гетерогенной группе пациентов с СРК, которые отмечают связь своих жалоб с употреблением пшеницы и положительный эффект от безглютеновой диеты.
В то время как целиакия и аллергия на пшеницу являются заболеваниями с хорошо известными патофизиологическими механизмами, подходами к диагностике и лечению, ГЧНЦ остается предметом постоянных дискуссий. Для оптимизации терапевтической помощи пациентам с ГЧНЦ необходимо учитывать, что глютен скорее всего не единственный компонент пшеницы, способствующий появлению симптомов. В качестве потенциальных триггеров можно рассматривать FODMAP (фруктаны) и неглютеновые белки (ATI).
Информация о финансовой поддержке.
Грант Президента РФ для государственной поддержки молодых российских ученых (МК-1679.2020.7)
(соглашение № 075-15-2020-138 от 17 марта 2020 г.)
«Разработка превентивной индивидуализированной стратегии ведения больных с синдромом раздраженного кишечника».
Конфликт интересов.
Авторы заявляют об отсутствии конфликта интересов
O.V. Gaus, PhD, M.A. Livzan, PhD, Prof., D.V. Popello
Omsk State Medical University
Contact person: Olga V. Gaus, gaus_olga@bk.ru
Wheat is an essential part of the diet of many people around the world. Despite the many beneficial aspects of eating wheat products, they can be associated with the development of a variety of diseases. The spectrum of gluten-associated pathologies includes celiac disease, wheat allergy, and non-celiac gluten sensitivity (NCGS). The clinical symptoms of gluten-associated pathology are similar to those of irritable bowel syndrome (IBS). Diagnosis of celiac disease and wheat allergy is now straightforward. NCGS remains a diagnosis of exclusion due to the lack of specific biomarkers and standardized research methods. Many patients with IBS consider themselves gluten-sensitive and their symptoms are relieved by a gluten-free diet. Most likely it is NCGS that occurs in a heterogeneous group of patients with IBS. However it remains controversial whether the development of symptoms in this case is associated with gluten itself or with other components of wheat, such as non-gluten proteins and FODMAPs.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.