Гранулоцитарные колониестимулирующие факторы в профилактике фебрильной нейтропении
- Аннотация
- Статья
- Ссылки
- English


Введение
Миелосупрессия представляет собой главный дозолимитирующий вид токсичности системной химиотерапии. Фебрильная нейтропения вследствие химиотерапии – основная причина ухудшения качества жизни, требующая госпитализации и часто приводящая к развитию инфекционных осложнений и даже смерти. Фебрильная нейтропения нередко становится причиной редукций доз, удлинений междозовых интервалов, что не может не сказываться на эффективности лечения [1–4]. В свою очередь это ухудшает результаты лечения, снижает выживаемость, особенно при чувствительных опухолях [5–7].
Роль нейтропении в повышении риска серьезных инфекционных осложнений у пациентов, получающих противоопухолевое лечение, впервые была описана в середине 1960-х гг. В первых исследованиях примерно у 50% больных с уровнем нейтрофилов меньше 1000/мкл в течение не менее семи дней отмечались инфекционные осложнения [8]. Кроме того, установлена прямая зависимость между длительностью стоматита, катетерного воспаления и уровнем нейтрофилов [9]. Цитостатики не только снижают количество нейтрофилов, но и нарушают их функцию – хемотаксис и способность к фагоцитозу.
В настоящее время в клинике используют шкалу нейтропении [10] в зависимости от абсолютного числа нейтрофилов в 1 мм3 крови:
-
1-я степень: от нижней границы нормы до 1500 клеток;
-
2-я степень: < 1500–1000;
-
3-я степень: < 1000–500;
-
4-я степень: < 500 клеток.
Фебрильная нейтропения определяется снижением уровня нейтрофилов менее 1000/мм3 и однократным подъемом температуры тела до 38,3 либо 38°С в течение не менее одного часа [11]. Патогномоничными симптомами инфекции могут быть абсцесс, инфильтраты в легких при рентгенографии. Однако чаще лихорадка бывает единственным проявлением инфекции [12]. И наоборот, лихорадка может не наблюдаться при обезвоживании организма, на фоне применения глюкокортикостероидов, нестероидных противовоспалительных препаратов или при наличии Clostridium septicum [13].
Ряд исследователей считают, что риск фебрильной нейтропении и ее длительность обычно возрастают при первых курсах терапии [14–16].
Фебрильная нейтропения нередко требует госпитализации. Так, при лечении 761 (21,7%) пациента с неходжкинской лимфомой 165 больных были госпитализированы в связи с фебрильной нейтропенией. Чаще она наблюдалась в начале лечения (41% – во время первого курса и 22% – во время второго) [17].
К факторам риска развития фебрильной нейтропении относятся тип и количество миелосупрессивных агентов в схеме лечения, тип опухоли, характеристики больного, в частности пожилой возраст, сопутствующая патология [18–20]. Интенсификация режима (повышение дозы или уменьшение интервалов между циклами) неизбежно приводит к повышению риска фебрильной нейтропении. Вероятность ее развития при гемобластозах выше, чем при солидных опухолях [19, 21].
Мультинациональная ассоциация по поддерживающей терапии при раке (Multinational Association of Supportive Care in Cancer – MASCC) разработала показатели (более 21), которые учитываются при определении риска развития глубокой нейтропении и ее осложнений (включая смерть, кардиальные и респираторные нарушения, гипотензию, кровотечение и другие серьезные состояния). Суммарная оценка позволяет выбрать пациентов, нуждающихся в профилактической терапии с использованием колониестимулирующих факторов (КСФ), еще и с точки зрения экономической целесообразности [22].
Показатель смертности вследствие фебрильной нейтропении у онкологических больных колеблется, по разным данным, от 5 до 20%. Более высокий процент определяется сопутствующей патологией и инфекционными состояниями [23]. Лечение характеризуется высокой стоимостью, поскольку высока вероятность госпитализации и проведения массивной антибактериальной терапии. Например, в Испании стоимость лечения одного эпизода фебрильной нейтропении в 2009 г. составляла
3841 евро [24].
Назначение антибиотиков и препаратов гранулоцитарных КСФ (Г-КСФ) призвано предотвращать случаи фебрильной нейтропении, индуцированной цитостатиками [25]. Тем не менее антибиотики, назначенные с профилактической целью, могут вызывать побочные эффекты и формировать резистентность большинства возбудителей [26, 27]. Европейская организация по изучению и лечению рака (European Organization for Research and Treatment of Cancer – EORTC) не рекомендует антибиотикопрофилактику пациентам, получающим химиотерапию по поводу солидных опухолей и лимфом [20].
Гранулоцитарные колониестимулирующие факторы
КСФ представляют собой гликопротеиды, стимулирующие пролиферацию клеток – предшественников миелопоэза в костном мозге, их созревание и дифференцировку в клетки крови. Гранулоцитарно-макрофагальные КСФ (ГМ-КСФ) стимулируют дифференцировку нейтрофилов, макрофагов и эозинофилов. Г-КСФ ограничены конечной дифференцировкой нейтрофилов. При этом функциональная активность и продолжительность жизни зрелых нейтрофилов не отличаются от таковых, полученных в физиологических условиях [28].
Несколько метаанализов и системных обзоров подтвердили, что использование Г-КСФ в качестве первичной профилактики снижает риск развития инфекций, позволяет поддерживать проведение химиотерапии в полноценных дозах и использовать дозоинтенсивные режимы лечения [18, 20, 29, 30]. Это особенно важно при лечении пациентов с потенциально излечимыми опухолями, такими как рак молочной железы, рак легкого, колоректальный рак, неходжкинская лимфома, поскольку отсрочки курсов и редукции доз ассоциируются с ухудшением общей выживаемости [31–34].
Лекарственные препараты КСФ получены биотехнологическим путем, благодаря внедрению ДНК человека в клетки микроорганизмов. Полученная субстанция является белком, идентичным натуральному и обладающим заданными свойствами. В европейских клиниках доступны филграстим, ленограстим и пэгфилграстим, которые призваны снижать риск фебрильной нейтропении у пациентов с немиелоидными опухолями при проведении химиотерапии [35, 36].
С момента появления филграстима (Нейпоген) в 2006 г. стали доступны его дженерики (Теваграстим, Ратиограстим, Биограстим, Зарсио, Нивестим и др.). Они утверждены для клинического применения с показаниями, аналогичными таковым филграстима [37]. К тому же появление аналогов позволило снизить экономическую нагрузку на систему здравоохранения.
Основные клинические исследования
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration – FDA) одобрило филграстим в 1991 г. Он назначается в дозе 5 мкг/кг ежедневно подкожно до достижения нормальных значений абсолютного числа нейтрофилов. Это важно, поскольку абсолютное число нейтрофилов снижается на 50% в течение первых 48 часов после отмены ежедневных КСФ [38]. Период полувыведения филграстима из сыворотки примерно три с половиной часа, в связи с чем необходимы ежедневные введения. Филграстим может назначаться путем внутривенной 30-минутной инфузии в 5%-ном растворе глюкозы [35].
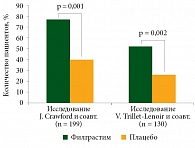
Эффективность и безопасность филграстима (5 мкг/кг) доказаны в двух исследованиях фазы III в Европе [39] и США [40]. Пациенты с мелкоклеточным раком легкого получали химиотерапию циклофосфамидом, доксорубицином и этопозидом. Они были рандомизированы на две группы: филграстима или плацебо ежедневно подкожно, начиная с 24-часового интервала после окончания химиотерапии в первом цикле и далее на протяжении всех циклов. Эффективность филграстима показана на рис. 1.
На фоне приема филграстима частота фебрильной нейтропении снизилась на 50% в обоих исследованиях. В США средняя длительность нейтропении 4-й степени во время первого цикла составила шесть дней в группе плацебо и три дня в группе филграстима [40]. Данные обоих исследований показали, что среднее количество введений препарата во время первого цикла химиотерапии – 9–14.
Пэгфилграстим
Пэгфилграстим был одобрен FDA для клинического использования в 2002 г. Пегилирование молекулы филграстима сделало ее большой, что привело к невозможности клубочковой фильтрации и обеспечило циркуляцию препарата до того момента, пока не образуется достаточное количество новых нейтрофилов. Комплекс «препарат + рецептор» подвергается фагоцитозу и деградации внутри самой клетки-нейтрофила, то есть обеспечивается саморегулирующийся клиренс. Эта особенность пэгфилграстима обеспечивает необходимую концентрацию самого препарата за одну инъекцию во время всего периода нейтропении. Что касается филграстима, для тех же целей необходимы ежедневные инъекции препарата [41].
Основные показания и рекомендации по использованию филграстима и пэгфилграстима отражены в табл. 1.
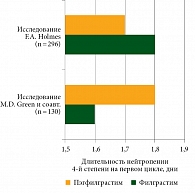
Эффективность и переносимость пэгфилграстима оценены в двух исследованиях фазы III, проведенных в Европе и США, у больных раком молочной железы. Пациентки получали адъювантную химиотерапию доцетакселом и доксорубицином. Всего четыре курса. Через 24 часа после введения цитостатиков больные получали пэгфилграстим и далее плацебо ежедневно подкожно или филграстим. Результаты обоих исследований подтвердили, что однократная инъекция пэгфилграстима на цикл так же эффективна, как 11 ежедневных инъекций филграстима, в предупреждении фебрильной нейтропении. Ее частота в обеих группах в европейском исследовании существенно не отличалась [42], однако в американском исследовании на фоне применения пэгфилграстима она снизилась в два раза по сравнению с использованием филграстима (9 против 18%, р < 0,005) (рис. 2) [43].
Как показали результаты нескольких метаанализов, пэгфилграстим эффективнее филграстима. Так, в 2008 г. G. von Minckwitz и соавт. [44] сообщили, что риск фебрильной нейтропении на фоне применения пэгфилграстима составил 7% (при использовании филграстима – 18%) у больных раком молочной железы, получавших химиотерапию по схеме «таксотер + доксорубицин + циклофосфан».
Похожий анализ представлен в 2009 г. [45]. Риск госпитализаций у пациентов, получавших различные режимы химиотерапии, на 33% ниже при использовании пэгфилграстима по сравнению с применением ежедневных КСФ.
В 2011 г. опубликован обзор пяти рандомизированных исследований [46], доказывающих снижение риска фебрильной нейтропении на фоне применения пэгфилграстима.
A. Naeim и соавт. [47] показали, что профилактика пэгфилграстимом снижает риск нейтропенических осложнений и госпитализаций. Более того, в клинической практике дозы филграстима не соответствуют рекомендованным: вместо 10–11 инъекций применяется четыре-пять. Именно поэтому исходы могут быть разными [48].
Использование ежедневных КСФ требует контроля анализов крови два раза в неделю.
Согласно международным рекомендациям, все Г-КСФ назначаются через 24 часа после введения последней дозы цитостатиков. Более быстрое или одновременное назначение химиотерапии и КСФ приводит к стимуляции миелоидного ростка, что способствует повышению токсичности цитостатиков [49]. Переносимость химиотерапии у больных раком молочной железы и неходжкинской лимфомой, которым пэгфилграстим назначали через 24 часа по окончании курса, была выше, чем при одновременном использовании, хотя данные статистически недостоверны [50]. Клинические результаты [51] свидетельствуют, что профилактическое назначение пэгфилграстима на четвертый день после химиотерапии так же эффективно, как и на второй день.
Рекомендации по профилактике фебрильной нейтропении
EORTC 20, ESMO 30 (European Society for Medical Oncology – Европейское сообщество медицинской онкологии), NCCN 18 (Comprehensive Cancer Network – Национальная онкологическая сеть), ASCO 29 (American Society of Clinical Oncology – Американское общество клинической онкологии) рекомендуют назначать профилактику Г-КСФ при проведении химиотерапии с риском развития фебрильной нейтропении ≥ 20% (табл. 2).
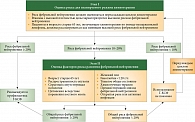
Индивидуальную оценку необходимости назначения КСФ надо проводить при назначении химиотерапии с риском фебрильной нейтропении 10–20%. То есть следует учитывать дополнительные риски, такие как возраст больного, сопутствующие заболевания и другие потенциальные состояния, способствующие нейтропеническим осложнениям, а также когда редукция доз нежелательна. На рисунке 3 приведен алгоритм определения необходимости первичной профилактики фебрильной нейтропении.
КСФ не показаны при паллиативном лечении и режимах с риском развития фебрильной нейтропении менее 10%, поскольку это экономически нецелесообразно. Только в рекомендациях NCCN [18] допускается вторичная профилактика для больных, получающих лечебную/адъювантную химиотерапию, когда фебрильная нейтропения с высокой долей вероятности может привести к серьезным осложнениям, включая смерть.
Поддержка КСФ особенно необходима при дозоинтенсивных режимах, то есть при уплотненных и высокодозных. Указанные выше руководства не рекомендуют профилактическое использование КСФ у пациентов, получающих химиолучевую терапию [18, 20, 29], поскольку повышается частота костномозговой супрессии, ассоциируемой с увеличением риска осложнений и смерти [30].
Использование КСФ при нефебрильной нейтропении. У пациентов с глубокой нейтропенией использование Г-КСФ не считается полезным [20, 30, 18, 29]. Рутинное применение КСФ при нефебрильной нейтропении снижает ее длительность, но не влияет на клинические исходы [52].
Использование КСФ при фебрильной нейтропении. Настоящие рекомендации EORTC [20], ESMO [30], NCCN [18], ASCO [29] и IDSA (Infectious Diseases Society of America – Американское общество инфекционных болезней) [12] не придерживаются рутинного назначения КСФ вместе с антибиотикотерапией при фебрильной нейтропении. Между тем в ряде руководств Г-КСФ рекомендованы части больным с повышенным риском инфекционных осложнений. В частности, в КСФ-поддержке нуждаются пациенты:
-
которые не отвечают на антибактериальную терапию и имеют угрозу развития сепсиса и септического шока (EORTC);
-
с длительной (> 10 дней) и глубокой (< 0,1 × 109/мм3) нейтропенией;
-
в возрасте старше 65 лет;
-
с неконтролируемыми сопутствующими заболеваниями, пневмонией, гипотензией, полиорганной недостаточностью, грибковой инфекцией (ASCO).
Влияние использования КСФ на выживаемость
По данному вопросу разные метаанализы демонстрируют противоречивые данные. Результаты 13 рандомизированных исследований показали отсутствие какого-либо влияния на общую выживаемость. Так, добавление Г-КСФ и ГМ-КСФ к антибиотикопрофилактике сокращает длительность нейтропении, лихорадки и госпитализации у больных с уже развившейся нейтропенией. Однако влияние на общий результат лечения незначителен [53].
Г-КСФ и ГМ-КСФ при лечении лимфом существенных изменений в показатели общей выживаемости или нарушения режима лечения не вносят, хотя нивелируют риск нейтропении и инфекционных осложнений [54].
Обзор NICE 2012 г., обобщающий метаанализы по первичной профилактике ГМ-КСФ, показал, что назначение данных препаратов не снижает непосредственную смертность, но уменьшает частоту фебрильной нейтропении приблизительно на один эпизод на каждые девять циклов химиотерапии при солидных опухолях и лимфомах и на каждые 13 циклов при лейкозах [27].
Другие 17 крупных рандомизированных исследований, напротив, продемонстрировали положительное влияние профилактического использования КСФ на выживаемость.
Системный обзор 2007 г. свидетельствует о значимом снижении риска инфекционной летальности и общей ранней смертности при профилактическом использовании Г-КСФ [55].
Согласно системному обзору 25 исследований 2010 г., химиотерапия совместно с КСФ снижает риск любой смертности на 3,4%. Эта выгода еще значительнее при дозоинтенсивной химиотерапии. Доказано повышение общей выживаемости за счет наилучшего контроля над болезнью благодаря КСФ [56].
Другой обзор, опубликованный в 2013 г., объединил данные 61 международного клинического исследования. Общий вывод: первичная профилактика Г-КСФ достоверно снижает вероятность редукций доз химиопрепаратов и нивелирует абсолютный риск любой смертности. Как и в обзоре 2010 г., снижение смертности значимо при проведении химиотерапии в высоких дозах и уплотненных режимах, особенно при раке легкого и лимфомах [57].
Основное различие между метаанализами касается общей выживаемости. В один обзор включены только исследования с Г-КСФ, в другой – и с Г-КСФ, и с ГМ-КСФ. Обзоры эффективности ГМ-КСФ против плацебо или Г-КСФ в уменьшении частоты фебрильной нейтропении и ее последствий доказывают отсутствие значимого снижения этого показателя при использовании ГМ-КСФ, что и объясняет меньшее влияние на выживаемость [58].
Переносимость и безопасность
Г-КСФ хорошо переносятся. Наиболее частые побочные эффекты – местное раздражение в зоне инъекции и боли в костях (у 20–30% больных), которые обычно хорошо купируются анальгетиками. Крайне редки сообщения о более серьезных последствиях. Имеются единичные сведения о таких осложнениях, как острый миелоидный лейкоз, миелодиспластический синдром, разрыв селезенки и блеомицин-обусловленная пульмональная токсичность [59].
По мнению некоторых онкологов, пэгфилграстим вызывает более частые артралгии. Вследствие этой неопределенности практикующими онкологами в отношении мышечно-скелетных болей при применении филграстима и пэгфилграстима был проведен отдельный анализ профиля переносимости данных препаратов.
В исследовании фазы III костные боли при использовании филграстима отмечались у 26–50% больных, а при применении пэгфилграстима – у 25–38%. Г-КСФ в обычной практике назначают ежедневно коротким курсом, далеко не после каждого курса химиотерапии, что делает переносимость филграстима лучше, чем пэгфилграстима. Хотя артралгии – самый частый побочный эффект этих препаратов, большинство исследователей отмечают, что в назначении нестероидных анальгетиков, как правило, нет необходимости [60].
В метаанализе 25 клинических исследований, объединившем свыше 12 000 пациентов, получавших различные режимы химиотерапии по поводу злокачественных новообразований, сообщается следующее. Острый миелобластный лейкоз и миелодиспластический синдром развивались у 43 больных, применявших Г-КСФ, против 22 больных, которые не получали данных препаратов. Таким образом, риск составил 1,92 (95%-ный доверительный интервал; 1,19–3,07, р < 0,05). Абсолютный риск повышен на 0,41%. Тем не менее общая смертность была ниже у пациентов, получавших поддержку КСФ [56].
Крайне редки наблюдения, касающиеся повышения риска пульмональной токсичности у больных, принимавших блеомицин. Так, при лечении лимфомы Ходжкина легочная токсичность наблюдалась у 19/74 (26%) больных при назначении КСФ (по сравнению с 6/67 (9%) больными, не получавшими КСФ-профилактику). Различия клинически значимы, р = 0,014 [61]. Однако такой зависимости не зафиксировано у пациентов с герминогенными опухолями, которые также получали схемы лечения, содержащие блеомицин [62].
КСФ-профилактика в клинической практике
Практический подход к назначению КСФ вариабелен. Так, результаты исследования в смешанной популяции больных раком легкого и колоректальным раком (n = 1849) показали, что в 96% случаев препараты КСФ назначали не в соответствии с клиническими рекомендациями [63].
В исследовании, включавшем 1347 больных, большая доля пациентов (45–80%) совсем не получала первичную профилактику нейтропении, хотя риск ее развития превышал 20% [64].
Данные клинических исследований подтверждают, что в среднем 11 ежедневных инъекций филграстима и его аналогов на один цикл химиотерапии эквивалентны одной инъекции пэгфилграстима для адекватного предупреждения нейтропении 4-й степени у пациентов с солидными опухолями и лимфомами [42, 43]. В среднем 16 инъекций необходимо пациентам с острыми миелоидными лейкозами [65]. В реальности большинство больных получают ежедневный курс КСФ, состоящий из пяти-шести инъекций, и частота развития фебрильной нейтропении и ее осложнений в такой ситуации выше, чем при назначении КСФ-профилактики в рекомендованном режиме [66, 67]. Доказано, что риск госпитализаций по поводу фебрильной нейтропении и ее осложнений у больных раком молочной железы, раком легкого и неходжкинской лимфомой снижается с каждым дополнительным днем приема филграстима [68].
В исследовании популяции больных раком молочной железы сравнивали применение одной дозы пэгфилграстима и 5–10 ежедневных инъекций Г-КСФ на каждом цикле химиотерапии. В результате частота фебрильной нейтропении на фоне применения неуластима составила 7%, а на фоне использования КСФ короткого действия – 18% [44].
Отметим, что даже временная задержка с назначением филграстима способна влиять на исходы лечения. В одном исследовании филграстим назначали через 24 часа после введения больших доз циклофосфамида. Частота фебрильной нейтропении составила 16%, длительность лечения около 11,5 дня. Другой части больных филграстим назначили через 96 часов после окончания химиотерапии. В этой группе пациентов частота фебрильной нейтропении составила 66%, лечение заняло 15,5 дня. Авторы отметили, что назначение КСФ более чем через 72 часа после последней дозы цитостатиков приводит к нарастанию фебрильных эпизодов, усилению антибактериальной терапии и значительно повышает стоимость лечения [66].
Сложно переоценить роль профилактического использования КСФ при дозоинтенсивных режимах. Особенно это касается больных, у которых химиотерапия предполагает полное излечение и исход лечения направлен на улучшение выживаемости (например, при раке молочной железы, неходжкинской лимфоме) [48]. Показано, что адъювантная химиотерапия улучшает общую выживаемость и беспрогрессивную выживаемость больных рецептор-негативным раком молочной железы [69], но не у рецептор-позитивных больных [70]. В то же время в ряде публикаций говорится, что у части пациентов интенсификация стандартных режимов химиотерапии не улучшает выживаемость [29]. Тем не менее редукция доз предпочтительна только у больных, получающих химиотерапию с паллиативной целью [18, 20, 30].
На сегодняшний день существует необходимость определения доказательной модели, устанавливающей достоверные факторы индивидуального риска развития нейтропенических осложнений у пациентов, получающих химиотерапию. Новейшие системные обзоры данной проблематики показывают статистическую значимость дополнительных прогностических факторов (тромбоцитопения, наличие центрального венозного катетера, длительность и глубина нейтропении), которые ранее не были включены в прогностическую модель [71]. Эти аспекты, равно как и данные фармакогеномных исследований, могут играть роль не только в прогнозировании эффективности системной химиотерапии, но и в предупреждении токсических эффектов и риска фебрильной нейтропении [72].
В настоящее время G.H. Lyman и соавт. [73] совершенствуют модель определения риска нейтропенических осложнений, используя большую проспективную когорту пациентов, которым будет назначена химиотерапия. Новшество этой модели заключается не только в проспективном дизайне и большой популяции исследуемых. Кроме индивидуальных факторов пациентов будут учтены такие детали химиотерапевтического лечения, как обеспечение препаратами, ранее проведенные режимы химиотерапии, нарушение функций печени и почек. Идентификация пациентов в соответствии с данной моделью позволит более прицельно определить когорту больных, для которых назначение сопутствующей терапии, в том числе Г-КСФ, наиболее экономически целесообразно. Это крайне важно, поскольку Г-КСФ считаются одним из пяти аспектов, благоприятствующих улучшению лечения и снижению затрат [74].
S.G. Bagrova
Russian Cancer Research Center named after N.N. Blokhin
Contact person: Svetlana Gennadyevna Bagrova, s.bagrova@mail.ru
Myelosuppression due to chemotherapy is a serious side effect that results in complications and lethal outcome. Primary prophylaxis based on administration of colony-stimulating factors in case of ≥ 20% risk of febrile neutropenia is stated in European and US guidelines on cancer treatment. The main factors determining risk of developing febrile neutropenia are regimen of chemotherapy, tumor type, patient’s age and comorbidities. This review covers the most significant clinical studies and updated recommendations regarding administration of granulocyte colony-stimulating factors upon using chemotherapy and their role in improving survival rate.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.