Группы риска по развитию неалкогольной жировой болезни печени: кому и как проводить скрининг
- Аннотация
- Статья
- Ссылки
- English




Данные о распространенности неалкогольной жировой болезни печени (НАЖБП) достаточно противоречивы. Вместе с тем прослеживается общая тенденция к росту числа пациентов с данной патологией. Эта ситуация прежде всего связана с различными методами, используемыми в исследованиях, неоднородными группами пациентов или когорт населения, включенных в скрининговые программы. По мнению экспертов, участвующих в составлении клинических рекомендаций от трех профессиональных ассоциаций Европы (Европейская ассоциация по изучению печени – European Association for the Study of the Liver (EASL), Европейская ассоциация по изучению диабета – European Association for the Study of Diabetes (EASD) и Европейская ассоциация по изучению ожирения – European Association for the Study of Obesity – EASO)) (2016 г.) [1], НАЖБП является самым распространенным заболеванием печени в странах Запада – 17–46% взрослого населения (различия обусловлены методом диагностики, половозрастными характеристиками, этнической принадлежностью).
По данным метаанализа, опубликованного в 2016 г. [2], распространенность НАЖБП в мире достигает 25%. Бессимптомное течение заболевания имеет место у 20–46% населения США [3, 4], прогрессирование – у 7% лиц без ожирения, чаще женщин, в отсутствие повышенной активности аминотрансфераз [5, 6].
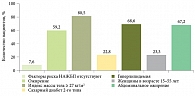
Самое крупное исследование распространенности НАЖБП в России DIREG 2 было проведено под эгидой Российской гастроэнтерологической ассоциации (РГА) в партнерстве с представительством фармацевтической компании «Санофи» в России [7, 8]. Установлено, что частота выявления НАЖБП за семь лет увеличилась более чем на 10% и достигла 37,3% (для сравнения: в 2007 г. этот показатель составлял 27%). При этом отмечается увеличение доли неалкогольного стеатогепатита (НАСГ) в структуре НАЖБП с 16,8 до 24,4%. Оценка факторов риска развития НАЖБП в России, согласно результатам исследования DIREG 2, представлена на рис. 1 [8].
Данные о структуре факторов риска развития НАЖБП в России согласуются с международными, что позволяет адекватно оценить группы риска, подлежащие скринингу на наличие этой патологии.
В соответствии с клиническими рекомендациями РГА и Российского общества по изучению печени (РОПИП) по диагностике и лечению НАЖБП [9], скрининг выявления НАЖБП показан среди пациентов с наличием доказанных ассоциированных состояний:
- ожирения;
- сахарного диабета 2-го типа;
- дислипидемии;
- метаболического синдрома.
Кроме того, риск НАЖБП увеличивается на фоне ассоциированных заболеваний, таких как синдром поликистозных яичников, гипотиреоз, синдром обструктивного апноэ сна, гипогонадизм, гипопитуитаризм, панкреатодуоденальная резекция, дефицит витамина D, а также на фоне применения тамоксифена [10].
В европейских рекомендациях определены ассоциированные состояния и клиническое течение НАЖБП с учетом фенотипов (подклассов) и приведены критерии метаболического синдрома (табл. 1) [1].
Опираясь на указанные данные, можно констатировать, что не только стеатогепатит представляет угрозу развития прогрессирующего заболевания печени. В поле зрения врача должны находиться собственно дистрофические изменения как фактор трансформации в гепатоцеллюлярную карциному. Не следует забывать о возможном сосуществовании НАЖБП и алкогольной жировой болезни печени. Наличие артериальной гипертонии рассматривается как фактор, определяющий проведение скрининга на наличие НАЖБП.
В целом информация соответствует положениям клинических рекомендаций РГА и РОПИП по диагностике и лечению НАЖБП [9] и клинических рекомендаций по ведению больных с метаболическим синдромом Минздрава России (2013 г.) [11]. Единственное исключение: в рекомендациях отсутствует оценка уровня липопротеинов низкой плотности. Кроме того, в европейских рекомендациях [1] детализированы некоторые группы пациентов, нуждающихся в перекрестном скрининге для выявления НАЖБП и нарушения углеводного обмена. Как видно из табл. 2 [1], группы первичного скрининга включают широкие слои населения с любыми метаболическими отклонениями и изменениями при ультрасонографическом исследовании печени, отвечающими критериям НАЖБП.
Тем не менее, исходя из данных о распространенности НАЖБП и подтвержденных фактов влияния образа жизни, характера питания, коморбидных состояний на развитие указанной патологии [12–14], группы для включения в скрининг расширяются в зависимости от разных факторов риска. Европейские эксперты [1] каждый фактор рассматривают очень подробно и выносят в отдельную рекомендацию. В таблицу 3 сведены подтвержденные доказательными исследованиями рекомендации для скрининга НАЖБП с учетом образа жизни, антропометрических данных, наличия фоновых или предположительно ассоциированных состояний.
Несмотря на то что генетический скрининг относится к факультативным программам, именно с этого раздела как перспективного направления начинается обсуждение. Роль генетических факторов развития и прогрессирования НАЖБП изучается. В ходе полногеномных исследований подтверждена ассоциация гена PNPLA3 c тяжестью заболевания [15, 16]. Аллель rs738409 гена PNPLA3 обусловливает восприимчивость к НАЖБП, влияет на гистологическую картину и развитие фиброза у детей и подростков с ожирением [17, 18], что нашло отражение в европейских рекомендациях (табл. 3) [1].
Обсуждается вопрос модифицирующего влияния гена TM6SF2 на течение НАЖБП с точки зрения ассоциации с сердечно-сосудистыми заболеваниями. Вполне вероятно, что скоро появится инструмент для стратификации риска заболеваемости печени [19, 20].
Особое внимание специалисты уделяют скринингу НАЖБП при ожирении (табл. 3), акцентируя внимание на том, что у пациентов с индексом массы тела > 30 кг/м2 (или > 25 кг/м2), но с накоплением висцерального жира или дисфункциональной жировой тканью может проявляться НАЖБП с отклонением от нормы ферментов печени или без такового [21–23].
В настоящее время механизмы взаимно отягощающего влияния НАЖБП и сердечно-сосудистых заболеваний рассматриваются как компоненты метаболического синдрома [24]. Доказано, что биохимические маркеры атеросклероза и преатерогенные поражения (увеличение толщины комплекса «интима – медиа», обызвествление коронарных артерий брюшной аорты и аортальных клапанов, эндотелиальная дисфункция) у пациентов с НАЖБП встречаются чаще, чем у лиц без стеатоза [25], в том числе у подростков [26, 27], и связаны с повышенным риском смерти от сердечно-сосудистых заболеваний в долгосрочной перспективе [28]. Эксперты сходятся во мнении, что при НАЖБП необходимо выявлять сердечно-сосудистые заболевания независимо от традиционных факторов риска. И наоборот: у лиц, подверженных высокому риску сердечно-сосудистых заболеваний, должен проводиться скрининг на НАЖБП (табл. 3).
Таким образом, можно отметить высокий уровень доказательности рекомендаций по формированию групп перекрестного всестороннего скрининга с учетом метаболических нарушений, сердечно-сосудистых заболеваний, изменений печени при ультрасонографическом исследовании, а также антропометрических характеристик, образа жизни и генетических рисков.
При рассмотрении особых групп в европейских рекомендациях [1] отмечается, что НАЖБП может быть связана с раком ободочной и прямой кишки, хронической болезнью почек при сахарном диабете 1-го типа [29], нарушением метаболизма костной ткани (дефицит витамина D, остеопороз) [30] и редкими болезнями обмена веществ (липодистрофия, болезнь накопления гликогена). Применение скрининга НАЖБП в качестве канцеропревенции вполне закономерно, если исходить из того, что НАЖБП считается вторым по важности показанием для пересадки печени вследствие гепатоцеллюлярной карциномы в США [31]. Однако четких указаний в этом отношении европейские эксперты не дают, ссылаясь на неопределенность экономической целесообразности.
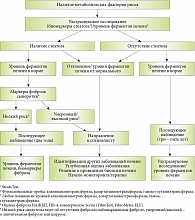
Перечень методов, предлагаемых для диагностики НАЖБП при скрининге, в рекомендациях РГА и европейских рекомендациях сопоставим и включает ультрасонографическое исследование, определение активности аминотрансфераз, показателей липидного спектра и углеводного обмена с оценкой инсулинорезистентности и ряд тестов исключения (табл. 4) [1]. Кроме того, предложен удобный алгоритм действий врача при диагностике НАЖБП (рис. 2) [1].
Следует отметить, что в рекомендациях РГА и РОПИП более подробно представлен спектр расширенных исследований, включающий те, которые позволяют исключить аутоиммунные заболевания печени, вирусные гепатиты, что облегчает работу врача при составлении программы обследования.
И еще один важный момент – требования к проведению пункционной биопсии, предлагаемой всем пациентам с НАЖБП для верификации стеатогепатита европейскими экспертами [1, 32, 33]. В рекомендациях РГА и РОПИП [9] показания к пункционной биопсии наиболее приближены к клинической практике и предусматривают:
- наличие неинвазивных критериев выраженного фиброза печени по данным эластометрии (плотность ткани печени > 9,3 кПа с использованием XL-датчика или > 9,6 кПа для обычного датчика или расчетных индексов (FIB-4, APRI, Hepascore и др.));
- отсутствие положительной динамики уровня активности аланинаминотрансферазы, аспартатаминотрансферазы, гамма-глутамилтранспептидазы при адекватном снижении веса и физических нагрузках у пациентов с ожирением;
- болезненность печени при пальпации;
- немотивированную слабость у пациентов с признаками стеатоза печени [33–36] (1B).
Таким образом, в клинических рекомендациях по диагностике и лечению НАЖБП, подготовленных РГА и РОПИП и группой профессиональных европейских ассоциаций, на высоком доказательном уровне показана важность проведения своевременного и всестороннего скрининга данной патологии печени.
На основании проспективных когортных рандомизированных исследований, а также метаанализов сформированы группы риска развития и прогрессирования НАЖБП и ассоциированных состояний, включая нозологии, требующие перекрестного скрининга с оценкой прогноза и мониторинга.
L.K. Palgova
Scientific and Educational Center for Gastroenterology and Hepatology of the Institute of High Medical Technologies of Saint-Petersburg State University
Contact person: Lyudmila Konstantinovna Palgova, L_Palgova@mail.ru
The article is devoted to the analysis of risk factors for the development of non-alcoholic fatty liver disease from the position of evaluation of groups for screening this pathology. The clinical recommendations of the Russian Gastroenterological Association and the Russian Society for the Study of the Liver for the Diagnosis and Treatment of Non-alcoholic Fatty Liver Disease (2015) and the combined clinical recommendations of the European Association for the Study of the Liver, the European Association for the Study of Diabetes and the European Association for the Study of Obesity (2016).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.