Ингаляционные глюкокортикостероиды для лечения бронхиальной астмы: в фокусе внимания мометазона фуроат
- Аннотация
- Статья
- Ссылки


Ингаляционные глюкокортикостероиды занимают важное место в лечении БА [1]. Они воздействуют именно на воспаление, а значит, уменьшают выраженность клинических симптомов заболевания (частоту приступов удушья, потребность в бета-2-агонистах короткого действия и др.), повышают качество жизни пациентов, улучшают бронхиальную проходимость, снижают гиперреактивность бронхов. Эти препараты предупреждают обострения астмы, уменьшают частоту госпитализаций и летальность от астмы, а также предупреждают развитие необратимых изменений дыхательных путей (ремоделирование).
Мометазона фуроат является хорошо известным топическим стероидом, который широко используется в терапии аллергического ринита, полипоза носа и риносинуситов (Назонекс), а также стероидочувствительных заболеваний кожи (Элоком, Элоком-С, Тридерм). В последние годы создана и стала доступна для российских пациентов его лекарственная форма для лечения БА – препарат Асманекс, выпускаемый в виде порошкового ингалятора (Твистхейлер).
Фармакодинамика мометазона фуроата
Мометазона фуроат – это синтетический гетероциклический 17-членный глюкокортикостероид (ГКС), содержащий в положении 17 эфир фуроата, а в 9-м и 21-м положениях – атомы хлора. В исследованиях in vitro установлено, что МФ снижает секрецию клеток, принимающих участие в развитии воспаления дыхательных путей (Т-хелперов, базофилов), тормозит экспрессию адгезивных молекул эпителием и активирует апоптоз эозинофилов. Выраженность противовоспалительного эффекта МФ in vitro аналогична таковой флутиказона пропионата и превышает эффекты будесонида, беклометазона дипропионата, триамцинолона ацетонида [2]. При проведении ингаляционного провокационного теста на мышах показано, что МФ достоверно снижает синтез интерлейкинов 4 и 5, а также число Т-хелперов в жидкости бронхоальвеолярного лаважа по сравнению с плацебо [3].
Механизмы противовоспалительной активности ГКС являются предметом интенсивных исследований. В 70-е годы прошлого века сформировалось представление о классической двухэтапной модели их действия. Согласно этой концепции, стероиды путем диффузии проникают в цитоплазму клетки и взаимодействуют с цитозольными (альфа-) рецепторами, которые в неактивном состоянии образуют комплексы с молекулами белков теплового шока (heat shock protein, hsp) hsp 90, 70, 23 и др. Последние необходимы для поддержания оптимальной конформации рецепторного домена, связывающего гормон. Они также обеспечивают нахождение свободного рецептора в цитоплазме клетки.
Образовавшийся комплекс «гормон – рецептор» перемещается в виде димера в ядро, где связывается с коактивирующими молекулами (белок, связывающий цАМФ-чувствительный элемент (cAMP responsive element binding protein, CBP), коактиватор стероидного рецептора 1 (steroid-receptor co-activator 1, SRC-1) и др.) и чувствительным элементом генов (геномный эффект). Таким образом в клетках активируются процессы транскрипции (транс-активация) генов и образование белков, обладающих противовоспалительным эффектом.
В последние годы установлено, что гормон-рецепторные комплексы (в виде мономера) непосредственно и через молекулы СBP взаимодействуют с факторами транскрипции (активирующий белок 1 (activating protein 1, AP-1), ядерный фактор каппа-B (nuclear factor (NF) kappa-B) и др.), которые активируются под влиянием медиаторов воспаления, оксидантов и вирусов (внегеномный эффект). Итогом этого является торможение транскрипции «воспалительных» генов (транс-репрессия). Последнее, в свою очередь, уменьшает образование в клетках белков и пептидов, обладающих провоспалительным эффектом.
Таким образом, в настоящее время сложились представления о геномном и внегеномном эффектах ГКС, в том числе и МФ. Следует отметить, что за счет непосредственного взаимодействия с ДНК ГКС могут оказывать неблагоприятное действие на обмен веществ. Именно поэтому одним из направлений дальнейшего совершенствования этого класса лекарственных препаратов является создание средств с преимущественно внегеномным механизмом действия.
Установлено, что МФ имеет более высокое сродство к глюкокортикостероидным рецепторам, чем флутиказона пропионат (в 1,5 раза), будесонид (в 5 раз), триамцинолона ацетонид (в 7 раз) и дексаметазон (в 12 раз). В эксперименте показано, что МФ в низких концентрациях (10-12) обладает преимущественно внегеномным эффектом, уменьшая образование в клетках белков, обладающих противовоспалительным действием [4]. Последнее, вероятно, является одним из объяснений высокой безопасности этого ГКС (см. ниже).
Фармакокинетика мометазона фуроата
Фармакокинетика МФ изучалась у экпериментальных животных (мышей, крыс, собак), а также здоровых людей и больных БА при однократном и многократном введении препарата в cуточных дозах от 200 до 1200 мкг, назначаемых 1–2 раза в день ингаляционно или внутривенно. Установлено, что легочная депозиция МФ при использовании дозированного ингалятора составляет 13,9% [5]. Системная биодоступность 400 мкг МФ при применении порошкового дозирующего устройства у 24 здоровых волонтеров оказалась менее 1%, причем не было найдено различий между этим показателем у мужчин и женщин. При последующем назначении концентрация препарата в плазме крови была близка к порогу его определения (0,02–0,24 мкг/л). Установлено, что при использовании порошкового ингалятора значительная часть МФ проглатывается и выводится в неизменном виде с фекалиями. Фракция, которая всасывается в кишечнике, достигает печени, интенсивно метаболизируется системой цитохрома Р450 до полярных соединений и экскретируется с желчью и мочой. При внутривенном введении 400 мкг МФ период его полувыведения у здоровых лиц составляет 4,5 часа, системный клиренс – 53,5 л/час, что сходно с фармакокинетическими параметрами других ИГКС [6].
Системная биодоступность МФ в дозах 400, 800 и 1200 мкг 1 раз в сутки и 200 мкг 2 раза в день изучалась у 60 больных БА легкого и среднетяжелого течения в двойном слепом плацебоконтролируемом исследовании, продолжавшемся 28 дней. У большинства пациентов концентрация препарата в плазме крови была ниже порога ее определения. Аналогичные данные были получены при назначении МФ в дозе 400 мкг 1 и 2 раза в сутки в течение 15 дней у 24 больных астмой легкого и среднетяжелого течения [7].
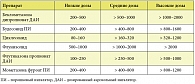
Показатели фармакокинетики ИГКС приведены в таблице 1 [8–11]. Из таблицы видно, что МФ относится к числу препаратов с низкой системной биодоступностью. Это имеет важное значение для его безопасности при использовании в высоких дозах у больных астмой (см. ниже).
Важной особенностью МФ является его высокая степень связывания с белками плазмы – 99% (для сравнения, у будесонида связывание с белками составляет 85%, у беклометазона дипропионата – 87%, у флутиказона пропионата – 90%), что уменьшает вероятность развития системных эффектов при его использовании у больных.
Приведенные выше результаты исследований свидетельствуют о том, что МФ – это ГКС с выраженной противовоспалительной активностью и минимальным системным действием. Низкая системная биодоступность может быть обусловлена как свойствами самой молекулы (например, наличие эфира фуроата), так и особенностями комплекса «МФ – лактоза», обеспечивающими замедленное всасывание препарата. Полученные данные убедительно доказывают возможность использования МФ в качестве средства для лечения заболеваний дыхательных путей, и в частности БА. При ингаляционном введении адсорбция препарата из дыхательных путей и пищеварительной системы низкая (табл. 1) [8–11]. Поступившая часть МФ подвергается интенсивному первичному метаболизму в печени и, вероятно, в стенке кишечника. Исследования in vitro показали, что МФ не метаболизируется в легочной ткани крыс и мышей. У крыс, кроликов, собак и людей МФ превращается в печени в полярные соединения. Основным путем его метаболизма, вероятно, является 6-бета-гидроксилирование, гидролиз эфира фуроата и замещение атома хлора в 21-м положении гидроксильной группой.
Клинические исследования мометазона фуроата Твистхейлера
Для лечения астмы и хронической обструктивной болезни легких (ХОБЛ) создан порошковый ингалятор, содержащий МФ и лактозу в соотношении 1:5,8 (Твистхейлер). Активация ингалятора осуществляется вдохом больного при скорости 20–60 л/мин – такую скорость вдоха способны развивать дети старше 4 лет и взрослые больные БА различной тяжести течения. Доказательства этого получены в 6 многоцентровых плацебоконтролируемых исследованиях, в которые были включены 109 пациентов с астмой, обученных пользованию Твистхейлером [13].
Твистхейлер представляет собой порошковый ингалятор, содержащий 60 доз МФ. Устройство имеет счетчик доз, что позволяет больному и врачу контролировать прием препарата. Стимулом для поступления порошка в канал для ингаляций является снятие крышки устройства. Это приводит к загрузке одной дозы МФ. Достоинством Твистхейлера является простота его использования, включающего всего 3 движения: снять крышку устройства – сделать вдох – закрыть крышку. Благодаря этому обучение пациентов занимает немного времени [14].
Твистхейлер обеспечивает высокую воспроизводимость доз МФ, получаемую больным при повторных ингаляциях из одного устройства, что удовлетворяет требованиям Управления по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration, FDA), фармакопей США и европейских стран. Примерно 30–35% дозы МФ составляют частицы размером 1–5 мкм, который является оптимальным для доставки препарата в мелкие бронхи [15].
Эффективность и безопасность Асманекса Твистхейлера изучались в многоцентровых клинических исследованиях, проводившихся в странах Европы, Латинской Америки, Канаде, США и Мексике. В них участвовало более 4000 больных (возраст 4–83 года) легкой, среднетяжелой и тяжелой БА, из которых более 3400 человек получали Аcманекс Твистхейлер в течение 3–12 месяцев в дозах 200–1600 мкг/cутки [8]. Клинические программы предусматривали наблюдение за пациентами с астмой, «стероиднаивных» и принимавших ранее ИГКС, а также больными гормонозависимой астмой. Для оценки эффективности препарата использовали динамику симптомов болезни (приступы затрудненного дыхания, ночные пробуждения от астмы, использование бета-2-адреномиметиков короткого действия, время до начала ухудшения астмы и др.), показатели функции легких (объем форсированного выдоха за первую секунду (ОФВ1), форсированная жизненная емкость легких (ФЖЕЛ), скорость потока выдыхаемого воздуха на уровне 25–75% ФЖЕЛ, пиковая экспираторная скорость выдоха) и качества жизни. У больных гормонозависимой БА оценивали изменение потребности в пероральных ГКС. Изучалось влияние МФ на гиперреактивность бронхов в провокационных пробах с аллергенами, аденозинмонофосфатом и метахолином. Проводилось сравнение МФ с другими ИГКС (беклометазона дипропионатом, будесонидом, флутиказона пропионатом) [8, 12].
Для исследования безопасности МФ оценивали частоту местных и системных побочных эффектов, влияние препарата на продукцию кортизола (по концентрации в плазме крови в течение 24 часов, а также в тесте стимуляции надпочечников синтетическим адренокортикотропным гормоном), внутриглазное давление, прозрачность хрусталика, плотность костной ткани и скорость роста у детей.
Одной из основных задач клинических программ являлось исследование возможности использования Асманекса Твистхейлера 1 раз в сутки вечером. Основанием для его однократного применения вечером явилось следующее [12]:
- высокое сродство МФ к глюкокортикостероидным рецепторам, что может обеспечить длительное противовоспалительное действие в дыхательных путях;
- возможность повышения приверженности пациентов лечению и, как следствие, эффективности лечения;
- наличие циркадных ритмов бронхиальной проходимости и снижение ее у больных БА в ночное время.
Эффективность мометазона фуроата при бронхиальной астме
В двойных слепых плацебоконтролируемых исследованиях показано, что МФ в дозах 50, 100 и 400 мкг, назначаемый дважды в cутки в течение 6–14 дней, достоверно снижал гиперреактивность бронхов при пробах с аллергенами (раннюю и позднюю астматическую реакцию), метахолином и аденозинмонофосфатом, а также эозинофилию мокроты у больных БА легкого течения [16, 17]. Это подтверждает способность МФ подавлять воспаление дыхательных путей.
При назначении Асманекса Твистхейлера в течение 12 недель у 236 больных БА легкого и среднетяжелого течения, получавших до включения в исследования только бета-2-адреномиметики короткого действия, оказалось, что доза 400 мкг 1 раз в сутки утром по сравнению с дозой 200 мкг и плацебо достоверно уменьшает выраженность симптомов астмы, потребность больных в сальбутамоле, вызывает прирост показателей бронхиальной проходимости (увеличение ОФВ1 на 11,5–18,6% по сравнению с 8,5–16,5% в группе пациентов, получавших МФ в дозе 200 мкг, и 0,1–5,1% в группе плацебо) [18]. Похожие результаты были получены и в другом исследовании, причем оказалось, что эффективность МФ в дозе 400 мкг 1 раз сутки аналогична таковой при его назначении 200 мкг 2 раза в день [19]. Bажно отметить, что достоверный прирост пиковой объемной скорости выдоха и сокращение потребности в сальбутамоле наблюдались уже через 24 часа после начала лечения [18, 19]. При дальнейшем наблюдении за больными оказалось, что положительные эффекты обеих доз МФ (200 и 400 мкг в сутки) сохранялись в течение 12 месяцев, при этом назначение препарата вечером было более эффективным, чем утром [20].
Большинство исследований МФ были проведены у больных, которые ранее получали ИГКС, причем эффективность и безопасность МФ сравнивали как с плацебо, так и с другими препаратами класса ИГКС.
В двойном слепом плацебоконтролируемом исследовании, включавшем 286 пациентов с БА легкого и среднетяжелого течения старше 12 лет, оценивалась возможность однократного назначения МФ в течение 12 недель. Показано, что Асманекс Твистхейлер в дозах 200 мкг 1 раз в день вечером и 400 мкг 1 раз в день утром достоверно улучшал бронхиальную проходимость по сравнению с МФ 200 мкг 1 раз в день утром и плацебо [21]. В других работах подтверждена более высокая эффективность применения МФ в дозе 400 мкг однократно вечером у больных, получавших ранее другие ИГКС 2 раза в день. Положительное влияние МФ на выраженность клинических симптомов и бронхиальную обструкцию отмечалось в течение первой недели лечения. Улучшение клинико-функционального состояния больных сочеталось с повышением качества их жизни [8, 22].
У 128 больных с тяжелой гормонозависимой БА назначение Асманекса в дозах 400 и 800 мкг 2 раза в день в течение 12 недель по сравнению с плацебо приводило к достоверному улучшению качества жизни и уменьшению потребности в пероральных ГКС (на 46% и 24% соответственно), причем у 40% пациентов удалось полностью отменить ГКС. Несмотря на снижение дозы ГКС, у больных отмечался существенный прирост показателей бронхиальной проходимости. Эффективность МФ в дозах 400 мкг и 800 мкг 2 раза в день была одинаковой. При дальнейшем наблюдении в течение 9 месяцев полной отмены пероральных ГКС к концу года удалось добиться у 71% больных, получавших 400 мкг 2 раза в день, и у 62% пациентов, принимавших 800 мкг 2 раза в день, что сочеталось с улучшением качества их жизни. В течение этого периода времени в группе плацебо потребность в системных стероидах увеличилась на 164,4% [23].
Аналогичные данные были получены в другом исследовании, включавшем 123 больных тяжелой гормонозависимой астмой [24]. В обоих работах показана стероидсберегающая активность МФ, причем доза 800 мкг 2 раза в день оказалась столь же эффективна, как и 400 мкг 2 раза в день.
В 5 исследованиях показано, что Асманекс Твистхейлер в дозах 200 мкг и 400 мкг 2 раза в день, назначаемый в течение 12 недель, был более эффективен, чем будесонид (Пульмикорт Турбухалер, 400 мкг 2 раза в день, число наблюдавшихся больных – 730) и беклометазона дипропионат (дозированный ингалятор, 168 мкг 2 раза в день, количество пациентов – 227) [25–28]. Эффективность МФ (200 мкг 2 раза в сутки) и флутиказона пропионата (Фликсотид Дискхалер, 250 мкг 2 раза в день, количество включенных в исследование больных – 733) была одинаковой [29].
Таким образом, приведенные выше результаты исследований свидетельствуют о том, что МФ уменьшает выраженность клинических симптомов, улучшает качество жизни, бронхиальную проходимость и снижает гиперреактивность бронхов у пациентов с БА различной тяжести течения. Для улучшения приверженности пациентов лечению и упрощения режима лечения предложен однократный прием препарата. Полученные данные позволяют рекомендовать в качестве стартовой дозы Асманекса Твистхейлера 400 мкг 1 раз в сутки вечером у больных астмой легкой и средней тяжести, получавших до его назначения бета-2-адреномиметики короткого действия или другие ИГКС. При достижении контроля за течением болезни доза препарата может быть снижена до 200 мкг 1 раз в сутки вечером. У пациентов с тяжелой БА начальная доза МФ должна составлять 400 мкг 2 раза в день. Его длительный прием приводит к сокращению потребности в пероральных ГКС или дает возможность их полной отмены. Эквивалентные дозы МФ и других ИГКС приведены в таблице 2 [1].
Безопасность мометазона фуроата
В нескольких работах изучалось влияние различных доз МФ на продукцию кортизола надпочечниками у больных БА и ХОБЛ. Для этого использовались 2 чувствительных метода: исследование концентрации кортизола плазмы в течение 24 часов после назначения МФ, а также тест стимуляции надпочечников синтетическим адренокортикотропным гормоном (косинтропином). Известно, что изменение суточной концентрации кортизола плазмы является индикатором его базальной секреции, а проба с косинтропином позволяет оценить функциональный резерв надпочечников.
У 60 больных БА легкого и среднетяжелого течения изучалось влияние Асманекса Твистхейлера (400, 800, 1200 мкг 1 раз в сутки, а также 200 мкг 2 раза в сутки) и плацебо в течение 28 дней на состояние оси «гипоталамус – гипофиз – надпочечники». Показано, что применяемые дозы МФ не оказывают существенного влияния на базальную секрецию кортизола и резерв надпочечников в тесте с косинтропином через 7, 14 и 28 дней лечения [30].
В другом наблюдении 64 пациента с астмой среднетяжелого течения получали МФ в дозах 400 мкг, 800 мкг 2 раза в сутки, преднизон 10 мг 1 раз в сутки или плацебо в течение 28 дней. Установлено, что средняя концентрация кортизола в плазме крови в течение 24 часов у больных, получавших Асманекс Твистхейлер в дозе 400 мкг 2 раза в день (800 мкг в сутки), существенно не отличалась от таковой в группе пациентов, принимавших плацебо, на 28-й день лечения. Снижение уровня кортизола крови в среднем на 21% по сравнению с плацебо отмечалось только у больных, получавших МФ в дозе 800 мкг 2 раза в день (общая доза 1600 мкг в сутки). Это снижение было достоверно менее выраженным, чем у пациентов, получавших 10 мг преднизона (64%) [8]. Следует помнить, что максимальная зарегистрированная доза Асманекса как при БА, так и при ХОБЛ составляет 800 мкг в сутки, это доза, при которой системных побочных эффектов не наблюдалось.
При наблюдении за больными БА, получавшими МФ в дозах 200 мкг 2 раза в день, 400 мкг 2 раза в день, 800 мкг 1 раз в день в течение 1 года, не обнаружено изменений концентрации кортизола плазмы крови и функционального резерва надпочечников в тесте с косинтропином [31].
Не выявлено отрицательного влияния МФ в дозах до 800 мкг в сутки на внутриглазное давление, прозрачность хрусталика и плотность костной ткани (поясничный отдел позвоночника, бедренная кость) у больных БА и ХОБЛ при наблюдении в течение 1 года [8]. Долгосрочные исследования не показали изменения скорости роста детей с БА при лечении этим препаратом [32, 33].
Местные побочные эффекты МФ, назначаемого в дозах 200–400 мкг в день в течение 1 года больным БА в возрасте от 12 до 83 лет, включали развитие кандидоза полости рта (2–6%), дисфонии (0–2%), фарингита (3–7%). Их частота была аналогичной или меньшей, чем при использовании других ИГКС (табл. 3) [21, 22, 26, 27]. Близкие данные получены у пациентов с ХОБЛ, лечившихся МФ в дозе 800 мкг/сутки или плацебо в течение года [8].
Частота тяжелых побочных эффектов у больных БА и ХОБЛ, получавших Асманекс Твистхейлер и плацебо, была сходной. По мнению врачей, участвующих в 19 исследованиях, эти побочные эффекты непосредственно не были связаны с лечением. Число пациентов, прекративших прием препаратов, было сходным среди больных, получавших МФ, плацебо и другие ИГКС.
Беременные и кормящие женщины исключались из клинических исследований. Если беременность наступала в процессе лечения МФ, то применение препарата прекращалось. Тем не менее концентрация препарата в плазме крови при ингаляционном введении обычно очень низкая, что делает его влияние на плод и репродуктивную функцию маловероятным. Применение Асманекса Твистхейлера во время беременности и у кормящих матерей возможно только в том случае, если предполагаемая польза для матери превышает потенциальный риск для плода или ребенка (категория С FDA).
Режим дозирования мометазона фуроата Твистхейлера
У больных БА легкого и среднетяжелого течения стартовая доза Асманекса Твистхейлера должна составлять 400 мкг 1 раз в сутки вечером. У некоторых пациентов предпочтительно назначение препарата в дозе 200 мкг 2 раза в день. При достижении контроля за течением астмы (при нормальной легочной функции и минимальном использовании бета-2-адреномиметиков короткого действия) в ряде случаев возможно использование 200 мкг 1 раз вечером. Однократный прием препарата повышает приверженность лечению у больных БА молодого возраста и подростков [34].
У больных тяжелой гормонозависимой БА в начале лечения МФ назначают по 400 мкг 2 раза в день. Доза системных ГКС должна быть постепенно уменьшена, при этом осуществляется контроль за симптомами БА и надпочечниковой недостаточности. После полной отмены пероральных стероидов доза МФ должна быть снижена до минимальной эффективной.
Соотношение «польза/риск»
Благодаря выраженной противовоспалительной активности МФ и его эффективной доставке в легкие с помощью порошкового ингалятора препарат способен обеспечивать контроль БА в относительно невысоких дозах. Риск системных побочных эффектов минимален из-за низкой биодоступности МФ. Это подтверждается результатами клинических исследований, в которых проводилось физикальное, лабораторное исследование, оценка функции гипоталамо-гипофизарно-надпочечниковой системы и скорости роста у детей. Частота местных побочных эффектов (осиплости голоса, сухости в горле, кандидоза) при ингаляционном применении МФ была низкой и сопоставимой с таковой у других ИГКС. Полученные данные свидетельствуют о высоком терапевтическом индексе МФ (то есть соотношении эффективности и безопасности) у больных персистирующей БА различной тяжести течения.
Заключение
Асманекс Твистхейлер является порошковым ингалятором, содержащим МФ и лактозу, предназначенным для лечения взрослых и детей (в России – в возрасте 12 лет и старше). Он одобрен для лечения астмы более чем в 40 странах мира [35]. При ингаляционном пути введения концентрация, поступающая в кровь, мала. МФ плохо всасывается из желудочно-кишечного тракта и подвергается интенсивному первичному печеночному метаболизму. При применении в рекомендованных дозах концентрация препарата в плазме находится около или ниже порога определения. Это обеспечивает высокую противовоспалительную активность в дыхательных путях при минимальной вероятности развития системных побочных эффектов. Возможность применения препарата один раз в сутки и простое в применении ингаляционное устройство, не требующее координации движений и специальных навыков пациента, повышают приверженность больных терапии и делают лечение удобным для пациентов.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.