Инсомния и риск острого нарушения мозгового кровообращения в условиях дистресса. Способы решения проблемы: полипрагмазия или поиск мультимодальных лекарственных средств?
- Аннотация
- Статья
- Ссылки
- English
В современном мире человечество сталкивается с серьезными проблемами, угрожающими здоровью и качеству жизни как индивидуума, так и популяции. Эпидемии и конфликты, самоизоляция и миграция населения, беспокойство о судьбах родственников – те социально-экономические и медико-психологические проблемы, которые требуют комплексного решения.
Очевидно, возможности адаптационных реакций организма в ответ на воздействие различных неблагоприятных факторов-стрессоров сугубо индивидуальны, однако неспецифический характер таких реакций позволяет прогнозировать риск развития дистресса и разрабатывать относительно общие подходы к профилактике ассоциированных с ним заболеваний, одним из которых является острое нарушение мозгового кровообращения (ОНМК).
В одобренных Минздравом России клинических рекомендациях «Ишемический инсульт и транзиторная ишемическая атака у взрослых» среди других факторов риска, ассоциированных с повышенной частотой развития ишемического инсульта (артериальная гипертензия любого происхождения, заболевания сердца, мерцательная аритмия, инфаркт миокарда, дислипопротеинемия, сахарный диабет, бессимптомное поражение сонных артерий, наследственная предрасположенность, табакокурение, низкий уровень физической активности, неправильное питание, злоупотребление алкогольными напитками), указаны длительное психоэмоциональное напряжение или острый стресс [1].
Важно, что стресс может выступать триггером одновременно для ряда иных факторов риска. Например, в клинических рекомендациях «Артериальная гипертензия у взрослых» психологический стресс обозначен как модифицируемый фактор, способствующий увеличению сердечно-сосудистого риска [2]. Стресс считают одной из причин нарушений сна.
Полноценный ночной сон жизненно необходим для существования человека, он важен как для физического, так и психического здоровья и благополучия. В настоящее время исследователи и практикующие врачи стали лучше понимать значимость сна для функционирования мозга и организма в целом. Тем не менее клинические дефиниции сна недостаточно согласованы, а при разработке масштабных медико-социальных проектов, направленных на профилактику и повышение эффективности лечения неврологических расстройств, болезней сердечно-сосудистой системы (ССС) и других заболеваний, проблеме нарушений сна не уделяют должного внимания.
Как известно, сон представляет собой процесс смены циклов, фаз и стадий. Результаты исследований последних лет показывают, что состояние бодрствования контролируют нейрохимические системы, основными медиаторами которых являются ацетилхолин, дофамин, норадреналин, серотонин и гистамин. Начало сна определяется активностью расположенных в переднем гипоталамусе нейронов, которые используют гамма-аминомасляную кислоту (ГАМК) для ингибирования областей, стимулирующих пробуждение. Области ствола мозга, находящиеся в состоянии торможения во время бодрствования и медленного сна, становятся активными во время фазы быстрого сна (ФБС). Значительную роль в регуляции сна и бодрствования играет орексинергическая система мозга. Определенную роль в регуляции циркадных ритмов, одним из которых является цикл «бодрствование – сон», играет мелатонин [3, 4].
Фаза медленного (медленноволнового) сна (ФМС) характеризуется преобладанием влияния блуждающего нерва, что дает возможность ССС восстановить гомеостаз в ответ на стресс или усталость, вызванные бодрствованием. Резкие нерегулярные колебания баланса симпатической и парасимпатической систем во время ФБС воздействуют на ССС как фазовые нагрузки в состоянии покоя. Любые причины укорочения или фрагментации сна, такие как его депривация, апноэ во сне, бессонница, периодические движения конечностями во время сна, посменная работа, не только ухудшают восстановление функции ССС, но и создают дополнительную нагрузку. Физиологические изменения во время сна могут влиять на церебральный гомеостаз и служить фактором риска развития заболеваний ССС.
Более того, синдром обструктивного апноэ сна (СОАС), проявляющийся такими симптомами, как храп, головная боль по утрам, сонливость в дневное время, нарушение памяти, внимания, неполноценный ночной сон, в клинических рекомендациях «Артериальная гипертензия у взрослых» обозначен как одна из непосредственных причин симптоматической артериальной гипертонии. Однако в клинических рекомендациях «Ишемический инсульт и транзиторная ишемическая атака у взрослых» нарушения сна как фактор риска ОНМК напрямую не упоминаются [1, 2].
Зарубежные исследователи, в частности V.L. Feigin и соавт., продемонстрировали, что различные расстройства сна могут быть модифицируемыми факторами риска развития инсульта. Установлено, что короткая или длинная продолжительность сна, бессонница при объективной короткой продолжительности сна повышают риск развития ОНМК и смерти от него. Важно, что нарушения сна не только играют важную роль в развитии инсульта, но и негативно влияют на последующую реабилитацию [5, 6].
По данным P.W. Olejniczak и соавт., J.Y. Dong и соавт. и других исследователей, наиболее распространенным основанием для направления пациентов в лабораторию сна служит СОАС. Как и в общей популяции, СОАС является преобладающим типом нарушения дыхания во сне у пациентов с инсультом или транзиторной ишемической атакой (ТИА). В общей популяции СОАС удваивает риск инсульта у пациентов, не получавших лечения. При этом отношение шансов (ОШ) составляет 2,24 (95%-ный доверительный интервал (ДИ) 1,57–3,19), отношение рисков (ОР) 2,02 (95% ДИ 1,40–2,90) [7–9].
Расстройства дыхания во сне связывают с неблагоприятным долгосрочным прогнозом исходов инсульта, в том числе с повышенной смертностью. В отношении пациентов с ТИА и инсультом D.M. Hermann и соавт. рекомендуют проводить исследования сна ввиду очень высокой распространенности (более 50%) нарушений дыхания во сне (класс II, уровень доказательности B). Согласно данным экспериментальных исследований, расстройства цикла «бодрствование – сон» могут дополнительно нарушать процессы нейропластичности и негативно влиять на восстановление функций после инсульта. На тип и тяжесть нарушения дыхания во сне влияют локализация и этиология инсульта. Установлено, что инфратенториальные инсульты связаны с СОАС, и эти расстройства протекают тяжелее. В то же время супратенториальные инсульты ассоциируются с нарушениями дыхания во сне центрального характера [10].
Остается неясным, увеличивают ли риск инсульта расстройства сна, не сопровождающиеся апноэ. Выявление специфических нарушений сна или проблем со сном, обусловленных повышенным риском инсульта, может способствовать определению новых целей для профилактики развития этого заболевания.
Согласно данным исследований, проведенных, в частности, A.C. Winter и соавт., M.I. Boulos и соавт., у пациентов с синдромом беспокойных ног (СБН), особенно при наличии сопутствующих заболеваний, повышен риск цереброваскулярных заболеваний (ЦВЗ). Однако только в некоторых работах удалось доказать причинно-следственную связь подобных состояний. Имеются ограниченные данные о распространенности СБН до инсульта [11–13]. По данным C.A. Medeiros и соавт., среди 96 пациентов с ишемическим инсультом 12% страдали СБН до развития этого заболевания. Распространенность периодических движений конечностей во сне (ПДК) до инсульта и роль ПДК как фактора риска ОНМК остаются неясными [14].
В многоцентровом исследовании «случай – контроль» с участием 318 пациентов с парасомнией по типу расстройства поведения в быстром сне (РПБС) и 318 участников контрольной группы наличие этого состояния ассоциировалось со значительно более высоким риском развития заболеваний ССС (ОШ 1,6; 95% ДИ 1,0–2,5) [15]. Вероятность развития ишемического и особенно геморрагического инсульта примерно в 1,5 раза выше у пациентов с РПБС, даже с поправкой на сопутствующие факторы риска, такие как возраст, пол, ожирение, артериальная гипертензия и курение. Данные о распространенности этой парасомнии до и после инсульта представлены отдельными сообщениями. Например, в исследовании W.K. Tang и соавт. из 119 пациентов, перенесших инсульт, у 11% выявлены РПБС [16].
Наиболее часто встречающимся в общей популяции нарушением сна является инсомния (бессонница). Как показал метаанализ 15 проспективных когортных исследований, трудности с засыпанием и поддержанием сна повышают риск будущих сердечно-сосудистых событий. Между тем только в двух исследованиях оценивали взаимосвязь между инсомнией и риском инсульта. Оказалось, что симптомы бессонницы, о которых сообщали сами пациенты, не являются прогностическими факторами развития инсульта ни у мужчин, ни у женщин (после поправки на возраст, образование и другие факторы риска ЦВЗ) [17]. A. Westerlund и соавт. подтвердили, что жалобы на бессонницу сами по себе не связаны с риском сердечно-сосудистых событий, включая инсульт, но у пациентов с частыми симптомами бессонницы в сочетании с короткой продолжительностью сна (пять часов или менее) самый высокий риск сердечно-сосудистых событий (ОР 1,26–1,39). Это согласуется с результатами других исследований, предполагающими, что бессонница с короткой продолжительностью сна значима в отношении риска развития инсульта [18].
Инсульт и расстройства сна взаимно усугубляют друг друга. Последние (включая нарушения дыхания во сне, РПБС, связанные со сном двигательные расстройства, инсомнию и гиперсомнию), тесно переплетаясь с сопутствующими заболеваниями ССС, повышают риск повторного ОНМК. Важно обращать внимание на нарушения дыхания во сне и иные расстройства цикла «бодрствование – сон» именно как на факторы риска развития инсульта, негативно влияющие на исход в остром периоде инсульта, снижающие реабилитационный потенциал и качество жизни пациента. В то же время ОНМК само по себе является для пациентов стрессом, провоцирующим или усугубляющим инсомнию. Сочетание перечисленных проблем может привести к значительному замедлению темпа восстановления нарушенных функций, увеличению риска тяжелого течения коморбидных состояний, например инфекционных, генетически детерминированных заболеваний, и еще большему увеличению риска развития повторных ОНМК. По этой причине выявление и устранение нарушений сна должно быть частью как первичной, так и вторичной профилактики инсульта.
Известно, что предиктором нарушения ночного сна у пациентов, перенесших инсульт, является депрессия. M.A. Gebara и соавт. считают нарушения сна одним из облигатных проявлений депрессии. Между этими расстройствами имеется двунаправленная связь. Нормализация ночного сна приводит к уменьшению выраженности симптомов депрессии, позитивное влияние на настроение пациентов способствует купированию нарушений сна [19].
Депрессия часто сочетается с тревожным расстройством (ТР), поскольку эти нарушения связаны с изменением работы общих нейротрансмиттерных систем. Соответственно нарушения сна и ТР при ЦВЗ коморбидны (могут независимо сочетаться, вызываться ТР, обусловленным стрессом, или наоборот).
По указанным причинам тревога и ТР являются предметом особого внимания психологов и психиатров. Эпидемиологические исследования показывают, что ТР – наиболее распространенная проблема психического здоровья во всем мире. При этом нарушения сна, особенно бессонница, затрагивают около 50% лиц с ТР, а недостаток сна способен спровоцировать или усугубить ТР. Пациенты с ТР особенно часто сообщают о трудностях с засыпанием и поддержанием сна.
Связь тревоги и нарушений сна в целом понятна. Тревога в большинстве случаев обусловлена наличием острой или хронической стрессовой ситуации. Биологическая роль тревоги состоит в том, чтобы мобилизовать организм на борьбу или бегство, но эти реакции несовместимы со сном. Стрессоустойчивость организма, адаптационные возможности с учетом биологических, психологических факторов во многом определяет сон. Как уже отмечалось, ОНМК – мощный стрессовый фактор для организма. Под его воздействием изменяется регуляция как цикла «сон – бодрствование», так и фаз быстрого и медленного сна. На фоне стресса модулируется функционирование восходящих активирующих систем мозга, подавляется активность центров сна, нарушаются стабильность, длительность и поддержание сна. Наблюдаемая при этом активация гипоталамо-гипофизарно-надпочечниковой системы (ГГНС) сопровождается отрицательным обратным влиянием на гиппокамп, гипофиз и гипоталамус. Например, в супрахиазматическом ядре (СХЯ) снижается выработка вазопрессина и изменяется циркадианная амплитуда, что может способствовать развитию нарушений сна. В то же время нарушения сна и пролонгированный во времени стресс являются одними из многих потенциальных триггеров ОНМК, а устойчивое повышение уровня глюкокортикоидов снижает выживаемость нейронов в условиях ишемии. Существует причинно-следственная связь между стрессом, активностью оси ГГНС и исходом инсульта. Стресс и активация ГГНС усугубляют инсульт, повышая чувствительность нейроиммунного ответа на ишемию.
Помимо стресса нейроиммунную функцию модулирует социальная среда. По мнению K.A. Stuller и соавт., социальная изоляция ухудшает исход инсульта, в том числе вследствие активизации нейроиммунной системы [20]. Появляется все больше данных о том, что социальная поддержка может служить важным буфером против стресса и положительно влиять на здоровье и благополучие людей. В ходе кросс-секционного онлайн-опроса выявлено, что у людей, подвергавшихся самоизоляции, значительно возрастали показатели депрессии, раздражительности и одиночества. Риск развития депрессии был на 63% ниже у лиц с более высоким уровнем социальной поддержки. Точно так же у респондентов этой группы на 52% оказался ниже риск нарушения сна [21].
Во время пандемии COVID-19 социальная изоляция оказала влияние на психическое и (или) физическое здоровье, особенно среди людей пожилого возраста. Обзор W. Sepulveda-Loyola и соавт., в который был включен 41 документ с описанием анамнеза 20 069 человек из Азии, Европы и Америки, продемонстрировал, что важными проблемами во время пандемии COVID-19 были ТР, депрессия, плохое качество сна. Следует согласиться с мнением авторов, которые предлагают при наличии любых жалоб на нарушения сна тщательно оценивать способствующие этому факторы и назначать соответствующее лечение [22].
Несмотря на повышение осведомленности населения и медицинских работников о факторах риска развития ОНМК, а также значительный прогресс в лечении пациентов в остром периоде инсульта, последний остается наиболее частой причиной длительной утраты трудоспособности и инвалидности у лиц взрослого возраста во многих странах [23]. В современных условиях все большее значение приобретают новые профилактические и терапевтические стратегии, направленные на оказание высококачественной помощи. Одной из них может стать систематический скрининг, а также надлежащее лечение нарушений сна, поскольку решение проблемы может существенно способствовать снижению риска развития инсульта на популяционном уровне.
В настоящее время считается необходимым одновременное воздействие на многие факторы риска. Но такая стратегия чревата полипрагмазией. Как следствие – непредсказуемые взаимодействия лекарственных средств и недостаточная комплаентность пациентов, из-за чего цели профилактики ОНМК могут быть не достигнуты.
Наиболее рациональным способом воздействия на факторы риска считается устранение дистресса, а точнее нормализация ночного сна. Необходимо учитывать, что не только депрессия, тревога, клинические проявления и осложнения инсульта (повреждение на уровне таламуса или ствола мозга), но и лекарственные средства могут способствовать нарушению цикла «сон – бодрствование», и эти проблемы должны быть устранены в первую очередь.
Нарушения сна могут усугубить когнитивные и поведенческие расстройства у пациентов с инсультом и стать источником дополнительного значительного стресса для членов их семей. В отсутствие лечения нарушения сна способны увеличить риск ночных травм, ухудшить качество жизни, усугубить социальное и экономическое бремя лиц, осуществляющих уход за больными. Поскольку нарушения сна отрицательно влияют на все метаболические процессы, важно, чтобы практикующие врачи ясно понимали причины и алгоритм ведения пациентов с распространенными нарушениями сна.
Сон – это не однородное состояние, механизмы контроля сна проявляются на всех уровнях биологической организации (от генов и внутриклеточных механизмов до сетей популяций нейронов в центральной нервной системе, которые контролируют движения, пробуждение, вегетативные функции, поведение и познание). Как уже отмечалось, существуют сложные нейротрасмиттерные взаимодействия различных структур головного мозга, участвующих в регуляции биологических ритмов. Например, одним из важных эндогенно накапливаемых метаболитов во время бодрствования, который инициирует сон, является аденозин. Помимо аденозина к факторам, инициирующим сон, относятся ГАМК, простагландин D2 (PGD2), цитокины интерлейкин (ИЛ) 1-бета и фактор некроза опухоли (ФНО) альфа [24].
Одну из ключевых ролей в центральной регуляции процесса сна играет глицин – простейшая гидрофильная аминокислота, которая легко синтезируется в клетках организма, имеет низкую токсичность и широкий спектр биологических эффектов. Небольшой размер и отсутствие боковой цепи позволяют глицину занимать внутреннее положение в строении многих белковых молекул, а также функционировать как их гибкая часть, определяя третичную структуру. Он присутствует в большинстве тканей и является ключевым веществом в метаболизме одноуглеродных фрагментов, пептидов, нуклеотидов, порфиринов и солей желчных кислот.
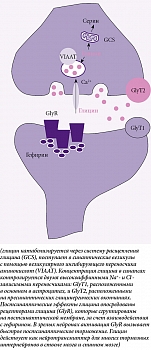
Помимо участия в клеточном метаболизме глицин, действуя через ионотропные рецепторы, служит важным распространенным тормозящим нейротрансмиттером, который наиболее заметно экспрессируется в стволе мозга взрослого человека, спинном мозге и сетчатке. Биосинтез глицина для нейротрансмиссии опосредуется серин-гидроксиметил-трансферазой, которая использует пиридоксальфосфат и тетрагидрофолат в качестве кофакторов реакции. В нервной системе глицин также синтезируется с участием фермента глицин-синтазы (glycine cleavage system, GCS) (рисунок).
Иммуногистохимические исследования показали, что GCS экспрессируется в эмбриональных нервных стволовых клетках, нейроэпителиальных клетках и астроцитах, обеспечивает развивающийся мозг метаболитами, такими как 5,10-метилентетрагидрофолат, необходимый для синтеза ДНК. Примечательно, что в процессе онтогенеза глицин претерпевает изменения кинетики и фармакологических свойств. Вместе с тем у взрослого человека глицин является тормозящим нейротрансмиттером, в незрелых тканях эмбриона он проявляет возбуждающие свойства. Этот эффект глицина во время эмбрионального развития, по-видимому, необходим для широкого спектра нейрогенных процессов, включая формирование и созревание нейронных цепей.
Глицинергическая передача требует высокоаффинных специфических транспортеров глицина – GlyT1 (glycine transporter 1) и GlyT2 (glycine transporter 2) для обратного захвата глицина из синаптической щели в клетки. Эти белки являются членами семейства Na+/Cl--зависимых переносчиков нейротрансмиттеров, при этом GlyT1 экспрессируется преимущественно в глиальных клетках, а GlyT2 – нейронами [25]. Дефекты глицинергической передачи сигналов во время развития нервной системы могут приводить к неврологическим двигательным нарушениям, гиперэкплексии, гипертонии и эпизодическому неонатальному апноэ. Вызывающие гиперэкплексию мутации в субъединице альфа-1 рецептора глицина (glycine receptor subunit alpha-1, GLRA1) и бета-субъединице рецептора глицина (glycine receptor subunit beta, GLRB) приводят либо к нарушению поверхностной экспрессии, либо к изменению эффективности глицина [26]. В дополнение к глицинергической передаче GlyT1 может модулировать глутаматергическую нейротрансмиссию через рецепторы N-метил-D-аспартата (N-methyl-D-aspartate receptors, NMDARs, NMDA-рецепторы), поддерживая его роль в функционировании мозга и при различных заболеваниях [27].
Существуют также собственно рецепторы глицина (GlyR), которые представляют собой сложно организованные пентамерные хлоридные каналы, экспрессия которых распределена по всем участкам центральной нервной системы. Постсинаптические GlyR участвуют в опосредовании быстрой тормозной нейротрансмиссии в спинном мозге, стволе головного мозга и сетчатке взрослого человека. В пресинаптических окончаниях GlyR модулируют высвобождение нейротрансмиттеров в глутаматергических и глицинергических синапсах. Глицинергическое торможение играет важную роль во многих физиологических процессах, включая регуляцию мышечного тонуса, двигательный контроль и сенсорную обработку. Нарушения в структуре GlyR непосредственно связаны с рядом неврологических расстройств, включая гиперэкплексию, боковой амиотрофический склероз, височную эпилепсию и хроническую неспецифическую боль. Тем не менее в настоящее время отсутствуют лекарственные средства, для которых GlyR являются непосредственными мишенями [28, 29].
В ряде научных публикаций последних лет высказывалось предположение, что профилактическое и терапевтическое введение глицина может защитить органы и ткани при некоторых патофизиологических состояниях, в том числе ишемическом инсульте. Именно этим был обусловлен повышенный интерес к изучению механизмов цитопротективного действия, а также предполагаемых новых областей применения глицина как лекарственного средства [30, 31].
Для объяснения описанной функции глицина имеет значение его способность модулировать трансмембранный перенос ионов кальция через медленный инозитол-1,4,5-трифосфат (IP3)-опосредованный путь, активируя впоследствии клетки Купфера и другие иммунокомпетентные клетки организма. Помимо этого был открыт механизм регуляции глицином концентрации рибонуклеиновой кислоты miR-19a-3p, что снижает активацию пути 5'аденозинмонофосфат-активированной протеинкиназы/киназы гликогенсинтазы-3 бета/гемоксигеназы-1 (5' adenosinemonophosphate-activatedproteinkinase/glycogensynthase kinase-3 beta/haem oxygenase-1, AMPK/GSK-3β/HO-1), ингибирует апоптоз клеток, нарушение метаболизма глюкозы и воспалительную реакцию. Другая, не менее важная роль глицина – его влияние на продолжительность фаз сна, что может применяться в качестве профилактики и терапии инсомний. Однако метаболизм экзогенно введенного глицина в нервной системе до сих пор остается предметом дискуссии, что ограничивает возможность его применения. В некоторых исследованиях доказано его прямое воздействие на NMDA, но не на GlyR. Предполагается, что описываемая нами аминокислота индуцирует периферическую вазодилатацию через сайт, связывающий глицин с NMDARs в головном мозге, а точнее в СХЯ, способствуя эффективной терморегуляции организма, быстрому засыпанию и увеличению продолжительности ФМС.
Применение глицина как средства, нормализующего качество сна, можно считать относительно новым и вполне безопасным подходом. Это подтверждают работы N. Kawai и соавт., в которых показано, что при остром нарушении сна введение глицина в условиях эксперимента вызывает ФБС и укорочение латентного периода ФМС с одновременным снижением температуры тела за счет стимуляции кожного кровотока. Антагонисты NMDARs ингибируют эффекты, вызванные введением глицина. Индукция экспрессии c-Fos наблюдается после введения глицина в ядрах гипоталамуса, включая медиальную преоптическую область и СХЯ. Аблация СХЯ полностью устраняет все эффекты глицина (и снотворный, и гипотермический) [32].
Зависимость между временем сна и ритмом температуры тела была доказана J. Barrett и соавт., D.J. Dijkand и M. vonSchantz [33, 34]. Как известно, гипотермию вызывают бензодиазепины и некоторые другие снотворные препараты, а также экзогенный мелатонин [35–37]. Однако способность глицина улучшать качество сна отличается от таковой традиционных снотворных. На фоне применения глицина нежелательные явления, такие как когнитивное снижение и зависимость, сводятся к минимуму.
По мнению F.R. Morales и соавт., активация глицинергических премотонейронов снижает мышечный тонус в ФБС во время сна в целом [38]. Считается, что экзогенный глицин способен пассивно проникать через гематоэнцефалический барьер [39]. В эксперименте пероральный прием глицина (3 г/сут непосредственно перед сном) субъективно улучшал качество сна и снижал дневную утомляемость и сонливость у лиц с депривацией сна или бессонницей [40, 41]. По данным полисомнографического исследования, глицин в дозе 3 г/сут способствует стабилизации состояния сна и сокращает латентность, не влияя существенно на структуру сна [32, 42].
M. Bannai и соавт., оценив влияние глицина на субъективную дневную производительность у здоровых добровольцев с частичным ограничением сна, констатировали значительное снижение утомляемости и тенденцию к снижению сонливости [41].
W. Yamadera и соавт. показали, что глицин вызывает субъективное и объективное улучшение качества сна, способствует более естественному характеру сна, включая снижение времени бодрствования, раннее появление ФМС и поддержание ФБС. Это позволяет восстановить ночной сон в целом [42].
Механизмы активации рецепторов глицина пока остаются нераскрытыми. Тем не менее свойства глицина, нашедшие отражение в показаниях к применению препарата согласно инструкции [43], позволяют рекомендовать его к амбулаторному использованию в сложных клинических ситуациях, например при стрессе, нарушениях сна и снижении работоспособности после перенесенных инфекционных заболеваний с поражением нервной системы или при стрессе на фоне высокого риска инсульта (в дозе до 0,375 г/сут), при первых признаках ОНМК (в дозе 1,0 г).
Ye.A. Salina, PhD, A.O. Moskvina, O.V. Kolokolov, PhD
Razumovsky Saratov State Medical University
Contact person: Oleg V. Kolokolov, kolokolov@inbox.ru
Sleep disorders are the most common triggers of distress-related diseases. They include acute cerebrovascular accident and other similar situations, and the treatment and prevention of them are still controversial issues around the world. This review describes the risk factors and mechanisms of sleep disorders, their impact on the development of cardiovascular disasters. Particular attention is paid to the work of neurotransmitter systems in normal conditions and in the conditions of pathological processes. The possibility of using the data of modern research to find therapeutic solutions to stroke and sleep disorders is also discussed. In particular, the perspective of using glycine-containing drugs and their pharmacological effects on various types of receptors of the nervous system are being considered.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.