Интерстициальное поражение легких при ревматических заболеваниях: новые возможности антипролиферативной/антифибротической терапии
- Аннотация
- Статья
- Ссылки
- English
Длительное время арсенал ревматологов при ИЗЛ был ограничен несколькими препаратами, в частности циклофосфамидом и микофенолата мофетилом. Однако они не позволяют контролировать все возможные ситуации. В настоящее время, после публикации результатов клинических исследований SENCSIS и INBUILD, для лечения ИЗЛ при системной склеродермии и других ревматических болезнях зарегистрирован антипролиферативный и антифиброзный препарат нинтеданиб, что значительно расширило терапевтические возможности.
В статье рассмотрены патогенетические основы применения нинтеданиба. Представлены результаты лечения с фокусом на ИЗЛ пациентов ревматологического профиля.
Длительное время арсенал ревматологов при ИЗЛ был ограничен несколькими препаратами, в частности циклофосфамидом и микофенолата мофетилом. Однако они не позволяют контролировать все возможные ситуации. В настоящее время, после публикации результатов клинических исследований SENCSIS и INBUILD, для лечения ИЗЛ при системной склеродермии и других ревматических болезнях зарегистрирован антипролиферативный и антифиброзный препарат нинтеданиб, что значительно расширило терапевтические возможности.
В статье рассмотрены патогенетические основы применения нинтеданиба. Представлены результаты лечения с фокусом на ИЗЛ пациентов ревматологического профиля.



Интерстициальное заболевание легких (ИЗЛ) – широко распространенный синдром, включающий в себя большую и разнородную группу паренхиматозных заболеваний легких, которые могут быть связаны с системными ревматическими заболеваниями, воздействием экзогенных факторов или иметь неизвестную этиологию (идиопатическое заболевание) [1]. В отечественной литературе для обозначения данного синдрома ревматологи часто используют термин «интерстициальное поражение легких» [2, 3]. Однако с учетом того, что при описании отечественной пульмонологической и общетерапевтической практики, как правило, применяется термин «интерстициальное заболевание легких» [4], а также общепринятости последнего в зарубежной литературе [5], в данной публикации мы будем придерживаться именно его.
У ряда пациентов развивается прогрессирующий фенотип ИЗЛ (ПФ-ИЗЛ), который характеризуется прогредиентным ухудшением функции легких, нарастанием дыхательной недостаточности и снижением качества жизни, а также риском ранней смерти (рис. 1) [1, 6].
Наиболее часто ПФ-ИЗЛ наблюдается при идиопатическом легочном фиброзе (ИЛФ). Идиопатический легочный фиброз относится к ИЗЛ неизвестной причины. Данная патология отличается неизменным прогрессированием и ассоциируется со средней выживаемостью три-четыре года [6–8]. Прогрессирующий фенотип фиброзирования легких также встречается у пациентов с другим ИЗЛ, в частности развивающимся на фоне ревматоидного артрита (РА) [2, 9], системной склеродермии (ССД) [3, 10], дерматомиозита/полимиозита (ДМ/ПМ) [11], саркоидоза [12], хронического гиперчувствительного пневмонита (ГП) [13] и иных вариантов ИЗЛ [6].
Прогрессирующий фенотип ИЗЛ при различных состояниях имеет много общих патогенетических механизмов, которые управляют процессом фиброзирования и приводят к необратимой потере целостности эпителиального/эндотелиального барьера, разрушению архитектуры легкого и потере им своей функции [6, 14, 15].
Клиническое значение при ревматических заболеваниях
Интерстициальное заболевание легких встречается при разных ревматических заболеваниях, преимущественно при классических аутоиммунных, для которых характерна выработка аутоантител. Наиболее типично ИЗЛ для ССД, РА, ДМ/ПМ, смешанного заболевания соединительной ткани (СЗСТ), болезни Шегрена (БШ), менее типично – для системной красной волчанки (СКВ), системных васкулитов (СВ) (рис. 2) [5, 16, 17]. Однако ИЗЛ не единственный вариант поражения легких при указанных заболеваниях. Могут развиваться инфильтративные изменения, сухой и выпотной плеврит, легочный васкулит, геморрагический альвеолит, бронхиолит и др. Для ИЗЛ наиболее характерно хроническое прогрессирующее течение с развитием необратимых изменений в легких.
Пациенты с ревматическими заболеваниями и ИЗЛ составляют существенную часть больных ИЗЛ. Согласно данным, представленным P. Rivera-Ortega и соавт. [18], на ИЗЛ при ревматических заболеваниях приходится от 2,9 до 34,8%. Доля пациентов с ПФ-ИЗЛ неизвестна. Однако, по оценкам экспертов и данным систематических обзоров, она может колебаться от 13 до 40% от общего числа больных ИЗЛ, ассоциированным с ревматическим заболеванием [5].
Системная склеродермия
Системная склеродермия – аутоиммунное заболевание соединительной ткани, которое характеризуется прогрессирующим избыточным фиброзом кожи и внутренних органов, вазоспастическими реакциями (феномен Рейно) с фиброинтимальной пролиферацией микрососудов [19]. Одним из наиболее характерных висцеральных проявлений ССД наряду с легочной артериальной гипертензией (ЛАГ) считается ИЗЛ.
В конце XX в. пятилетняя выживаемость при ССД составляла 77,9%, десятилетняя – 55,1%. Однако отмечена отчетливая тенденция к возрастанию числа летальных исходов в связи с поражением легких (ИЗЛ и ЛАГ). В настоящее время поражение легких признано ведущей причиной смерти при ССД [3].
Несмотря на значительные различия в разных когортах, частота выявления ИЗЛ при ССД достаточно велика. По данным реестра CSRG, ИЗЛ с помощью компьютерной томографии высокого разрешения (КТВР) было диагностировано у 64% больных ССД [5]. Согласно обзору данных 21 центра в Испании, из 1374 пациентов с ССД у 43% обнаружены признаки легочного фиброза при рентгенографии грудной клетки или КТВР [20]. По другим данным, частота выявления ИЗЛ при ССД составляет до 70–80% [21, 22].
К факторам риска развития или прогрессирования ИЗЛ у пациентов с ССД относятся диффузное поражение кожи (диффузная склеродермия), принадлежность к афроамериканцам, пожилой возраст в дебюте заболевания, более короткая продолжительность заболевания, наличие антител к топоизомеразе 1 (анти-Scl-70) или отсутствие антицентромерных антител [22, 23].
Несмотря на то что для ССД, как и для большинства других ревматических заболеваний, за исключением РА, характерен паттерн неспецифической интерстициальной пневмонии [24, 25], прогрессирующее течение ИЗЛ является типичным. Скорее всего, это связано с определенным субтипом ССД, ассоциированным с наличием анти-Scl-70 [3, 23, 25]. ИЗЛ обычно развивается в течение первых трех лет от дебюта ССД, у 40–75% пациентов отмечается снижение функции легких [26]. В рамках проекта EUSTAR (European League Against Rheumatism (EULAR) Scleroderma Trials and Research Group) установлено, что примерно у трети из 695 пациентов с ССД прогнозируемый уровень диффузионной способности легких по монооксиду углерода (DLCO) снижается более чем на 50% в течение трех лет после появления первых симптомов (феномена Рейно) [27]. В целом ПФ-ИЗЛ встречается у 25–30% больных ССД в зависимости от критериев диагностики [22].
Для мониторинга состояния таких больных предложен алгоритм клинико-инструментальных исследований в зависимости от клинического сценария (табл. 1) [26]. Для него характерна комплексность обследования и высокая частота проведения КТВР.
Необходимо отметить, что для выявления ПФ-ИЗЛ при ССД были предприняты попытки использовать КТВР и функциональные легочные тесты (ФЛТ). В исследованиях SLS I (NCT00004563) и II (NCT00883129) более высокий исходный кожный счет, пожилой возраст, снижение форсированной жизненной емкости легких (ФЖЕЛ) и DLCO в течение двух лет были независимо связаны с повышенным риском смерти [28]. Система, часто называемая критериями Goh, выделяет пациентов с распространенным (более 20% поражения легких по данным КТВР или 10–20% по КТВР и ФЖЕЛ менее 70% от прогнозируемой) или ограниченным заболеванием (менее 20% поражения легких по данным КТВР или 10–20% по КТВР и ФЖЕЛ 70% и более от прогнозируемой). Наличие указанных критериев было предиктором смертности (отношение рисков (ОР) 3,46 при 95%-ном доверительном интервале (ДИ) 2,19–5,46) [29]. В другом исследовании наиболее точным предиктором смертности было относительное снижение ФЖЕЛ на 10% и более или относительное снижение ФЖЕЛ на 5–9% с относительным снижением DLCO более 15% [30]. Однако широких исследований критериев ПФ-ИЗЛ при ССД не проводилось [22].
Интерстициальное заболевание легких при ССД ассоциируется с ранней смертью больных. В исследовании причин смерти 1508 пациентов с ССД из центра в США смертность, связанная с фиброзом легких, увеличилась с 6% в 1972–1976 гг. до 33% в 1997–2001 гг. [31]. При анализе базы данных EUSTAR в отношении 5850 пациентов установлено, что с 2004 по 2008 г. из-за легочного фиброза умерло 35% [32]. Во Франции с 2000 по 2011 г. из 2719 умерших больных ССД почти у половины смерть была вызвана сердечными или респираторными причинами. При этом частота смертельных случаев, связанных с ИЗЛ, за этот период увеличилась [33].
Ревматоидный артрит
Ревматоидный артрит признан наиболее распространенным ревматическим заболеванием – порядка 1000 случаев на 100 тыс. населения, или 1% общей численности, что на порядок превосходит встречаемость ССД [17, 25]. ИЗЛ – одно из типичных системных проявлений РА [34]. По некоторым данным, приблизительно у 10% пациентов с РА наблюдаются клинические симптомы ИЗЛ, у 30% – субклиническое течение [35, 36]. В разных исследованиях заболеваемость ИЗЛ варьировалась в зависимости от исследуемой популяции и критериев его определения [5]. В целом при применении КТВР выявляемость ИЗЛ при РА достаточно высокая. Так, в одном британском центре при анализе данных 150 амбулаторных пациентов с РА установлено, что у 28 (19%) ИЗЛ было выявлено после проведения КТВР [36]. Аналогичные результаты получены итальянскими исследователями [37]. В китайском ретроспективном исследовании с участием 550 пациентов с РА, которым была выполнена КТВР, показано, что данный метод позволил выявить ИЗЛ у 43,1%. При этом у 13,5% больных оно было выявлено до начала РА, у 69,6% – в течение десяти лет от начала РА, у 16,9% – более чем через десять лет от дебюта РА [38].
По расчетным данным, распространенность ИЗЛ, ассоциированного с РА, при активном обследовании может составлять от 100 до 400 случаев на 100 тыс. населения, что многократно превышает таковую при других вариантах ИЗЛ.
Длительное время обсуждается роль метотрексата, широко применяемого при РА, в развитии ИЗЛ. Необходимо подчеркнуть, что пневмонит, ассоциированный с терапией метотрексатом, отличается от ИЗЛ характером течения [41]. Поскольку метотрексат – один из ключевых препаратов для достижения целей терапии РА и распространенность потенциально связанных с ним осложнений невелика, решение о его назначении должно быть взвешенным [42]. Последние данные многоцентровых наблюдательных исследований ERAS и ERAN свидетельствуют об отсутствии прямой связи между назначением метотрексата и развитием ИЗЛ при РА [43]. Это подтверждают и результаты наблюдения за большой когортой BRASS (n = 1419) [44]. Кроме того, получены данные о возможности метотрексата предотвращать развитие ИЗЛ [43] и увеличивать выживаемость больных РА с ИЗЛ [45].
Основными факторами риска развития ИЗЛ при РА считаются курение, мужской пол, пожилой возраст, высокие титры ревматоидного фактора и антител к циклическому цитруллинированному пептиду, высокая активность РА [2, 37, 43, 44].
Как было отмечено ранее, при РА в существенном количестве случаев ИЗЛ длительно протекает субклинически [2]. Для РА в отличие от других ревматических заболеваний характерен паттерн обычной интерстициальной пневмонии (ОИП), что само по себе определяет большую склонность к прогрессированию легочного фиброза и неблагоприятному прогнозу [24, 25, 46]. Прогрессирующее ухудшение ФЛТ наблюдалось в течение пяти лет у 8–11% пациентов с ИЗЛ [5]. В уже упоминавшемся ранее исследовании ERAS наличие ИЗЛ у больных ранним РА ассоциировалось с неблагоприятным жизненным прогнозом. Так, медиана выживаемости составила три года [47]. В американском наблюдательном исследовании пациенты с ИЗЛ при РА с паттерном ОИП по данным КТВР имели худшую выживаемость по сравнению с другими больными РА – 3,2 против 6,6 года [48]. В относительно небольшой финской когорте (n = 59), находившейся под длительным наблюдением, у больных ИЗЛ при РА отмечено различие в отношении количества госпитализаций по респираторным причинам (1,9 ± 2,6 у пациентов с ОИП против 0,5 ± 0,9 у больных без ОИП, p = 0,004), использования кислородной терапии (22,9 против 0%, p = 0,016), количества смертей (65,7 против 41,7%, p = 0,046) и снижения DLCO (56 ± 20,6 против 69 ± 20,2%, p = 0,021). ИЗЛ было наиболее частой причиной смерти больных РА – 39,4% [49].
Другие системные ревматические заболевания
При других ревматических заболеваниях, так же как при ССД и РА, достаточно велика доля случаев развития ПФ-ИЗЛ. Высокая частота ИЗЛ наблюдается при БШ. Так, в исследовании P. Guisado-Vasco и соавт. из 102 последовательных пациентов с БШ у 35,3% диагностировано ИЗЛ. При этом у значительной части отмечалось прогрессирующее течение [50]. В исследовании, проведенном J.G. Parambil и соавт., при анализе данных 18 пациентов с БШ и ИЗЛ, наблюдавшихся в среднем в течение 38 месяцев, у пяти (28%) было прогнозируемое снижение ФЖЕЛ ≥ 10% или прогнозируемое снижение DLCO ≥ 15%, несмотря на иммуносупрессию [51]. Согласно данным Y. Enomoto и соавт., у таких пациентов прогноз в целом может быть относительно благоприятным [52]. Пятилетняя выживаемость составила 87,3% от общей популяции пациентов независимо от паттерна поражения легких по данным КТВР. В исследовании I. Marie и соавт. установлено, что из 107 пациентов с ИЗЛ, ассоциированным с ПМ/ДМ, получавших иммуносупрессанты, у 16% было прогнозируемое снижение ФЖЕЛ ≥ 10% и/или снижение DLCO ≥ 15% в течение периода наблюдения в среднем 34 месяца [11]. H. Yamakawa и соавт. при анализе данных 75 пациентов с антисинтетазным синдромом и ИЗЛ, получавших противовоспалительную терапию, выявили, что у шести (8%) больных наблюдалось снижение ФЖЕЛ > 10% и/или DLCO > 15% от прогнозируемого через год после диагностики ИЗЛ [53]. Из 36 пациентов, у которых ожидалось увеличение ФЖЕЛ > 10% и/или DLCO > 15% через год, у 12 (33%) наблюдалось ухудшение в течение следующих двух лет [53].
Традиционные методы медикаментозной терапии
Возможности традиционных иммуносупрессивных и противовоспалительных препаратов при ИЗЛ, ассоциированном с ревматическими заболеваниями, весьма ограничены (табл. 2) [2, 5, 17, 54–59].
Клиническая практика основывается на результатах исследований в отношении ССД. Положительный эффект циклофосфамида и микофенолата мофетила у пациентов с ССД доказан в рандомизированных контролируемых исследованиях (РКИ) [57–59]. Другие препараты, которые относительно успешно применяются для лечения ИЗЛ при ревматических заболеваниях, такие как азатиоприн, метотрексат, ритуксимаб, оценивались только в наблюдательных и ретроспективных исследованиях с низким уровнем доказательности [5, 60, 61]. Это касается как ССД, так и РА, БШ, ДМ/ПМ, СВ. Другие методы медикаментозной терапии оказались неэффективными [56]. Именно поэтому в рекомендации EULAR по лечению ССД для субтипа с ИЗЛ фактически вошел только циклофосфамид. Российские клинические рекомендации содержат также указание на возможность применения микофенолата мофетила, азатиоприна и ритуксимаба.
Однако указанные препараты имеют достаточно ограниченный терапевтический потенциал в отношении торможения легочного фиброза, будучи более иммуносупрессивными, чем антипролиферативными. Кроме того, часто возникают проблемы с их переносимостью (циклофосфамид) или доступностью (азатиоприн).
Конкретных рекомендаций врачебных сообществ по лечению ИЗЛ при РА пока не существует.
Нинтеданиб – новый препарат для лечения интерстициального заболевания легких
Для того чтобы замедлить прогрессирование фиброзирующего ИЗЛ у пациентов с системными аутоиммунными заболеваниями, целесообразно добавить к иммуносупрессантам собственно антипролиферативные/антифиброзные препараты. Как уже упоминалось, у ИЗЛ, ассоциированного с аутоиммунными заболеваниями, и ИЗЛ, вызванного другими причинами, включая ИЛФ, есть общие механизмы, управляющие прогрессирующим фиброзом [5]. Согласно существующим представлениям, ПФ-ИЗЛ развивается на фоне повторных повреждений альвеолярного эпителия или микрососудистого эндотелия, что приводит к разрушению клеток и нерегулируемому их восстановлению. Фибробласты, расположенные в местах повреждения, активируются, превращаются в миофибробласты, которые секретируют чрезмерное количество внеклеточного матрикса. Как следствие, увеличивается жесткость ткани, что в свою очередь дополнительно активирует и стимулирует фибробласты [62, 63]. Макрофаги и лимфоциты, привлеченные к месту повреждения, высвобождают как провоспалительные медиаторы, так и медиаторы, стимулирующие пролиферацию (факторы роста) [62]. Этот процесс усиливается за счет повреждения сосудов и приводит к активации и дегрануляции тромбоцитов [64]. Под воздействием указанных факторов развивается самоподдерживающийся процесс прогрессирующего фиброза. При накоплении внеклеточного матрикса увеличивается расстояние диффузии между кровеносными сосудами и клетками. В результате снижается снабжение тканей кислородом. Тканевая гипоксия может стимулировать дальнейшую продукцию белков матрикса [65]. Дополнительное значение может иметь персистенция антигенов, стимулирующих иммунный локальный ответ. При РА таковыми считаются цитруллинированные пептиды, способствующие развитию иммунного воспаления в суставах и прогрессированию пролиферативных процессов в легких [62, 66]. Кроме того, в последних исследовательских работах у больных ИЛФ выявлено повышение уровня антицитруллиновых антител [67].
Таким образом, общность патогенеза идиопатических и связанных с ревматическими заболеваниями интерстициальных фибротических процессов в легких обосновывает целесообразность применения антифиброзной/антипролиферативной терапии у данной категории больных.
В настоящее время наиболее ярким представителем препаратов указанной группы является нинтеданиб (Варгатеф, номер регистрационного удостоверения ЛП-002830).
Нинтеданиб – ингибитор тирозинкиназы, относящийся к классу малых молекул. Он блокирует киназную активность рецепторов фактора роста эндотелия сосудов 1–3 (VEGFR 1–3), рецепторов тромбоцитарного фактора роста α, β (PDGFR α, β) и рецепторов фактора роста фибробластов 1–3 (FGFR 1–3). Кроме того, ингибируются Fms-подобная протеинтирозинкиназа (Flt-3), лимфоцит-специфическая протеинтирозинкиназа (Lck), протоонкогенная протеинтирозинкиназа (Src) и киназы рецептора колониестимулирующего фактора 1 (CSF1R). Нинтеданиб конкурентно взаимодействует с аденозинтрифосфат-связывающим участком этих киназ и блокирует каскады внутриклеточной передачи сигналов, которые участвуют в ремоделировании фиброзной ткани при интерстициальном заболевании легких [68].
По основному механизму действия нинтеданиб представляет собой тройной ингибитор тирозинкиназ. Он обладает антифибролитическими, противовоспалительными свойствами и эффектами, направленными на сосудистое ремоделирование.
Первоначально нинтеданиб применяли для лечения немелкоклеточного рака легкого. Практически одновременно с этим в 2014 г. были завершены 52-недельные двойные слепые плацебоконтролируемые исследования INPULSIS-1 и -2, в которых на большой группе больных ИЛФ (n = 1066) была доказана его способность замедлять прогрессирование идиопатического легочного фиброза [69, 70]. Поэтому препарат был зарегистрирован по показанию «идиопатический легочный фиброз (идиопатический фиброзирующий альвеолит)».
В настоящее время уже накоплен российский клинический опыт применения нинтеданиба. Он подтверждает эффективность данного препарата [70, 71].
Применение нинтеданиба при системной склеродермии
Следующим этапом внедрения стало исследование нинтеданиба при ССД как естественной модели фибротических процессов на фоне аутоиммунной патологии. В 2019 г. опубликованы результаты двойного слепого плацебоконтролируемого исследования SENCSIS [72]. В него были включены 576 больных ССД, рандомизированных на группу нинтеданиба в дозе 150 мг два раза в день перорально и группу плацебо. Критериями включения выбраны возраст пациента ≥ 18 лет, подтвержденный диагноз ССД по критериям ACR/EULAR 2013 г. [73], при начале заболевания первый симптом, отличный от феномена Рейно, не ранее чем за семь лет до скрининга, ИЗЛ по данным КТВР грудной клетки не ранее чем за 12 месяцев до скрининга при степени охвата легкого фиброзом ≥ 10%, ФЖЕЛ ≥ 40%, DLCO от 30 до 89%. В исследование не включали больных с уровнями аланинаминотрансферазы/аспартатаминотрансферазы/билирубина, более чем в полтора раза превышающими норму, риском кровотечения, инфарктом миокарда или нестабильной стенокардией менее чем за шесть месяцев до скрининга, тромботическим событием в анамнезе не ранее чем за 12 месяцев до скрининга, более чем тремя очагами изъязвления пальцев или их некрозом в анамнезе в тяжелой форме, потребовавшим госпитализации, выраженной легочной гипертензией, склеродермическим почечным кризом в анамнезе.
Допускавшаяся в исследовании терапия основного заболевания включала преднизолон в дозе 10 мг/сут и менее или его эквивалент. Курс стабильной терапии микофенолата мофетилом или метотрексатом за шесть месяцев и более до рандомизации.
Первичной конечной точкой выбрано снижение ФЖЕЛ за год с оценкой в течение 52 недель. Ключевые вторичные конечные точки включали абсолютное изменение модифицированного кожного счета Роднана [17] и абсолютное изменение комплексной оценки по опроснику SGRQ [74] на 52-й неделе по сравнению с исходным уровнем.
В общей сложности 576 пациентов с ССД в 177 центрах из 32 стран получили по крайней мере одну дозу нинтеданиба (назначался внутрь по 150 мг два раза в день) или плацебо.
У 51,9% имела место диффузная склеродермия, 48,4% исходно получали микофенолата мофетил.
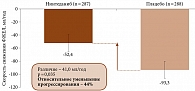
При первичном анализе конечных точек скорректированная скорость изменения ФЖЕЛ в группе нинтеданиба составила 52,4 мл/год, в группе плацебо – 93,3 мл/год. Разница – 41,0 мл/год (95% ДИ 2,9–79,0, p = 0,04) (рис. 3). Кожный счет Роднана и общая оценка по SGRQ через 52 недели существенно не различались.
Таким образом, лечение нинтеданибом достоверно тормозило развитие легочного фиброза и, соответственно, снижение легочной функции у больных ССД.
Полученные результаты стали основанием для регистрации препарата по показанию «интерстициальные заболевания легких при системной склеродермии».
Нинтеданиб и другие иммуновоспалительные заболевания
Успех нинтеданиба при ССД способствовал инициации исследований в отношении других иммуновоспалительных заболеваний. Предварительно были получены экспериментальные данные, поддерживающие гипотезу об эффективности нинтеданиба при различных ИЗЛ. Так, E.F. Redente и соавт. оценили влияние нинтеданиба на развитие фиброза легких и заболеваний суставов у самок мышей линии SKG, у которых артрит был вызван внутрибрюшинной инъекцией зимозана в дозе 5 мг [75]. Показатели исходов в отношении артрита и фиброза легких определяли через шесть недель лечения. Значительное снижение уровня коллагена в легких, установленное с помощью измерения гидроксипролина и окрашивания на коллаген, наблюдалось у получавших нинтеданиб. Раннее вмешательство с применением нинтеданиба значительно снизило риск развития артрита.
Эффективность нинтеданиба при разных прогрессирующих ИЗЛ была продемонстрирована в исследовании INBUILD [76]. В этом двойном слепом плацебоконтролируемом РКИ фазы III, проведенном в 15 странах, участвовали пациенты с фиброзирующими заболеваниями легких, которым назначали нинтеданиб в дозе 150 мг два раза в день перорально или плацебо. В исследование включали лиц с признаками фиброза легких более 10% по данным КТВР, ФЖЕЛ 45% или более от прогнозируемой и DLCO от 30 до 80% от прогнозируемого. В исследование не включали получавших азатиоприн, циклоспорин, микофенолата мофетил, такролимус, ритуксимаб, циклофосфамид или пероральные глюкокортикостероиды в дозе более 20 мг/сут.
Первичной конечной точкой стала скорость снижения ФЖЕЛ в год по оценке за 52 недели.
Спирометрия выполнялась исходно, на второй, четвертой, шестой, 12, 24, 36 и 52-й неделях.
Рандомизацию прошли и получили хотя бы одну дозу нинтеданиба или плацебо 663 пациента (332 в группе нинтеданиба и 331 в группе плацебо). Средний возраст составил 65,8 ± 9,8 года, ФЖЕЛ – 69,0 ± 15,6%, DLCO – 46,1 ± 13,6% от прогнозируемого.
Из 663 пациентов у 412 (62,1%) имел место паттерн ОИП. Самыми частыми диагнозами были хронический ГП (26,1%) и аутоиммунные ИЗЛ (25,6%). У 170 больных (82 в группе нинтеданиба и 88 в группе плацебо) отмечены системные ревматические заболевания, такие как ССД, РА, СЗСТ.
В общей популяции скорректированная скорость снижения ФЖЕЛ составила 80,8 мл/год в группе нинтеданиба и 187,8 мл/год в группе плацебо. Разница между группами – 107,0 мл/год (95% ДИ 65,4–148,5, p < 0,001). У пациентов с паттерном поражения легких по типу ОИП скорректированная скорость снижения ФЖЕЛ составила 82,9 мл/год для группы нинтеданиба и 211,1 мл/год для группы плацебо. Разница – 128,2 мл/год (95% ДИ 70,8–185,6, p < 0,001).
Таким образом, в большой группе больных с прогрессирующим ИЛФ ежегодная скорость снижения ФЖЕЛ была значительно ниже среди получавших нинтеданиб, чем среди применявших плацебо.
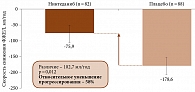
При проведении субанализа результатов исследования INBUILD в зависимости от конкретного диагноза эффект нинтеданиба по сравнению с плацебо на снижение скорости ФЖЕЛ был постоянным во всех пяти подгруппах: гиперчувствительный пневмонит – 73,1 мл/год (95% ДИ -8,6–154,8), аутоиммунные интерстициальные пневмонии – 104,0 мл/год (ДИ 21,1–186,9), идиопатическая неспецифическая интерстициальная пневмония – 141,6 мл/год (ДИ 46,0–237,2), неклассифицируемая идиопатическая интерстициальная пневмония – 68,3 мл/год (ДИ -31,4–168,1), другие ИЗЛ – 197,1 мл/год (ДИ 77,6–316,7) (p = 0,41 между группами) [77]. Что касается ревматических заболеваний, то разница по выраженности снижения ФЖЕЛ между группой активного лечения и группой плацебо составила 102,7 мл/год, что означает относительное уменьшение прогрессирования на 58% (p = 0,012) (рис. 4).
Важно, что в исследованиях нинтеданиба частота серьезных нежелательных явлений была приемлемой и достоверно не отличалась от группы плацебо. Чаще отмечались транзиторные диспептические явления и диарея [69, 72, 76].
В июле 2020 г. нинтеданиб зарегистрирован по показанию «другие хронические фиброзирующие интерстициальные заболевания легких (ИЗЛ) с прогрессирующим фенотипом», что при наличии оснований позволяет назначать его пациентам с РА и другими ревматическими заболеваниями, сопровождающимися ПФ-ИЗЛ.
Заключение
На сегодняшний день нинтеданиб является единственным препаратом среди применяющихся для лечения ИЗЛ при ревматических заболеваниях. Он характеризуется как антипролиферативным, так и антифибротическим действием. Благодаря такой уникальной особенности нинтеданиб способен улучшить состояние больных с множественной лекарственной резистентностью, а также лиц, имеющих противопоказания для назначения цитотоксической иммуносупрессивной терапии.
Нинтеданиб пополнил арсенал средств для борьбы с тяжелой хронической ревматической патологией.
D.E. Karateev, MD, PhD, Prof., E.L. Luchikhina, PhD, A.R. Tangiyeva
Moscow Regional Research and Clinical Institute
Contact person: Dmitry E. Karateev, dekar@inbox.ru
Interstitial lung disease (ILD) is a heterogeneous group of diseases that includes autoimmune rheumatic diseases such as systemic scleroderma, rheumatoid arthritis, and others. ILD is associated with a severe course and the risk of early death of patients.
For a long time, the rheumatologists’ arsenal in terms of treatment of ILD was very limited by the use of several drugs, such as cyclophosphamide, mycophenolate mofetil, etc., which do not allow to control all clinical situations. Currently, after publication of the results of clinical trials SENCSIS and INBUILD for the treatment of ILD in systemic scleroderma and other rheumatic diseases, the antiproliferative and antifibrotic drug nintedanib has been approved, which significantly expands the therapeutic options.
The review details the pathogenetic basis of the use of nintedanib and the results of its use with a focus on ILD in rheumatic diseases.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.