Изменяя парадигмы лечения сахарного диабета 2 типа: от исследований к реальной клинической практике. III Всероссийский эндокринологический конгресс «Инновационные технологии в эндокринологии». Сателлитный симпозиум компании «Такеда»
- Аннотация
- Статья
- Ссылки
Рассмотрению новых парадигм терапии СД 2 типа был посвящен сателлитный симпозиум компании «Такеда», состоявшийся в рамках III Всероссийского эндокринологического конгресса «Инновационные технологии в эндокринологии» (Москва, 2 марта 2017 г.). Как отметил модератор мероприятия, заведующий кафедрой эндокринологии и диабетологии Российской медицинской академии непрерывного профессионального образования, заслуженный деятель науки РФ, д.м.н., профессор Александр Сергеевич АМЕТОВ, настало время оценить результаты многочисленных исследований и внедрить в реальную практику такие стратегии лечения, которые принесут пользу пациентам с СД.
В рамках симпозиума были подведены итоги десятилетнего применения ингибиторов дипептидилпептидазы 4 (иДПП-4) в диабетологии, проанализирована возможность интенсификации терапии с помощью иДПП-4 алоглиптина.
Рассмотрению новых парадигм терапии СД 2 типа был посвящен сателлитный симпозиум компании «Такеда», состоявшийся в рамках III Всероссийского эндокринологического конгресса «Инновационные технологии в эндокринологии» (Москва, 2 марта 2017 г.). Как отметил модератор мероприятия, заведующий кафедрой эндокринологии и диабетологии Российской медицинской академии непрерывного профессионального образования, заслуженный деятель науки РФ, д.м.н., профессор Александр Сергеевич АМЕТОВ, настало время оценить результаты многочисленных исследований и внедрить в реальную практику такие стратегии лечения, которые принесут пользу пациентам с СД.
В рамках симпозиума были подведены итоги десятилетнего применения ингибиторов дипептидилпептидазы 4 (иДПП-4) в диабетологии, проанализирована возможность интенсификации терапии с помощью иДПП-4 алоглиптина.



Преодоление шаблонов в управлении диабетом
Профессор госпиталя Ландау, член Королевской коллегии врачей, доктор медицины Марк ЭВАНС (Великобритания) представил современную парадигму лечения сахарного диабета (СД) 2 типа – преодоление клинической инерции. Такая тактика позволяет повысить эффективность терапии и минимизировать расходы на лечение больных.
Актуальность рассматриваемой проблемы обусловлена не только быстро увеличивающейся распространенностью СД 2 типа, но и его тяжелыми осложнениями. Согласно данным статистического отчета США за 2014 г., у лиц с СД продолжительностью более 20 лет частота госпитализаций вследствие сердечно-сосудистых заболеваний в 1,8 раза выше, чем у лиц без диабета. Практически 50% пациентов с СД всех возрастов в 2011 г. стали получать лечение по поводу почечной недостаточности. 73 тыс. больных старше 20 лет перенесли нетравматическую ампутацию нижней конечности. 4,2 млн пациентов старше 40 лет страдают диабетической ретинопатией. 71% пациентов старше 18 лет имеют неоптимальное артериальное давление (АД) (≥ 140/90 мм рт. ст.)1.
Приведенные данные свидетельствуют о клинической инерции не только в отношении контроля уровня глюкозы, но и в отношении лечения сердечно-сосудистых заболеваний (ССЗ).
Результаты метаанализа 102 исследований показали, что СД приводит к двукратному увеличению риска развития сердечно-сосудистых патологий, а продолжительность жизни 50-летних больных даже без сосудистой патологии в анамнезе в среднем на шесть лет короче, чем у их сверстников без диабета2.
Исследования по оценке наиболее значимых факторов риска развития ССЗ продемонстрировали, что контроль показателей АД, уровня липидов и глюкозы в совокупности приводит к уменьшению суммарного количества сердечно-сосудистых заболеваний3.
Тяжелым осложнением длительного и своевременно не корректируемого течения СД является хроническая почечная недостаточность (ХПН) вплоть до развития терминальной стадии. Затраты на ее лечение в Великобритании исчисляются 65 тыс. фунтов в год. Результаты расширенных исследований (ADVANCE-ON) с десятилетним наблюдением доказали, что снижение уровня гликированного гемоглобина (HbA1c) на 1% ассоциируется со снижением частоты случаев развития терминальной стадии ХПН на 46%4.
Причина недостаточной эффективности лечения больных СД – клиническая инерция. Так, исследование Datalink, проведенное в Великобритании в условиях реальной клинической практики (n = 81 573), выявило, что пациенты с уровнем HbA1c 8,7% находились на монотерапии пероральными сахароснижающими препаратами (ПССП), с уровнем HbA1c 9,1% – на терапии двумя ПССП, с уровнем HbA1c 9,7% – тремя ПССП. Медиана времени до интенсификации терапии при HbA1c > 7% составила от двух до семи лет и более5.
Клиническая инерция является общемировой тенденцией. Под ней понимается неспособность инициировать и усилить терапию в ситуации, когда это клинически целесообразно. Это может привести к отрицательным индивидуальным и экономическим последствиям. Для сравнения докладчик рассмотрел две клинические ситуации: «Возьмем двух мужчин, страдающих СД 2 типа и имеющих аналогичные показатели во всем параметрам, при этом у одного из них недостаточный контроль гликемии, у второго – хороший. Продолжительность жизни последнего будет больше на 20%, количество осложнений сократится на 60%, затраты на лечение – на 20%».
Среди причин отсрочки интенсификации лечения указывают риск гипогликемии, увеличение массы тела, сложные схемы лечения, недостаточную приверженность пациента лечению, повышенную потребность во врачах, ресурсах (время, деньги) и др. Безусловно, наиболее важным является страх гипогликемии – три четверти врачей и столько же пациентов отдали бы предпочтение более интенсивной терапии, если бы не риск развития такого состояния.
Кроме того, гипогликемия патофизиологически связана со многими механизмами, которые обусловливают развитие сердечно-сосудистых осложнений (дисфункция эндотелия, воспаление, нарушение свертывания крови, реакция симпатоадреналовой системы)6. Так, метаанализ шести исследований с участием более 900 тыс. больных СД 2 типа с периодом наблюдения от одного года до шести лет продемонстрировал, что тяжелая гипогликемия ассоциируется с повышенным риском развития сердечно-сосудистых заболеваний.
«Следовательно, гипогликемия – это не только барьер для соблюдения пациентами схемы лечения, в том числе при ее интенсификации, но и проблема конечных клинических точек», – подчеркнул выступающий.
Именно поэтому необходима разработка новых стратегий терапии для достижения адекватного гликемического контроля с минимальным количеством побочных эффектов.
Идеальная фармакотерапия должна сочетать эффективность с устойчивостью действия, воздействовать на звенья патогенеза, минимизировать риски развития гипогликемии, увеличения массы тела, обладать хорошей переносимостью и быть удобной в применении.
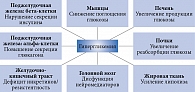
Установлено, что причиной развития СД 2 типа являются патофизиологические дефекты. До недавнего времени их насчитывалось восемь, так называемый угрожающий октет: дисфункция альфа- и бета-клеток поджелудочной железы, снижение поглощения глюкозы мышцами, увеличение продукции глюкозы печенью и реабсорбции глюкозы почками, усиление липолиза жировой ткани, дисфункция нейромедиаторов головного мозга, дефицит инкретинов/резистентность в желудочно-кишечном тракте (рис. 1)7, 8. В настоящее время рассматривают уже 11 патофизиологических дефектов.
Все эти нарушения приводят к повышению уровня глюкозы в крови. Большую часть патофизиологических проблем можно решить с помощью продления действия эндогенного глюкагоноподобного пептида 1 (ГПП-1), предотвращая быстрый распад ГПП-1 путем ингибирования ферментативной активности дипептидилпептидазы 4 (ДПП-4). Может ли это привести к преимуществам в клинической практике?
В двухлетнем многоцентровом рандомизированном сравнительном исследовании эффективности ингибиторов ДПП-4 (иДПП-4) алоглиптина и препарата сульфонилмочевины (ПСМ) глипизида при их комбинации с метформином установлено, что у пациентов с СД 2 типа и неудовлетворительным контролем на монотерапии метформином добавление алоглиптина обеспечивает более устойчивый гликемический контроль без риска гипогликемий и увеличения массы тела, чем добавление глипизида9.
Продемонстрированная в исследованиях эффективность алоглиптина может быть значительно выше в клинической практике, устойчивость результатов терапии – потенциально более значимой. В связи с этим, безусловно, будут представлять особый интерес результаты начатого в 2013 г. в США крупного проспективного исследования Grade, целью которого стало сравнение в долгосрочной перспективе эффективности основных сахароснижающих препаратов – иДПП-4, ПСМ, агонистов рецепторов ГПП-1 (АР ГПП-1), базального инсулина – при назначении в комбинации с метформином. Результаты данного исследования позволят оценить преимущества и недостатки сахароснижающих средств, в том числе с позиции устойчивости их сахароснижающего действия.
Превосходство иДПП-4 перед ПСМ заключается прежде всего в их нейтральном воздействии на массу тела и низком риске гипогликемий. Указанные эффекты, а также хорошая переносимость и удобство применения улучшают приверженность пациентов лечению, что в долгосрочной перспективе обусловливает и фармакоэкономическое преимущество.
Эффективность и безопасность применения алоглиптина по сравнению с эффективностью и безопасностью применения плацебо при добавлении к ПСМ, метформину, пиоглитазону и инсулину изучалась в ряде исследований. На основании полученных результатов был сделан вывод: на фоне терапии алоглиптином в сочетании с другими сахароснижающими препаратами отмечается низкая частота эпизодов гипогликемии. Она сопоставима с частотой гипогликемий при приеме плацебо.
Добавление алоглиптина 25 мг к ПСМ, метформину, пиоглитазону и инсулину или к двойной комбинации инсулина и пиоглитазона сопровождалось снижением уровня HbA1c на 0,5–0,9%10–14.
Для оценки эффективности иДПП-4 (алоглиптина, линаглиптина, саксаглиптина, ситаглиптина и вилдаглиптина) в лечении пациентов с неконтролируемым СД 2 типа было выбрано более 6 тыс. статей, только 163 из них соответствовали критериям включения в метаанализ и 85 публикаций о 63 рандомизированных клинических исследованиях содержали достаточные данные для метаанализа. Сравнение разных видов терапии иДПП-4 в комбинации с метформином продемонстрировало сопоставимую их эффективность и безопасность. В частности, на фоне применения алоглиптина уровень HbA1c уменьшился на 0,68%, линаглиптина – на 0,57%, саксаглиптина – на 0,61%, ситаглиптина – на 0,64%, вилдаглиптина – на 0,59%15.
Данные исследований позволили сделать вывод, что алоглиптин обеспечивает аналогичное снижение значений HbA1c у пациентов как старше, так и моложе 65 лет.
Оценка профиля эффективности и безопасности сахароснижающей терапии очень важна у пациентов пожилого и старческого возраста в связи с наличием у них большого количества сопутствующих патологий, в том числе ХПН. Так, японские исследователи установили, что у более 60% больных СД 2 типа старше 70 лет, страдающих ХПН, на фоне применения ПСМ и даже инсулина повышается частота гипогликемий, требующих госпитализации16.
Риск развития гипогликемии у больных СД 2 типа с заболеваниями почек ограничивает терапевтические возможности. Для таких пациентов наиболее предпочтительными считаются экзогенный инсулин и иДПП-4. Одно из ключевых преимуществ последних – низкий риск развития гипогликемических состояний17.
В 2008 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration – FDA) существенно ужесточило требования к одобрению гипогликемических средств. Причиной стали данные метаанализа, опубликованные в 2007 г. При проведении работы была выявлена ассоциация между применением розиглитазона и повышением риска сердечно-сосудистой смерти. В связи с этим FDA рекомендовало проводить оценку сердечно-сосудистой безопасности зарегистрированных и разрабатываемых гипогликемических препаратов на основании широкомасштабных исследований фаз II и III с учетом верхней границы двустороннего 95%-ного доверительного интервала (ДИ) для расчета относительного риска (ОР). Достижение верхней границы < 1,3 (общее соотношение риска и пользы) является достаточным основанием, чтобы одобрить препарат для применения.
В настоящее время завершены три крупных исследования по оценке влияния иДПП-4 на сердечно-сосудистые исходы: саксаглиптина (SAVOR-TIMI), алоглиптина (EXAMINE) и ситаглиптина (TECOS). Исследование EXAMINE отличалось от других исследований составом участников. Это были пациенты, перенесшие острый коронарный синдром за 15–90 дней до включения в исследование.
В качестве первичной конечной точки (MACE) в исследованиях выбрана частота крупных сердечно-сосудистых событий (сердечно-сосудистая смерть, нефатальный инфаркт миокарда или инсульт). Все три исследования достигли своих первичных конечных точек, продемонстрировав безопасность иДПП-4 у пациентов с СД 2 типа и ССЗ в анамнезе18.
Вторичная конечная точка – частота госпитализаций по причине сердечной недостаточности (СН). В исследовании SAVOR-TIMI терапия саксаглиптином ассоциировалась с небольшим, но достоверно значимым повышением частоты госпитализаций по сравнению с приемом плацебо (3,5 против 2,8% (ОР 1,27 (95% ДИ 1,07–1,51), р = 0,007). Исследование TECOS не выявило увеличения частоты госпитализаций (ОР 0,98 (95% ДИ 0,89–1,08)).
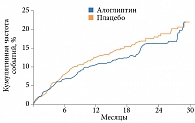
В исследовании EXAMINE независимо от статуса пациента (с СН или без СН) был продемонстрирован сходный с плацебо профиль безопасности алоглиптина как в отношении первичной конечной точки, так и вторичной19. Согласно данным post-hoc анализа, прием алоглиптина не приводит к повышению частоты смерти и госпитализаций по поводу СН у пациентов с СН (ОР 0,90 (95% ДИ 0,70–1,17)) (рис. 2).
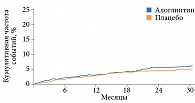
Сходная тенденция отмечалась при приеме алоглиптина пациентами с СД 2 типа без СН в анамнезе (ОР 1,14 (95% ДИ 0,85–1,54)) (рис. 3).
Отсутствие разницы между группами алоглиптина и плацебо по комбинированной точке сердечно-сосудистой смерти и госпитализации по причине СН отмечалось и по всем квартилям BNP.
Таким образом, результаты исследования EXAMINE продемонстрировали, что прием алоглиптина по сравнению с приемом плацебо не приводит к повышению риска серьезных нежелательных сердечно-сосудистых событий у пациентов с СД 2 типа из группы высокого сердечно-сосудистого риска (11,3 против 11,8% (ОР 0,96, верхняя граница ДИ 1,16)). Не было выявлено различий и в отношении риска наступления вторичной комбинированной конечной точки МАСЕ. Терапия алоглиптином не ассоциировалась с увеличением риска смерти вследствие сердечно-сосудистого заболевания и любых других причин, а также количества случаев развития СН или ухудшения сердечно-сосудистых исходов у пациентов с СН в анамнезе.
Важно и то, что эффективность иДПП-4 в комбинации с метформином у больных СД 2 типа в реальной клинической практике аналогична эффективности, продемонстрированной в клинических исследованиях.
Профессор М. Эванс констатировал, что по алоглиптину собрана большая доказательная база. В программе клинических исследований по оценке эффективности и безопасности алоглиптина при добавлении к разным ПССП участвовало порядка 14 800 пациентов, включая пожилых лиц и лиц с нарушением функции почек. Терапию алоглиптином получали 2257 пациентов старше 65 лет и 386 пациентов старше 75 лет; 5447 пациентов с почечной недостаточностью легкой степени тяжести, 1290 пациентов с почечной недостаточностью средней степени тяжести и 82 пациента с ХПН тяжелой степени или заболеванием на терминальной стадии.
Алоглиптин – единственный из иДПП-4 с доказанной сердечно-сосудистой безопасностью у больных СД 2 типа из группы очень высокого риска и у пациентов, недавно перенесших острый коронарный синдром18, 20, – подчеркнул докладчик в заключение.
Декада ингибиторов ДПП-4: какие результаты мы получили
Уже более одной декады иДПП-4 используются в мировой диабетологической практике. Свое выступление заведующий отделением терапевтических и хирургических методов лечения диабетической стопы Эндокринологического научного центра Минздрава России, д.м.н., профессор Гагик Радикович ГАЛСТЯН начал с краткого экскурса в историю их создания.
Впервые ДПП-4 была описана в 1966 г. К началу 1990-х гг. получены сведения о ее кинетических свойствах и специфичности. Незадолго до этого ГПП-1 признан самым сильным инкретиновым гормоном человека, а спустя несколько лет выявлена роль ДПП-4 в метаболизме ГПП-1. Позже были опубликованы работы, иллюстрирующие, что инфузия нативного ГПП-1 практически нормализует гликемию у пациентов с СД 2 типа на ранней стадии.
Эти данные послужили обоснованием ингибирования ДПП-4 с целью повышения концентрации инкретинов и улучшения контроля гликемии. В 1998 г. разработаны первые иДПП-4, в 2000 г. – проведены клинические исследования препаратов этой группы. Их результаты способствовали внедрению иДПП-4 в клиническую практику.
Таким образом, иДПП-4 стали первыми ПССП, созданными на проспективной основе21–29.
Целесообразность использования инкретин-направленной терапии обусловлена ее способностью влиять на одно из звеньев патогенеза СД – дисфункцию бета-клеток. Установлено, что ГПП-1, обеспечивая разными механизмами глюкозорегулирующую, метаболическую функцию, в то же время влияет на хроническую дисфункцию бета-клеток за счет усиления биосинтеза инсулина30. Результаты ряда исследований свидетельствуют, что АР ГПП-1 и иДПП-4 способны снизить активность апоптоза бета-клеток. В связи с этим выдвинуто предположение, что их использование предотвратит прогрессирование заболевания.
На сегодняшний день описано уже 11 звеньев патогенеза СД 2 типа. В центре внимания – снижение функции бета-клеток, которое заключается не только в снижении секреции инсулина, но и в дефекте секреции альфа-клеток, повышенной продукции глюкагона.
Инкретин-направленная терапия влияет на большинство звеньев патогенеза: в семи из них определенная роль отводится именно инкретинам. Если к такому лечению добавить метформин, воздействие будет оказываться уже на десять патогенетических звеньев31.
Комбинация иДПП-4 с метформином характеризуется синергизмом действия в отношении уровня ГПП-132. Применение метформина может привести к увеличению продукции ГПП-1 L-клетками. Однако, поскольку пептидазы находятся в непосредственной близости от места продукции ГПП-1 и подвергаются деградации, указанное действие при использовании метформина в виде монотерапии практически не проявляется. При добавлении иДПП-4 к метформину секреция ГПП-1 повышается, активность гормона увеличивается. При монотерапии иДПП-4 концентрация активной фракции ГПП-1 ниже, чем при его использовании в сочетании с метформином.
Синергизм действия двух препаратов позволяет рассчитывать на больший сахароснижающий потенциал. Поскольку метформин и иДПП-4 характеризуются низким риском развития гипогликемий и увеличения массы тела, их преимущества в отношении гликемического контроля не сопряжены с ухудшением прогноза в отношении этих двух показателей.
В настоящее время зарегистрировано девять препаратов класса иДПП-4, однако только пять из них – ситаглиптин, вилдаглиптин, саксаглиптин, алоглиптин, линаглиптин – назначаются активно. Ингибиторы ДПП-4 различаются по своей химической структуре, метаболизму, экскреции, периоду полувыведения, что предопределяет дозу и кратность приема (таблица)33, но не эффективность и безопасность.
В отношении последних показателей существенных различий между сахароснижающими препаратами данного класса не наблюдается.
По словам профессора Г.Р. Галстяна, сегодня иДПП-4 и ПСМ являются конкурирующими группами. Проведенный метаанализ подтвердил, что по динамике снижения HbA1c, достижению его целевых значений иДПП-4 и ПСМ демонстрируют паритетные результаты, однако по риску увеличения массы тела и частоте гипогликемий показатели терапии ПСМ выше в два и пять раз соответственно34.
Первым долгосрочным исследованием, в котором сравнивались эффективность и безопасность иДПП-4 и ПСМ в комбинации с метформином, стало двухлетнее рандомизированное двойное слепое исследование ENDURE. Оно доказало преимущество иДПП-4 перед ПСМ. Пациенты были рандомизированы на три группы: алоглиптин 12,5 мг/сут (n = 880), алоглиптин 25 мг/сут (n = 885), глипизид 5–20 мг (n = 874).
К 104-й неделе снижение уровня HbA1c в группе глипизида составило 0,59%. В группах алоглиптина 12,5 и 25 мг – -0,68 и -0,72% соответственно (рис. 4).
Кроме того, терапия алоглиптином в дозах 12,5 и 25 мг сопровождалась более выраженным снижением уровня глюкозы плазмы натощак по сравнению с терапией глипизидом, достигнутый результат сохранялся на протяжении двух лет35.
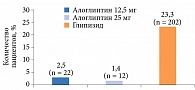
Большинство пациентов группы глипизида оказались на минимальной или средней дозе препарата. Почему при утрате гликемического контроля исследователи не увеличивали дозу препарата? Ответ прост: они старались избежать повышения частоты гипогликемических эпизодов. Последние отмечались у 23,2% пациентов, принимавших глипизид (против 2,5 и 1,4% пациентов, принимавших алоглиптин в дозах 12,5 и 25 мг соответственно) (рис. 5). Фактически исследователи были ограничены в возможности интенсифицировать терапию, чтобы не спровоцировать развитие гипогликемических состояний.
Далее профессор Г.Р. Галстян проанализировал результаты исследований EXAMINE18, SAVOR-TIMI36 и TECOS37. Выступающий отметил, что существуют определенные сложности в попытке их сравнить. Прежде всего потому, что различаются характеристики включенных в них больных: в исследовании EXAMINE участвовали пациенты, перенесшие острый инфаркт миокарда за 15–90 дней до рандомизации; в исследовании SAVOR-TIMI – пациенты с ССЗ или факторами риска их развития; в исследовании TECOS – пациенты, страдающие ССЗ. Следовательно, в исследовании EXAMINE приняли участие самые тяжелые с точки зрения риска развития сердечно-сосудистых событий пациенты. Еще одним важным аспектом, по мнению профессора Г.Р. Галстяна, является различие верхних границ исходного уровня HbA1c – 11,0% (EXAMINE), 12,0% (SAVOR-TIMI) и 8,0% (TECOS).
Во всех трех исследованиях по основным конечным точкам были достигнуты паритетные результаты, которые подтвердили общую сердечно-сосудистую безопасность иДПП-4. Однако они не дали окончательного ответа на вопрос – можно ли рассчитывать на плейотропные эффекты такой терапии?
Именно поэтому большой интерес представляют данные ряда регистров больных СД, в частности шведского. В популяционном шведском исследовании анализировались истории болезней 52 760 пациентов с СД 2 типа, которым назначались ПСМ и метформин или иДПП-4 и метформин в период с 2006 по 2013 г.38 Более высокая частота гипогликемий отмечена в группе ПСМ и метформина. Согласно оценке исходов заболевания среди пациентов, получавших ПСМ и метформин, чаще фиксировались фатальные и нефатальные события, хотя это были больные без ССЗ в анамнезе.
Данные наблюдательного исследования с участием 127 555 пациентов с СД 2 типа, опубликованные в Европейском кардиологическом журнале (European Heart Journal) и основанные на оценке сердечно-сосудистой безопасности терапии разными классами сахароснижающих препаратов, показали, что терапия иДПП-4 не ассоциируется с увеличением риска госпитализаций по причине СН, по крайней мере по сравнению с ПСМ39.
Результаты метаанализа крупных рандомизированных исследований также продемонстрировали нейтральный эффект иДПП-4 на сердечно-сосудистые исходы при СД 2 типа40.
«Сегодня особый интерес вызывает сравнение двух классов препаратов – иДПП-4 и ингибиторов натрий-глюкозного котранспортера 2 типа (иНГЛТ-2) – в лечении сахарного диабета и предупреждении его осложнений», – отметил выступающий. Для назначения иДПП-4 лучшими кандидатами считаются лица пожилого возраста, лица с умеренными и тяжелыми нарушениями функции почек, поскольку препараты указанной группы не имеют ограничений в применении по скорости клубочковой фильтрации (СКФ)41. При этом с осторожностью следует назначать иДПП-4 больным, имеющим в анамнезе панкреатит. Ингибиторы НГЛТ-2 лучше назначать пациентам с СН, ожирением. В то же время их не следует рекомендовать лицам с умеренными и тяжелыми нарушениями функции почек, риском развития кетоацидоза, пациентам старшей возрастной группы42.
«Речь идет не о конкуренции этих двух классов препаратов, а о расширении терапевтических возможностей. В ряде случаев можно рассматривать целесообразность комбинированного их назначения», – уточнил профессор Г.Р. Галстян.
Особая категория больных – лица пожилого и старшего возраста. Возраст считается одним из драйверов развития СД 2 типа. Во многих странах Европы и США рост числа больных СД 2 типа старшего возраста за последние 10–20 лет обусловлен значительным снижением сердечно-сосудистых осложнений и смерти от них43. В российской когорте больных СД 2 типа представительство пациентов старшего и пожилого возраста также велико44.
Возраст также считается одним из факторов риска развития гипогликемических состояний. Данные исследования ACCORD свидетельствуют, что у больных старше 65 лет один год жизни ассоциируется с увеличением риска тяжелых гипогликемий на 5%45. Именно в этой когорте смертность была наиболее высокой. Она была связана с тяжелыми гипогликемиями46.
В данной группе больных часто отмечается нарушение функции почек47.
У лиц с СД риск развития деменции значительно выше, чем у лиц без СД48.
Назначение таким пациентам терапии, способной увеличить риск гипогликемий, может привести к ухудшению их состояния и приверженности лечению.
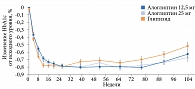
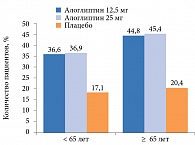
Исследования, касающиеся возрастной категории пациентов старше 65 лет, проведены в отношении всех иДПП-4. Сравнительный анализ шести рандомизированных двойных слепых плацебоконтролируемых исследований по алоглиптину в дозах 12,5 и 25 мг с участием 2366 больных СД 2 типа продемонстрировал преимущество терапии иДПП-4 у пациентов старше 65 лет (рис. 6).
Целевого уровня HbA1c ≤ 7,0% в группах алоглиптина 12,5 и 25 мг достигло большее количество пациентов старше 65 лет по сравнению с пациентами более молодого возраста (44,8 и 45,4% против 36,6 и 36,9% соответственно)49.
В 52-недельном рандомизированном двойном слепом контролируемом исследовании эффективности и безопасности алоглиптина по сравнению с глипизидом у пациентов 65 лет и старше была отмечена сопоставимая эффективность обоих режимов терапии. В то же время показано преимущество алоглиптина в отношении безопасности. Так, частота развития гипогликемии при приеме алоглиптина составила 5,4% случаев, глипизида – 26%50.
Еще одно преимущество инкретин-направленной терапии – влияние на риск переломов. Известно, что у лиц с СД риск переломов выше, чем у лиц без СД. Результаты исследований свидетельствуют о том, что применение иДПП-4 уменьшает риск периферических переломов51, 52.
Результаты многочисленных исследований, десятилетний опыт успешного применения иДПП-4 способствовали тому, что сегодня препараты данного класса представлены и в рекомендациях Американской диабетической ассоциации (American Diabetes Association – ADA), и Американской ассоциации клинических эндокринологов (American Association of Clinical Endocrinologists – AACE), и Российской ассоциации эндокринологов (РАЭ). Примечательно, что эксперты РАЭ еще в 2011 г. рассмотрели возможность монотерапии иДПП-4 в дебюте заболевания у пациентов с HbA1c ≤ 7% в тех случаях, когда назначение метформина противопоказано, и комбинированной стартовой терапии в случае, если уровень HbA1c > 7,6%53.
«Ингибиторы ДПП-4 – это востребованный класс сахароснижающих препаратов, оказывающих влияние на патогенез заболевания и обладающих солидной доказательной базой в отношении сердечно-сосудистой и общей безопасности», – констатировал профессор Г.Р. Галстян.
Заключение
Подводя итоги выступлений, профессор А.С. Аметов отметил, что десятилетие использования иДПП-4 – это целая эра инкретин-направленной терапии в диабетологии. Препараты, основанные на инкретиновом эффекте, помогают решать большую часть патофизиологических проблем, лежащих в основе развития СД. Ингибиторы ДПП-4 позволяют поддерживать физиологические концентрации глюкозы в крови, обладают устойчивым сахароснижающим действием, характеризуются низким риском развития гипогликемии. На фоне их приема не отмечается увеличения массы тела и риска сердечно-сосудистых событий. Кроме того, препараты данного класса хорошо переносятся.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.