VI Всероссийский конгресс эндокринологов с международным участием «Современные технологии в эндокринологии»: Как добиться успеха в терапии СД 2 типа: новые возможности в лечении ингибиторами ДПП-4
- Аннотация
- Статья
- Ссылки
Успешная сахароснижающая терапия у больных сахарным диабетом 2 типа, находящихся в группе риска хронического заболевания почек, подразумевает не только оптимальную коррекцию углеводного обмена и контроль гликемии, но и отсутствие необходимости в коррекции дозы препаратов и дополнительного мониторинга функции почек.
Уникальные особенности и терапевтические свойства нового ингибитора ДПП-4 линаглиптина (препарат Тражента) обсуждались в докладах члена-корреспондента РАМН, профессора Марины Владимировны ШЕСТАКОВОЙ и профессора Ашота Мусаеловича МКРТУМЯНА на симпозиуме «Как добиться успеха в терапии СД 2 типа: новые возможности в лечении ингибиторами ДПП-4».
Симпозиум, организованный при поддержке компаний «Берингер Ингельхайм» и «Эли Лилли», прошел 30 мая 2012 г. в рамках VI Всероссийского конгресса эндокринологов.
Успешная сахароснижающая терапия у больных сахарным диабетом 2 типа, находящихся в группе риска хронического заболевания почек, подразумевает не только оптимальную коррекцию углеводного обмена и контроль гликемии, но и отсутствие необходимости в коррекции дозы препаратов и дополнительного мониторинга функции почек.
Уникальные особенности и терапевтические свойства нового ингибитора ДПП-4 линаглиптина (препарат Тражента) обсуждались в докладах члена-корреспондента РАМН, профессора Марины Владимировны ШЕСТАКОВОЙ и профессора Ашота Мусаеловича МКРТУМЯНА на симпозиуме «Как добиться успеха в терапии СД 2 типа: новые возможности в лечении ингибиторами ДПП-4».
Симпозиум, организованный при поддержке компаний «Берингер Ингельхайм» и «Эли Лилли», прошел 30 мая 2012 г. в рамках VI Всероссийского конгресса эндокринологов.

![Рис. 2. Химическое строение препаратов класса ингибиторов ДПП-4, адаптировано по [11].](/upload/resize_cache/iblock/68c/195_350_1/68cadda8217f90ac8d380d7a29cc8aae.jpg)

![Таблица 2. Селективность препаратов класса ингибиторов ДПП-4, адаптировано по [12]](/upload/resize_cache/iblock/dac/195_350_1/dacede52c74f197380b4252a57696e9d.jpg)
![Рис. 3. Особенности фармакодинамики линаглиптина, адаптировано по [13]](/upload/resize_cache/iblock/f8a/195_350_1/f8adc86e23427daefb3913a250d5cd5b.jpg)
![Рис. 4. Увеличение концентрации ГПП-1 на фоне приема линаглиптина, адаптировано по [14]](/upload/resize_cache/iblock/045/195_350_1/04557c0e787a7a569b2d05b65fbea954.jpg)

![Рис. 8. Эффективность линаглиптина у пациентов с хронической болезнью почек (ХБП) различной степени тяжести, адаптировано по [25].](/upload/resize_cache/iblock/79e/195_350_1/79eaf1dee4010aa04fecd42e4aaaff29.jpg)

![Рис. 10. Динамика уровня HbA1c на фоне терапии линаглиптином в сравнении с глимепиридом, адаптировано по [32]](/upload/resize_cache/iblock/a52/195_350_1/a52fcbda109b999d644a50b78e04cd21.jpg)
Согласно данным Всемирной организации здравоохранения (ВОЗ), перечень неинфекционных эпидемий ХХI века возглавляет сахарный диабет (СД), следом идут сердечно-сосудистые заболевания, хронические болезни легких, онкологические заболевания. По мнению директора Института диабета ФГБУ «Эндокринологический научный центр», д.м.н., члена-корреспондента РАМН, профессора М.В. ШЕСТАКОВОЙ, в эту группу можно включить и хроническую болезнь почек (ХБП). «В последние годы в мире драматично растет число больных сахарным диабетом с сочетанными заболеваниями почек, – поясняет Марина Владимировна. – Диабет занял лидирующие позиции среди причин развития почечной патологии, поэтому эти две большие медицинские проблемы тесно взаимосвязаны».
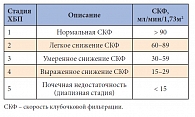
Предложенное Национальным почечным фондом США (National Kidney Foundation, NKF) понятие «хроническая болезнь почек» (ХБП) является наднозологическим и применяется вне зависимости от основного заболевания почек. Главным маркером заболеваний почек, лежащим в основе действующей классификации ХБП, является снижение скорости клубочковой фильтрации (СКФ). По уровню СКФ выделяют 5 стадий ХБП (табл. 1).
Первая и вторая стадии ХБП определяются, если выявлены клинико-лабораторные признаки почечного заболевания (микроальбуминурия, протеинурия, измененный осадок мочи и др.). Если у пациента СКФ снижена и составляет от 30 до 60 мл/мин/1,73м2, то уже независимо от наличия или отсутствия других признаков нефропатии устанавливается диагноз «ХБП, 3-я стадия», при СКФ от 15 до 30 – 4-я стадия, а при значении СКФ меньше 15 мл/мин/1,73м2 – 5-я стадия. При формулировке диагноза следует учитывать и основное заболевание, и стадию ХБП. Например: диабетическая нефропатия, стадия микроальбуминурии, ХБП 2.
Далее профессор М.В. Шестакова остановилась на наиболее распространенных причинах ХБП. В США в структуре причин хронической почечной недостаточности у больных, находящихся на заместительной почечной терапии (ЗПТ), на долю СД приходится 43,8%, артериальной гипертензии – 26,8%, а на долю гломерулонефрита – 7,6% (United States Renal Data System Annual Report, 2007). В России, согласно регистру Российского диализного общества (2009), доминирует гломерулонефрит (46,1%), а на долю СД приходится 11,3%.
Причинами ХБП могут также являться хронический пиелонефрит, тубуло-интерстициальный нефрит, гипертоническая нефропатия, стеноз почечной артерии, поражение почек при системных заболеваниях соединительной ткани, амилоидоз почек, подагрическая нефропатия; врожденные заболевания почек, миеломная болезнь, длительная обструкция мочевыводящих путей, мочекаменная болезнь, гидронефроз, а также токсическая нефропатия вследствие приема нестероидных противовоспалительных препаратов (НПВП), аминогликозидов, циклоспоринов, амфотерицина B и др.
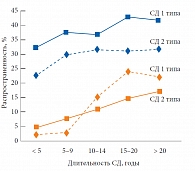
По данным Государственного регистра больных сахарным диабетом, в 2010 г. в нашей стране насчитывалось 1 млн 139 тыс. больных СД с диабетической нефропатией. Однако, по мнению докладчика, есть основания говорить о гиподиагностике осложнений СД. Так, в рамках программы активного скрининга сосудистых осложнений СД, проводившейся в 20 регионах России, была выявлена существенная разница между фактической и регистрируемой распространенностью диабетического поражения почек. Таким образом, на основании данных ФГБУ «Эндокринологический научный центр» (2010), истинная распространенность диабетической нефропатии в России в среднем составляет 40% при СД как 1-го, так и 2-го типа. При этом частота диабетической нефропатии растет по мере увеличения длительности СД (рис. 1).
Диабетическое поражение почек является фактором риска развития сердечно-сосудистой патологии и смерти от сердечно-сосудистых заболеваний. Так, результаты исследования WESDR показали, что у больных СД 2 типа риск смерти от сердечно-сосудистых причин возрастает в 2,2 раза на фоне микроальбуминурии и в 3,7 раза на фоне протеинурии по сравнению с больными СД с нормоальбуминурией1. Доказано, что диабетическая нефропатия может также провоцировать риск развития эпизодов гипогликемии. В ходе исследования M.F. Moen и соавт. (2009) было показано двукратное возрастание риска гипогликемии при СД, отягощенном ХБП, при этом 74% тяжелых гипогликемий вызывалось терапией препаратами сульфонилмочевины у пациентов со сниженной функцией почек2. К возможным причинам гипогликемии при ХБП следует отнести сниженный клиренс инсулина и сахароснижающих препаратов, сниженный почечный глюконеогенез, нарушение питания/анорексию при сниженной функции почек, нарушение содержания гликогена в печени.
Завершая выступление, профессор М.В. Шестакова остановилась на важном для практикующего врача вопросе: как следует корректировать сахароснижающую терапию у больных СД с ХБП. Снижение функции почек ограничивает возможности применения сахароснижающих препаратов, поскольку большинство из них выводится в основном через почки. В журнале Европейской почечной ассоциации – Европейской ассоциации диализа и трансплантации (European Renal Association – European Dialysis and Transplant Association, ERA-EDTA) Nephrology Dialysis Transplantation («Нефрология. Диализ. Трансплантация») были опубликованы рекомендации по использованию основных противодиабетических препаратов у пациентов с ХБП.
Начиная с 3-й стадии ХБП рекомендуется прекратить прием метформина и вилдаглиптина, значительное снижение дозы препарата на 3-й стадии ХБП требуется в случае препаратов сульфонилмочевины, акарбозы, эксенатида, а также ситаглиптина и саксаглиптина. Поскольку глитазоны и глиниды не выводятся почками, нет необходимости в коррекции их дозы у больных СД с ХБП. «Список препаратов, которые можно назначать больным сахарным диабетом при любой стадии хронической болезни почек, пополнился недавно зарегистрированным в России ингибитором ДПП-4 линаглиптином (торговое название Тражента)», – подчеркнула профессор М.В. Шестакова.
Новый ингибитор ДПП-4 линаглиптин: основные аспекты эффективности, безопасности, возможности применения
В начале своего выступления заведующий кафедрой эндокринологии и диабетологии МГМСУ, д. м. н., профессор А.М. МКРТУМЯН охарактеризовал основную цель современной фармакотерапии СД как поддержание баланса между эффективностью и безопасностью. На современном этапе развития медицины этот баланс нарушен. Как показано в ходе ряда исследований, большинство пациентов с СД 2 типа не достигают целевых показателей гликемии: при целевом значении HbA1c 6,5–7,0% у 64% пациентов уровень HbA1c превышает 7,2%, у 37% – > 8%, у 20% – > 9%3, а у 10% пациентов уровень HbA1c превышает 10%4.
Интенсификация терапии СД с целью достижения целевых значений гликемии приводит к повышению риска развития гипогликемии. Так, в ходе исследования VADT (Veterans Affairs Diabetes Trial – Исследование диабета среди ветеранов войны США) тяжелые эпизоды гипогликемии были отмечены у 21,2% пациентов в группе интенсивной терапии (целевое значение HbA1c 6,9%) и у 9,9% пациентов в группе стандартной терапии (целевое значение HbA1c 8,4%)5, в ходе исследования ACCORD (Action to Control Cardiovascular Risk in Diabetes – Действия по контролю кардиоваскулярного риска при диабете) по крайней мере один эпизод тяжелой гипогликемии был зарегистрирован у 16,2% пациентов в группе интенсивного гликемического контроля (HbA1c 6,4%) и у 5,1% пациентов в группе стандартной сахароснижающей терапии (HbA1c 7,5%)6.
Среди побочных эффектов современной сахароснижающей терапии Ашот Мусаелович также выделил увеличение массы тела, которое на фоне приема препаратов сульфонилмочевины или инсулина в течение 3–12 лет может достигать 5–8 кг7. Еще одна важная терапевтическая проблема – коморбидность и стойкая ассоциация диабета с повышенным риском развития осложнений со стороны сердца и почек. По данным Американской диабетологической ассоциации (American Diabetes Association, ADA), у 67% больных СД отмечается артериальная гипертония, являющаяся самостоятельным фактором риска развития нефропатии.
У 43% пациентов с СД присутствует такой фактор риска развития диабетической нефропатии, как гипергликемия8, у 30% – повышенный риск развития микроальбуминурии8, у 24% – дислипидемии9. С учетом того, что у большинства больных СД присутствует не один фактор риска развития диабетических осложнений, а несколько, вопросы безопасности сахароснижающей терапии выходят на первый план. В этой связи большие надежды клиницисты возлагают на терапию, основанную на «инкретиновом эффекте» гормонов желудочно-кишечного тракта (ЖКТ).
Профессор А.М. Мкртумян напомнил слушателям, что в 1973 г. J.C. Brown и J. Dupre обнаружили основное свойство выделенного ранее гормона – глюкозозависимую стимуляцию секреции инсулина – и предложили его назвать «глюкозозависимый инсулинотропный полипептид» (ГИП). В 1983 г. из гена проглюкагона хомяка была выделена последовательность двух глюкагоноподобных пептидов, которые впоследствии были названы «глюкагоноподобный пептид-1» (ГПП-1) и «глюкагоноподобный пептид-2» (ГПП-2). Позже было показано, что ГПП-1 обладает множественным влиянием на эндокринную часть поджелудочной железы, но его принципиальным действием является потенцирование глюкозозависимой секреции инсулина и глюкозозависимое подавление секреции глюкагона.
Общим «недостатком» обоих инкретинов является то, что они быстро (ГПП-1 – в течение 2 минут, ГИП – в течение 6 минут) подвергаются расщеплению ферментом дипептидилпептидазой 4-го типа (ДПП-4). Перед специалистами встал вопрос: как использовать глюкозозависимый инсулинотропный эффект ГПП-1 и преодолеть разрушающее действие фермента ДПП-4? Было найдено два пути решения проблемы: 1) создание веществ, имитирующих действие ГПП-1 (миметики и аналоги ГПП-1), 2) создание веществ, пролонгирующих действие эндогенных ГПП-1 и ГИП (ингибиторы ДПП-4).
Более детально профессор А.М. Мкртумян остановился на классе препаратов ингибиторов ДПП-4 (рис. 2). К пептидомиметическим ингибиторам ДПП-4 относятся такие препараты, как ситаглиптин, вилдаглиптин и саксаглиптин. Единственным представителем класса ингибиторов ДПП-4, напрямую связывающимся с ферментом (благодаря ксантиновому основанию), является линаглиптин (препарат Тражента). Химическая структура линаглиптина идеально соответствует активному центру фермента ДПП-4 (по типу «ключ – замок»)10, что обусловливает высокую афинность препарата к ингибированию фермента ДПП-4.
У препарата Тражента самая высокая способность к ингибированию активности фермента ДПП-4 в прямом сравнении с другими ингибиторами ДПП-4. Показатель IC50 (концентрация, необходимая для ингибирования 50% активности ДПП-4) составляет у линаглиптина 1 нмоль, ситаглиптина – 19 нмоль, саксаглиптина – 50 нмоль, вилдаглиптина – 62 нмоль (чем ниже значение IC50, тем выше способность к подавлению активности ДПП-4)11.
Препарат характеризуется высокой селективностью в отношении ДПП-4: выше, чем в отношении ДПП-2 более чем в 100 000 раз, ДПП-8 в 40 000 раз, а ДПП-9 более чем в 10 000 раз. Это самые высокие показатели в классе (табл. 2)12. Докладчик подчеркнул, что селективность имеет большое значение для безопасности и переносимости ингибиторов ДПП-4, поскольку в экспериментах на животных моделях было установлено, что подавление изоферментов ДПП-8 и ДПП-9 привело к развитию токсических реакций (алопеция, тромбоцитопения, ретикулоцитопения, спленомегалия, мультиорганные гистологические изменения).
Терапевтическая доза препарата – 5 мг перорально – позволяет достичь равновесной концентрации линаглиптина (6–8 нмоль/л) уже в течение 3-го междозового интервала, обеспечивая более чем 91%-ное ингибирование ДПП-4 в течение 24 часов (рис. 3)13. Как следствие, в 3,2 раза увеличивается постпрандиальная концентрация эндогенного ГПП-1 (рис. 4)14.
«Линаглиптин повышает постпрандиальную концентрацию активного ГПП-1 у больных СД 2 типа, выступая, таким образом, физиологическим, классическим, регулятором постпрандиальной гликемии, – комментирует профессор А.М. Мкртумян. – В целом ключевыми фармакодинамическими характеристиками линаглиптина являются высокая аффинность, высокая селективность, прочность связывания с ферментом ДПП-4, длительность действия и высокая эффективность». Клинический профиль линаглиптина определяет его место в пероральной сахароснижающей терапии (рис. 5). Высокая и стойкая эффективность линаглиптина в различных схемах пероральной терапии СД 2 типа была подтверждена рядом международных исследований (рис. 6)15–21.
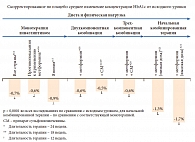
Анализ данных исследований, в которых изучалось применение линаглиптина в качестве монотерапии и в составе комбинаций, показал сопоставимые результаты. На фоне монотерапии линаглиптином уровень HbA1c в среднем снижался на 0,7%. Добавление линаглиптина к терапии метформином позволило дополнительно снизить HbA1c на 0,6%, к терапии производным сульфонилмочевины – на 0,5%, к комбинации «метформин + производные сульфонилмочевины» – на 0,6%. Так, в исследовании S. Del Prato и соавт. (2011)15 монотерапия линаглиптином привела к 0,86%-ному снижению уровня HbA1c по сравнению с плацебо у пациентов с неудовлетворительным контролем гликемии (исходный уровень HbA1c 9,5%). Добавление линаглиптина к терапии метформином (M.R. Taskinen и соавт. (2011)) снижает HbA1c на 0,95%18, а к комбинации «метформин + препарат сульфонилмочевины» (D.R. Owens и соавт. (2011)) – на 1,2%22 (рис. 7).
Еще один важный показатель оценки эффективности сахароснижающей терапии, на котором акцентировал внимание участников симпозиума профессор А.М. Мкртумян, – это так называемый индекс стойкости. В ходе ряда исследований с продолжительным периодом наблюдения (например, ACCORD) было показано, что достигнутый в результате терапии гликемический контроль по прошествии нескольких лет «исчезал». Результаты исследования, в котором на продленной фазе, то есть после достижения контроля гликемии в течение 24-недельной терапии метформином или комбинацией «метформин + препарат сульфонилмочевины» или пиоглитазоном на протяжении еще 78 недель, добавляли линаглиптин, продемонстрировали стойкое снижение уровня HbA1c на 0,8% к концу исследования23.
В еще одном докладе, прочитанном на 47-м конгрессе Европейской ассоциации по изучению сахарного диабета – EASD-2011, – были представлены данные, согласно которым линаглиптин обеспечивал надежный контроль гликемии вне зависимости от длительности СД 2 типа: снижение HbA1c по сравнению с плацебо составило 0,66% в группе пациентов со «стажем» диабета менее 1 года, 0,59% – у пациентов с длительностью заболевания 1–5 лет и 0,67% – у пациентов, которым диагноз «сахарный диабет» был поставлен более 5 лет назад24.
Отсутствуют ограничения по применению линаглиптина у больных с ХБП: сопоставимая эффективность препарата была зарегистрирована у пациентов с нормальной СКФ (> 90 мл/мин/1,73м2), с легким (60–90 мл/мин/1,73м2) и умеренным (30–60 мл/мин/1,73м2) снижением СКФ (рис. 8)25. Существует также доказательная база по профилю безопасности нового ингибитора ДПП-4. Данные клинических исследований свидетельствуют: частота возникновения побочных реакций у пациентов, получавших линаглиптин, сопоставима с плацебо (табл. 3).
Использование линаглиптина характеризуется низким риском гипогликемии и отсутствием клинически значимого повышения массы тела. Частота гипогликемических эпизодов на фоне терапии линаглиптином у пациентов, не получавших производные сульфонилмочевины, была менее 1%, в том числе и у склонных к гипогликемии пациентов (пожилого возраста, страдающих ожирением и нарушением функции почек). Добавление линаглиптина к терапии производными сульфонилмочевины снижало частоту гипогликемий – осложнения, характерного для этого класса препаратов. Исследования влияния линаглиптина на массу тела продемонстрировали отсутствие такового как на фоне монотерапии, так и в комбинации с метформином или производными сульфонилмочевины18.
Ингибиторы ДПП-4 в целом не оказывают серьезного негативного воздействия на риск развития сердечно-сосудистых заболеваний. Тем не менее линаглиптин показал самую высокую в своем классе безопасность в отношении сердечно-сосудистых рисков (рис. 9)26–30.
Линаглиптин – единственный ингибитор ДПП-4, применение которого не требует коррекции дозы и/или дополнительного мониторинга функции почек у пациентов с сопутствующим заболеванием почек31. Это обусловлено тем, что 95% принятого перорально линаглиптина экскретируется с желчью и фекалиями и лишь 5% – почками. Другие ингибиторы ДПП-4 выводятся из организма преимущественно почками. Так, доля почечной экскреции в случае ситаглиптина составляет 87%, вилдаглиптина – 85%, саксаглиптина – 75%.
«Препарат не метаболизируется в печени, а значит, отсутствует эффект лекарственного взаимодействия, – поясняет профессор А.М. Мкртумян. – Этим объясняется возможность применения линаглиптина в комбинации с другими пероральными сахароснижающими средствами (например, метформином) или в сочетании с антитромботическими средствами (варфарин), гиполипидемическими препаратами (симвастатин) или сердечными гликозидами (дигоксин). Кроме того, линаглиптин (Тражента) очень удобен в применении: единственная дозировка (5 мг) принимается 1 раз в сутки независимо от приема пищи».
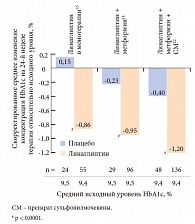
В конце своего выступления профессор А.М. Мкртумян очертил основные схемы терапии с использованием линаглиптина. В режиме монотерапии препарат демонстрирует высокую эффективность у пациентов с высоким уровнем HbA1c (причем чем ниже компенсация заболевания, тем выше эффективность терапии линаглиптином)15. Согласно рекомендациям Российской ассоциации эндокринологов (Консенсус РАЭ, 2011), добавление ингибитора ДПП-4 к метформину возможно уже в первой линии терапии СД 2 типа. Данные исследований показали, что к 24-й неделе терапии метформином в комбинации с линаглиптином отмечалось статистически достоверное (p < 0,0001) скорректированное по плацебо снижение уровня HbA1c на 0,64%18, при этом наиболее высокая эффективность (снижение уровня HbA1c на 1,7%) отмечалась при старте терапии линаглиптином 2,5 мг в комбинации с метформином в дозировке 1000 мг 2 раза в сутки.
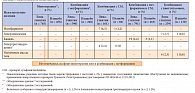
Существуют данные клинических исследований об эффективности линаглиптина в комбинации с метформином и препаратами сульфонилмочевины. Практический интерес представляют результаты исследования эффективности линаглиптина в сравнении с глимепиридом (рис. 10)32: если начиная с 10–12-й недели от начала лечения на фоне терапии глимепиридом отмечалось более значимое снижение уровня HbA1c по сравнению с терапией линаглиптином, то к 50–55-й неделе от старта терапии показатели HbA1c в обеих группах уравниваются. «К концу 104-й недели терапии 75,6% пациентов, получавших линаглиптин, и 76,4% пациентов, принимавших глимепирид, достигли целевого уровня HbA1c 7%.
Данные этого исследования могут развенчать миф о несопоставимой с препаратами других классов сахароснижающей “силе” производных сульфонилмочевины», – комментирует профессор А.М. Мкртумян. Важно, что линаглиптин может использоваться (без необходимости коррекции дозировки) у различных групп пациентов независимо от длительности диабета и сопутствующих заболеваний: у пациентов любого возраста (включая лиц пожилого возраста), у пациентов с нарушением функции печени, почек, у больных с сердечно-сосудистой патологией, у пациентов, страдающих ожирением или недостатком массы тела. Завершая выступление, профессор А.М. Мкртумян еще раз акцентировал внимание участников симпозиума на клинических преимуществах Траженты (линаглиптина) в сравнении с другими ингибиторами ДПП-4:
- одна дозировка один раз в день для всех пациентов с СД 2 типа;
- не требуется коррекции дозы при нарушении функции почек (в отличие от ситаглиптина, вилдаглиптина, саксаглиптина);
- не требуется дополнительного мониторинга функции почек (в отличие от ситаглиптина и саксаглиптина);
- не требуется коррекции дозы при нарушении функции печени (в отличие от вилдаглиптина и ситаглиптина);
- не требуется коррекции дозы с учетом лекарственных взаимодействий (в отличие от саксаглиптина, ситаглиптина и вилдаглиптина);
- отсутствие гепатотоксичности (в отличие от вилдаглиптина).
Уникальные особенности и терапевтические свойства нового ингибитора ДПП-4 линаглиптина (препарат Тражента) обсуждались в докладах члена-корреспондента РАМН, профессора Марины Владимировны ШЕСТАКОВОЙ и профессора Ашота Мусаеловича МКРТУМЯНА на симпозиуме «Как добиться успеха в терапии СД 2 типа: новые возможности в лечении ингибиторами ДПП-4».
Симпозиум, организованный при поддержке компаний «Берингер Ингельхайм» и «Эли Лилли», прошел 30 мая 2012 г. в рамках VI Всероссийского конгресса эндокринологов.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.