Как улучшить результаты терапии бронхиальной астмы и других воспалительных заболеваний нижних дыхательных путей. XXVI Национальный конгресс по болезням органов дыхания. Сателлитный симпозиум компании «Сандоз»
- Аннотация
- Статья
- Ссылки




Стандарты и индивидуальный подход к терапии бронхиальной астмы
Профессор, д.м.н., заведующая отделением бронхиальной астмы Института иммунологии ФМБА России Оксана Михайловна КУРБАЧЕВА открыла симпозиум докладом о подходах к лечению бронхиальной астмы (БА), основанных на современных рекомендациях. Она отметила, что лечение БА предполагает исключительно индивидуальный подход к пациенту. Бронхиальная астма – гетерогенное заболевание, обычно характеризующееся хроническим воспалением дыхательных путей. Астма проявляется респираторными симптомами – свистящими хрипами, затрудненным дыханием, заложенностью в груди, кашлем, интенсивность которых со временем меняется. На каком-либо этапе заболевания у пациентов с БА могут отсутствовать перечисленные симптомы, поскольку течение заболевания вариабельно и зависит от множества факторов.
Воспаление – универсальный патологический процесс, представляющий важную защитно-приспособительную реакцию, эволюционно сформировавшуюся как способ сохранения целого организма ценой повреждения его части. Воспаление может быть инфекционного и неинфекционного происхождения. В основе развития БА лежит аллергическое воспаление, тесно связанное с бронхиальной гиперреактивностью.
Последние годы активно обсуждается вопрос, касающийся фенотипов БА. Под фенотипом понимают видимые характеристики организма, обусловленные взаимодействием его генетической составляющей и факторов внешней среды. Выделение фенотипов БА позволяет обеспечить индивидуальный подход к ведению пациентов на этапах динамического наблюдения, выбора терапии и прогнозирования заболевания. Существуют такие фенотипы, как аллергическая и неаллергическая БА, астма с поздним дебютом, астма с фиксированной бронхиальной обструкцией, астма на фоне ожирения, синдром перекреста (астмы и хронической обструктивной болезни легких (ХОБЛ)).
Сегодня с позиции доказательной медицины рассматривается понятие, которое нередко сопряжено с фенотипом, – эндотип. Эндотип в моно- или сочетанном варианте характеризует патогенетические механизмы, лежащие в основе формирования определенного клинического фенотипа. На основании молекулярного эндотипирования в рамках эндотипов Th2 и неTh2 выделяют определенные фенотипы БА.
Тh2-эндотип объединяет разные варианты БА и эозинофильного воспаления. Тh2-эндотип включает в себя аллергическую (атопическую) астму, аспириновую БА, которая может сочетаться с атопией, позднюю эозинофильную БА, частично синдром перекреста (атопическая БА в сочетании с ХОБЛ). НеТh2-эндотип – астма с очень поздним дебютом, астма с ожирением, астма курильщиков или нейтрофильная астма некурящих, а также малогранулоцитарная БА1.
Выбор терапии БА строго индивидуален и зависит от фенотипа и эндотипа, этиологических факторов и факторов риска, характера течения заболевания.
Целью лечения БА является достижение и поддержание полного контроля над симптомами заболевания, а также минимизация потенциальных рисков в будущем. Это достигается не только за счет применения оптимальной терапии, эффективность и безопасность которой подтверждена в многочисленных клинических исследованиях и реальной клинической практике. Для достижения контроля БА и предотвращения развития обострений в будущем необходим также индивидуальный подход к пациенту с учетом его предпочтений, способности адекватно применять лекарственное средство, стоимости терапии. Такой подход позволит повысить эффективность лечения и приверженность ему больного.
На эффективность терапии БА существенно влияют комплаентность пациента, техника ингаляции, внешние факторы (аллергены и др.), а также сопутствующие заболевания.
Ведущими экспертами по различным аспектам БА разработана международная программа GINA (Global Initiative for Asthma – Глобальная стратегия по лечению и профилактике бронхиальной астмы), определяющая основные направления диагностики, терапии и профилактики БА. На основании GINA подготовлены клинические рекомендации и руководства по лечению БА.
Согласно GINA, принципом лечения БА является ступенчатый подход с увеличением объема терапии в отсутствие контроля и/или при наличии факторов риска обострений. У пациентов с БА часто имеет место сопутствующая патология. Аллергический ринит и другие патологические заболевания слизистой оболочки носа напрямую влияют на состояние пациента с БА. Препаратами выбора в лечении аллергического ринита у пациентов с БА считаются интраназальные глюкокортикостероиды (ГКС). Они оказывают противоаллергический и противовоспалительный эффект. Доказано, что назначение интраназальных ГКС снижает риск обострений БА. Пациенты, которым было выписано более трех рецептов в год на интраназальные ГКС, в два раза реже обращались за неотложной помощью по поводу ухудшения течения БА. Добавление интраназальных ГКС к противоастматической терапии позволило снизить риск обострений БА на 30%. При этом не выявлено достоверного снижения числа обращений у пациентов, которым выписывались только антигистаминные препараты2.
Сегодня ингаляционные ГКС признаны наиболее эффективными противовоспалительными препаратами в терапии БА, начиная со второй ступени. На фоне их применения снижается не только воспаление в дыхательных путях, но также гиперреактивность бронхов, выраженность симптомов и частота обострений. Комбинации ингаляционных ГКС и бета-2-агонистов длительного действия (ДДБА) – основа терапии БА. Подобная комбинация обеспечивает более эффективный контроль БА по сравнению с монотерапией ГКС. При этом противовоспалительный эффект достигается вдвое меньшими дозами ингаляционных ГКС. Кроме того, наличие ингаляционного ГКС способствует повышению плотности бета-рецепторов на мембране клеток-мишеней3. На территории Российской Федерации зарегистрированы и разрешены к применению следующие ингаляционные ГКС: будесонид, флутиказона пропионат, циклесонид, беклометазона дипропионат и мометазона фуроат.
Течение БА может ухудшиться даже на фоне лечения и потребовать изменения объема терапии. Причинами обострения, требующего увеличения дозы ингаляционных ГКС, могут быть массивный и длительный контакт с аллергеном (например, сезон цветения), респираторные вирусные инфекции, прием нестероидных противовоспалительных препаратов (НПВП), профессиональные факторы, курение. Увеличение дозы бронхолитика необходимо в фазе обострения БА одновременно с увеличением дозы ингаляционных ГКС, а также превентивно перед вынужденным и краткосрочным контактом с аллергеном или физической нагрузкой без изменения дозы ингаляционного ГКС, при сочетании БА и ХОБЛ.
Изменение объема противоастматической терапии подразумевает коррекцию доз принимаемых препаратов, добавление к базисной терапии препаратов других групп, смену препарата внутри одной фармакологической группы.
Если контроль БА достигнут на фоне терапии комбинацией ингаляционных ГКС и ДДБА, предпочтительно начинать уменьшение объема терапии со снижением дозы ингаляционного ГКС примерно на 50% при продолжении терапии ДДБА. При сохранении контроля БА следует продолжать снижение дозы ингаляционных ГКС до низкой, на фоне которой возможно прекращение терапии ДДБА.
Относительно новым направлением патогенетической терапии БА считается использование антагонистов лейкотриеновых рецепторов.
Влияние на ремоделирование бронхиального дерева антилейкотриеновых препаратов (АЛП) связывают с их способностью снижать проницаемость сосудов дыхательных путей и пролиферацию гладкомышечных элементов.
Антилейкотриеновые препараты целесообразно использовать при аллергическом рините и БА для исключения полипрагмазии и первичной профилактики, а также в качестве стартовой терапии легкой БА. АЛП (монтелукаст) применяют при средней и тяжелой степени БА для усиления терапевтического эффекта ингаляционных ГКС или комбинированной терапии с целью улучшения контроля БА и снижения доз ингаляционных ГКС. Противовоспалительное действие АЛП отличается от такового ингаляционных ГКС и реализуется через подавление иных механизмов воспаления. Эти две группы препаратов оказывают взаимодополняющий противовоспалительный эффект.
Включение АЛП в комплексную терапию аспириновой БА обеспечивает дополнительный клинический эффект. При астме физического усилия монотерапия препаратами антагонистов лейкотриеновых рецепторов позволяет детям и подросткам с БА заниматься спортом, получать физическую нагрузку. Кроме того, АЛП применяют в профилактике сезонных обострений БА (вирус-индуцированная астма).
Таким образом, контроля БА можно достичь, подобрав индивидуальную терапию в зависимости от фенотипа заболевания. Важную роль играют элиминационные мероприятия, направленные на прекращение или уменьшение контакта с причинно-значимым аллергеном. Аллергенспецифическая иммунотерапия (АСИТ) – снижение чувствительности организма к причинно-значимому аллергену путем введения постепенно возрастающих доз аллергенов. АСИТ считается патогенетически оправданной при легкой и среднетяжелой формах БА, поскольку позволяет модифицировать характер воспаления, уменьшить потребность пациента в противоаллергических препаратах, предупредить трансформацию аллергического ринита в БА и расширение спектра аллергенов, к которым формируется повышенная чувствительность. Чем в более раннем возрасте и на более ранних стадиях развития болезни проведена АСИТ, тем выше ее эффективность. В отличие от существующих методов лечения атопических заболеваний положительный эффект АСИТ носит длительный характер.
Вирус-индуцированная астма: лечение и профилактика
По словам д.м.н., профессора кафедры клинической аллергологии Российской медицинской академии непрерывного профессионального образования Натальи Михайловны НЕНАШЕВОЙ, несмотря на фенотипическую гетерогенность БА, большинство пациентов достигают контроля заболевания на фоне терапии ингаляционными ГКС и бета-2-агонистами. В то же время некоторые фенотипы астмы трудно поддаются лечению. Это БА при ожирении, астма курящих, БА с частыми вирус-индуцированными обострениями, поздняя БА (БА пожилых), тяжелая эозинофильная БА. У пациентов с такими фенотипами БА ответ на лечение ингаляционными ГКС снижен.
Среди трудных фенотипов БА особое место занимает вирус-индуцированная БА, поскольку респираторные вирусные инфекции способны приводить к потере контроля над заболеванием и развитию обострения. По данным исследований, респираторные вирусные инфекции (риновирусы, респираторно-синцитиальный (РС) вирус, грипп, парагрипп, метапневмовирусы, аденовирусы) являются самой частой причиной развития бронхообструктивного синдрома у детей – от 6 до 26%. Частые и тяжелые респираторные инфекции в детстве увеличивают риск развития БА и ХОБЛ во взрослом возрасте. У лиц с атопией отмечается склонность к более тяжелым вирусным инфекциям, а аллерген и вирус действуют как синергисты. Респираторные вирусы вызывают гиперпродукцию IgE, бронхиальную гиперреактивность, сенсибилизацию к неинфекционным аллергенам.
Как показали результаты исследований, перенесенная респираторная вирусная инфекция, сопровождаемая свистящим дыханием, у детей первых трех лет жизни существенно повышает риск развития детской БА в последующие годы. Сенсибилизация к аэроаллергенам у детей первых трех лет жизни значительно повышает риск развития детской БА, который становится особенно высоким при сочетании с синдромом свистящего дыхания в результате респираторной инфекции4–6.
Существует ассоциация между вирусными заболеваниями дыхательных путей и риском развития БА в последующем, который зависит от сопутствующего атопического заболевания. Лица без атопии имеют нормальный эпителиальный барьер и полноценную противовирусную защиту в отличие от лиц с атопией, у которых эпителиальный барьер и противовирусная защита нарушены. При инфекции риновирусами и РС-вирусом у пациентов без атопии развивается легкое заболевание верхних дыхательных путей. Имеют место эффективный вирусный клиренс и нормальное восстановление эпителия. При вирусной респираторной инфекции у пациентов с атопией на фоне сниженной способности мононуклеарных клеток крови к продукции интерферона (ИФН) гамма и интерлейкина 12 уменьшается вирусный клиренс, что приводит к развитию инфекции нижних дыхательных путей, хроническому воспалению и повреждению эпителия.
В сравнительном исследовании с участием детей с аллергической БА, с аллергией, но без БА и здоровых детей дефицит в интерфероновом ответе приводил к вирус-индуцированному дебюту БА и/или вирус-индуцированному обострению уже существующей астмы. Так, дети с аллергической БА имели значительно меньшую вирус-индуцированную (риновирус) продукцию ИФН-альфа и ИФН-лямбда мононуклеарными клетками периферической крови в отличие от детей с аллергией без БА и здоровых детей7.
Между вирусом и аллергеном существует определенная взаимосвязь. Респираторные вирусы взаимодействуют с аллергенами, способствуя развитию и/или обострению БА. Экспозиция с аллергеном в период вирусной инфекции приводит к повышенной сенсибилизации к данному аллергену и увеличению бронхиальной гиперреактивности8.
При наличии атопии путь развития БА связан с экспрессией высокоаффинных рецепторов к IgE. Респираторные вирусы – уникальные агенты, способные вызывать развитие БА независимо от атопии и аллергии. Генетические исследования детской БА показали высокий риск развития заболевания, связанный с локусом на хромосоме 17q21. Генетические изменения в этом участке обусловлены повышенным риском именно БА, но не атопии9.
У лиц молодого возраста, перенесших в детстве РС-инфекцию нижних дыхательных путей, повышенный риск развития БА связан с курением10.
Таким образом, существует множество неопровержимых доказательств связи большинства обострений БА с респираторными вирусными инфекциями. Показано, что пики обострений астмы у детей, требующих стационарного лечения, чаще наблюдаются в сентябре. Начало занятий в школе после летних каникул совпадает с пиком риновирусной инфекции. Как известно, пиковые периоды риновирусной инфекции наблюдаются в начале осени, в меньшей степени весной11. При этом 75–80% вирус-индуцированных обострений БА у детей, подростков и молодых людей обусловлены риновирусами12.
Риновирусная инфекция у больных БА индуцирует снижение легочной функции, ухудшение симптомов, повышение бронхиальной гиперреактивности и увеличение эозинофильного воспаления, то есть основных признаков обострения БА. Цис-лейкотриены, равно как и цитокины, играют ключевую роль в формировании воспаления и ремоделировании при БА. Респираторные вирусные инфекции активируют 5-липоксигеназу в клетках слизистой оболочки бронхов, обеспечивая тем самым повышенный синтез цис-лейкотриенов в нижних дыхательных путях. У детей с вирус-индуцированным бронхиолитом и бронхообструктивным синдромом отмечается повышенный уровень цис-лейкотриенов. Следует отметить, что ингаляционные ГКС незначительно влияют на уровень лейкотриенов в мокроте у пациентов с БА.
Таким образом, механизмами формирования обострения БА в результате респираторной вирусной инфекции являются:
- активация воспаления в слизистой оболочке нижних дыхательных путей;
- повышение парасимпатического тонуса на фоне снижения вирусами экспрессии М2-рецепторов;
- увеличение бронхиальной гиперреактивности, синтеза цис-лейкотриенов в слизистой оболочке верхних и нижних дыхательных путей;
- уменьшение эффективности ингаляционных ГКС;
- развитие десенситизации бета-2-адренорецепторов в результате избыточного синтеза простагландинов.
Эффективное лечение и профилактика вирус-индуцированных обострений БА как у детей, так и у взрослых позволяет предотвратить развитие вирусных обострений и сохранить хороший контроль БА. В настоящее время разработаны действенные схемы терапии для пациентов с БА разного генеза. В частности, предусмотрено добавление ингибиторов лейкотриеновых рецепторов к обычной терапии БА в виде монотерапии или комбинации с ингаляционными ГКС. Антагонисты лейкотриеновых рецепторов способны эффективно предотвращать развитие обострений у больных с легкой формой БА.
В двойном слепом плацебоконтролируемом исследовании изучали эффективность монтелукаста, добавленного к обычной терапии БА, в сокращении дней с ухудшением симптомов астмы и незапланированных визитов к врачу в течение осеннего пика у детей разного возраста.
Как показали результаты исследования, в группе терапии монтелукастом имела место 53%-ная редукция дней с ухудшением симптомов в отличие от группы плацебо (3,9 и 8,3% соответственно) и 78%-ное сокращение незапланированных визитов к врачу по поводу БА (4 и 18 соответственно). Монтелукаст продемонстрировал эффективность у детей, получавших регулярную терапию ингаляционными ГКС, и у тех, кто не получал ее, а также у пациентов с проявлениями респираторной вирусной инфекции во время исследования, и у тех, кто не отмечал таких проявлений. Разница в эффективности зависела от возраста и пола. У мальчиков в возрасте от двух до пяти лет эффективность монтелукаста была выше, чем у мальчиков постарше. Среди девочек более значимый эффект зафиксирован в группе от десяти до 14 лет13.
В двойном слепом плацебоконтролируемом исследовании изучали эффективность монтелукаста в предотвращении вирусиндуцированных обострений БА у детей в возрасте от двух до пяти лет с интермиттирующей БА. Пациенты получали 4 мг монтелукаста или плацебо однократно на протяжении 12 месяцев. Применение монтелукаста способствовало значительному (на 31,9%) снижению числа обострений БА и увеличению времени до первого обострения БА на два месяца по сравнению с плацебо (р = 0,024). Кроме того, у детей, получавших монтелукаст, отмечалось сокращение курсов ингаляционных ГКС по сравнению с детьми, применявшими плацебо14.
Завершая выступление, профессор Н.М. Ненашева констатировала, что респираторные вирусные инфекции являются наиболее частой причиной развития бронхообструктивного синдрома у маленьких детей и наиболее частыми триггерами обострений БА у детей, подростков и взрослых с уже установленным диагнозом заболевания. Направленная терапия, блокирующая лейкотриеновый путь воспаления, имеет доказанную эффективность в отношении особых фенотипов БА: у детей и подростков с вирус-индуцированной астмой, пациентов с аспириновой БА, больных с выраженным бронхоспазмом в ответ на физическую нагрузку, курящих пациентов как в виде монотерапии, так и в комбинации с ингаляционными ГКС.
Возможности противовоспалительной терапии при острых респираторных заболеваниях нижних дыхательных путей: от клинических рекомендаций к ежедневной практике
Доцент кафедры клинической фармакологии и пропедевтики внутренних болезней Первого Московского государственного медицинского университета им. И.М. Сеченова, к.м.н. Надежда Георгиевна БЕРДНИКОВА в начале своего выступления рассказала об этиологии острых респираторных инфекций (ОРИ). Это общее название клинически сходных острых инфекций, передаваемых воздушно-капельным путем и характеризующихся воспалением слизистой оболочки дыхательных путей, реже конъюнктивитом и/или отитом. В настоящее время терапия пациентов с ОРИ носит преимущественно симптоматический характер и направлена главным образом на купирование основных клинических проявлений. Наиболее частыми возбудителями ОРИ являются вирусы или ассоциации вирусов и бактерий.
Анализ результатов эпидемиологического сезона 2015–2016 гг. по гриппу и ОРИ продемонстрировал, что всего было зарегистрировано 2 436 204 пациента с гриппом и ОРИ. В инфекционные стационары Москвы за эпидемиологический сезон госпитализировано 54 060 больных с диагнозом гриппа и ОРИ. Доля госпитализированных детей составила 77,4%15.
В 2013 г. эксперты Всемирной организации здравоохранения (ВОЗ) выступили с инициативой по борьбе с острыми респираторными вирусными инфекциями (ОРВИ) BRaVe (Battle against Respiratory Viruses initiative). Инициатива BRaVe – новое руководство ВОЗ для инициации мультидисциплинарных исследований стратегий профилактики и лечения респираторных вирусных инфекций с целью своевременной интеграции научных достижений и технических новшеств в практику общественного здравоохранения.
Одним из основных этапов патогенеза гриппа и других респираторных вирусных инфекций является репродукция вируса в клетках органов дыхательной системы, в ответ на которую происходят вирусемия, токсические или токсико-аллергические реакции макроорганизма. Развиваются воспалительные процессы с преимущественной локализацией в различных отделах дыхательных путей, проявляющиеся такими симптомами, как кашель, отделение мокроты, одышка, заложенность носа. Эти процессы протекают в двух направлениях: обратное развитие патологического процесса либо возникновение бактериальных осложнений. При воспалительном процессе в ответ на внедрение вирусного агента возникают сосудистые изменения, обусловленные вазодилатацией, увеличением проницаемости сосудов и экссудацией. Это приводит к высвобождению медиаторов воспаления и повышению секреции слизи (гиперсекреция). В результате нарушается проходимость нижних дыхательных путей, снижается мукоцилиарный клиренс и формируются предпосылки для развития осложнений.
Таким образом, больные ОРИ требуют назначения не только этиотропной, но и противовоспалительной терапии, которая становится обязательным компонентом патогенетического лечения. В настоящее время в качестве терапии ОРИ используются препараты нескольких групп, воздействующие на потенциальные мишени для контроля воспаления. Лекарственные средства оказывают противовоспалительный эффект за счет воздействия на разные уровни метаболизма арахидоновой кислоты: ГКС блокируют фосфолипазу А2, стимулируя синтез белка-ингибитора, НПВП ингибируют циклооксигеназный путь образования простагландинов и тромбоксана, блокаторы лейкотриенов подавляют липооксигеназный путь образования лейкотриенов, фенспирид уменьшает поступление в клетку ионов кальция, ответственного за активацию фосфолипазы А2.
Фенспирид – препарат с бронхолитической и противовоспалительной активностью, который не относится к НПВП и ГКС. Фенспирид уменьшает симптомы воспаления, такие как отечность, гиперсекреция, бронхообструкция, гиперреактивность бронхов, снижает выработку ряда биологически активных веществ, участвующих в развитии воспаления и способствующих повышению тонуса бронхов, подавляет образование гистамина, ингибирует Н1-гистаминовые рецепторы. Противовоспалительная активность фенспирида обусловлена уменьшением продукции ряда биологически активных веществ (цитокинов, особенно фактора некроза опухоли альфа, производных арахидоновой кислоты, свободных радикалов), играющих важную роль в развитии воспаления.
По данным эпидемиологических исследований, ОРИ характеризуются полиэтиологичностью. Известно свыше 250 возбудителей ОРИ, примерно 20% приходится на микст-инфекции у детей. В структуре заболеваемости взрослых пациентов вирусы гриппа составляют 23%, аденовирусы – 23%, РС-вирусы – 15%, вирусы парагриппа – 8%, пикорнавирусы (ротавирусы, энтеровирусы) – 31%. Основными возбудителями ОРИ могут быть не только вирусы, но и бактерии, в том числе внутриклеточные организмы.
Результаты многоцентрового фармакоэпидемиологического исследования ПАТРИОТ (Практика антибактериальной терапии инфекций дыхательных путей и ЛОР-органов у детей) с участием 4952 детей в возрасте от года до 17 лет из 18 городов России показали, что наиболее частой причиной обращения за медицинской помощью являются ОРИ. При этом системную антибактериальную терапию получали 74,7% пациентов, из них 59,6% – пациенты с неосложненной ОРИ. В восьми из 18 городов при неосложненных ОРИ антибактериальную терапию назначали в 100% случаев. Частота обоснованных назначений системных антибиотиков составила в среднем 51,5%. Выбор режима антибактериальной терапии был адекватным в среднем у 45,2% пациентов16.
При ОРИ и гриппе применяют этиотропную терапию, направленную на угнетение репродукции вирусов, патогенетическую и симптоматическую терапию. Необходимым компонентом является профилактика осложнений у больных, входящих в группу риска: дети, лица в возрасте 60 лет и старше, больные сахарным диабетом, пациенты, получающие химиотерапию, цитостатики, ГКС, пациенты с обострением соматических заболеваний.
В многоцентровом рандомизированном сравнительном исследовании ЭРА (Эффективность противовоспалительной терапии острых респираторных заболеваний в амбулаторной практике) участвовали 260 врачей и 1309 пациентов в возрасте 18–70 лет с острыми респираторными заболеваниями из десяти регионов России17. Исследователи оценивали динамику симптоматики острого ринита при введении в схему лечения противовоспалительных препаратов. Основная группа пациентов получала фенспирид 80 мг три раза в день в течение десяти дней, парацетамол. Пациентам контрольной группы назначили парацетамол, муколитики, антигистаминные препараты и антисептики. Оценка динамики клинических симптомов у пациентов с ринитом на фоне приема фенспирида показала более выраженное уменьшение выделений из носа и заложенности носа (рис. 1).
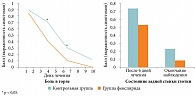
Аналогичная ситуация складывалась у пациентов с острым фарингитом. Боль в горле при использовании фенспирида удавалось купировать в более короткие сроки. Сравнительный анализ результатов лечения показал, что динамика интенсивности кашля и состояния задней стенки глотки в основной группе была достоверно лучше, чем в контрольной (рис. 2).
На фоне лечения фенспиридом у пациентов с острым ларинготрахеитом динамика мокроты была более интенсивной. То же отмечалось и у пациентов с острым бронхитом.
Противовоспалительная эффективность фенспирида подтверждена результатами многоцентрового открытого рандомизированного контролируемого исследования ЭСКУЛАП, в котором участвовали 730 пациентов в возрасте 20–55 лет с разными нозологическими формами ОРВИ. Исследователи сделали вывод, что применение фенспирида в комплексном лечении позволяет в более короткие сроки купировать симптомы ОРВИ, быстрее восстановить трудоспособность, качество жизни, а также снизить стоимость лечения и объем сопутствующей терапии (муколитики, бронхолитики, антигистаминные препараты)18.
Таким образом, обширная доказательная база свидетельствует о положительном эффекте фенспирида при ОРИ.
В заключение Н.Г. Бердникова еще раз подчеркнула, что преимуществами включения противовоспалительного препарата в схему лечения заболеваний верхних и нижних дыхательных путей являются более быстрое купирование симптомов, уменьшение длительности заболевания и риска развития осложнений. Хороший фармакологический профиль, возможность комбинации с другими препаратами, безопасность и незначительное количество побочных эффектов позволяют использовать фенспирид у пациентов разных возрастных групп. Эти характеристики являются решающими в случае длительного использования фенспирида при хронических заболеваниях, таких как хронический отит и синусит.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.