Клиническая эффективность тиоктовой кислоты при лечении синдрома диабетической стопы
- Аннотация
- Статья
- Ссылки
- English
В статье приводятся данные об эффективности комплексной терапии с добавлением тиоктовой кислоты у 134 пациентов с синдромом диабетической стопы. Особое внимание уделено влиянию препарата на раневой процесс.
В статье приводятся данные об эффективности комплексной терапии с добавлением тиоктовой кислоты у 134 пациентов с синдромом диабетической стопы. Особое внимание уделено влиянию препарата на раневой процесс.
Введение
Синдром диабетической стопы – осложнение сахарного диабета, характеризующееся специфическими патогенетическими звеньями, такими как диабетическая полиневропатия, нарушение циркуляции крови в периферических отделах конечностей, патология опорно-двигательного аппарата нижних конечностей, гнойно-септические процессы в тканях стопы [1].
Согласно данным экспертов Всемирной организации здравоохранения (ВОЗ), в настоящее время в мире насчитывается 422 млн больных сахарным диабетом, более 50% из них страдают синдромом диабетической стопы различной степени тяжести.
Прогрессирование нарушений при синдроме диабетической стопы с присоединением инфекционного процесса требует экстренного оперативного лечения, в 28% случаев приводит к ампутации нижней конечности [1, 2]. В течение 12 месяцев после операции смертность среди таких пациентов достигает 5%, через пять лет – 42% [3]. При высоких ампутациях вероятность смертельного исхода превышает 40%, что обусловлено трудно поддающимися лечению генерализованными септическими осложнениями, тяжелым течением позднего сахарного диабета, отягощенным коморбидным фоном [2–5].
Основная роль в патогенезе синдрома диабетической стопы отводится ишемии и невропатии [6]. На коррекцию этих состояний и направлены многие новые методы консервативного лечения [7–9]. Одним из наиболее перспективных считается тиоктовая кислота, эффект которой подтвержден с позиции доказательной медицины [10].
Тиоктовая кислота является эндогенным антиоксидантом, который служит активатором липогенеза, нейро- и гепатопротектором [11, 12].
Целью настоящего исследования стала оценка влияния тиоктовой кислоты на результаты лечения пациентов с синдромом диабетической стопы.
Материал и методы
Исследование выполнено на базе Первой республиканской клинической больницы Министерства здравоохранения Удмуртской Республики.
В исследование отобрано 184 пациента с сахарным диабетом и синдромом диабетической стопы, находившихся на стационарном лечении в Первой республиканской клинической больнице с 2016 по 2021 г.
Все больные подписали информированное согласие на участие в исследовании, которое было составлено согласно требованиям ВОЗ по правилам Надлежащей клинической практики.
Исследование получило одобрение этического комитета Ижевской государственной медицинской академии.
Все участники исследования были разделены на две группы. В первую (контрольную) группу вошли 50 больных, которым проводилось лечение согласно принятым в Российской Федерации стандартам [7]. Вторую (основную) группу составили 134 пациента, получавших помимо стандартной терапии препарат тиоктовой кислоты.
Оценка эффективности лечения проводилась согласно действующим клиническим рекомендациям по диагностике и лечению синдрома диабетической стопы.
Тиоктовую кислоту вводили внутривенно капельно в дозе 600 мг/сут, разделенной на две процедуры в день. Длительность лечения составила 15 дней. В дальнейшем пациентов переводили на таблетированную форму препарата с приемом в течение месяца.
Лабораторные исследования предполагали проведение биохимического и общего анализов периферической венозной крови и мочи по стандартным методикам.
Иммуногистохимическое исследование осуществлялось с помощью непрямого иммунопероксидазного метода с последующим окрашиванием срезов (толщиной 5 мк) маркером пролиферации Ki-67 и маркером апоптоза p53. Для проведения данного исследования использовали видеоанализатор Video-Test-Morpho.
Для статистической обработки результатов использовали программу Statistica 6.0. Кроме того, применяли методы описательной статистики с целью получения среднего показателя (М) с последующим проведением множественного парного сравнения с помощью критерия Newman – Keuls. Данные считали достоверными при p < 0,05.
Результаты
Уточнен возрастной и гендерный состав основной группы. Так, 41,8% пациентов были в возрасте от 61 до 70 лет, 20,2% – от 71 до 80 лет, 19,4% – от 51 до 60 лет, 18,6% – от 30 до 50 лет. Среди пациентов основной группы 62 (46,3%) женщины, 72 (53,7%) мужчины.
У 115 (85,8%) больных имел место сахарный диабет 2 типа, у 19 (14,2%) – сахарный диабет 1 типа.
По степени компенсации синдрома диабетической стопы в основной группе пациенты были распределены следующим образом: 15 (11%) с компенсированной формой заболевания, 31 (23%) с субкомпенсированной, 88 (66%) с декомпенсацией.
Тяжесть течения синдрома диабетической стопы оценивалась по классификации Meggitt – Wagner. У большинства (85%) пациентов выявлена вторая и третья степени поражения нижних конечностей.
В основной группе невропатическая форма синдрома диабетической стопы диагностирована у 102 (76%) пациентов, нейроишемическая – у 24 (18%), ишемическая – у 8 (6%). В контрольной группе распределение по формам заболевания было следующим: 36 (72%), 11 (22%) и 3 (6%) человека соответственно.
Клиника синдрома диабетической стопы преимущественно была представлена проявлениями гнойно-некротического процесса тканей нижних конечностей, а именно: болевой синдром приступообразного характера различной интенсивности и интоксикация организма (лихорадка, общая слабость, снижение аппетита, диурез).
В связи с преобладанием невропатической формы в 64,2% случаев отмечалось формирование трофической язвы в области костей плюсны и подошвы. Средний размер язвы – 31,5 см2.
При проведении осмотра нижних конечностей наблюдались цианоз, гиперемия, сухость кожи, отек и деформация стоп. На подошве, боковых поверхностях стоп и в области головок плюсневых костей определялись межпальцевые трещины, опрелости, трофические язвы. При пальпации отмечалось снижение пульсации сосудов стопы и голени. Обнаружены изменения в виде молоткообразных и когтевидных деформаций пальцев стоп.
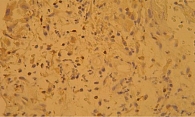
В ходе гистологического исследования язвенных дефектов на 21-й день у пациентов контрольной группы зафиксировано значительное нейтрофильное преобладание в инфильтрате, в меньшем объеме присутствие лимфоцитарных клеток, выраженные дистрофические и эндотелиальные изменения. Грануляции располагались на дне язвы и по ее краям. В них обнаруживалась активная лейкоцитарная инфильтрация. Оценка регенеративной способности ткани также была проведена на 21-й день путем окрашивания срезов маркерами пролиферации Ki-67 и апоптоза р53. Индекс пролиферации протеина Ki-67 составил 5,2%, что является низким показателем. Экспрессия р53 характеризовалась как слабопозитивная – 3,7% (рис. 1). Полученные данные указывают на существенно замедленное формирование грануляционной ткани в ранах у пациентов контрольной группы.
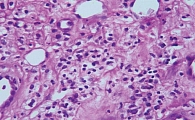
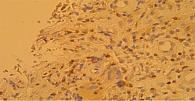
В основной группе к 21-му дню зафиксировано очищение ран. Интенсивность деструктивных процессов в тканях регрессировала и сохранялась в меньшем объеме. Преобладание лейкоцитарного компонента в инфильтрате снижалось, как следствие, выравнивалось соотношение лейкоцитов и лимфоцитов. Наблюдались усиленная пролиферация камбиальных эпителиальных клеток, интенсивные процессы заживления и эпителизации (рис. 2). Присутствие Ki-67 возросло и составило 9,5%. Экспрессия р53 увеличилась до 6,3%. В совокупности это свидетельствовало об усилении процессов регенерации (рис. 3).
Иммуногистохимическое исследование продемонстрировало более высокую степень эпителизации, образования грануляционной ткани и заживления ран у пациентов основной группы. Данные иммуногистохимического анализа находились в прямой корреляционной зависимости от результатов лабораторных анализов (r = 0,01).
При поступлении в стационар у пациентов обеих групп были выявлены снижение уровня гемоглобина до 91,7 ± 4,8 г/л и эритроцитов до 3,3 ± 0,9 × 1012/л, лейкоцитоз 38,12 ± 4,8 × 109/л, увеличение скорости оседания эритроцитов (СОЭ) до 29,7 ± 1,2 мм/ч, гипергликемия на уровне 11,2 ± 0,6 ммоль/л, гиперкреатинемия – 205,9 ± 16,4 мкмоль/л и повышение концентрации мочевины до 14,5 ± 2,1 ммоль/л (у пациентов контрольной группы p < 0,05 для всех показателей, кроме эритроцитов).
К 21-му дню пребывания в стационаре в контрольной группе гемоглобин повысился на 12,1%, количество лейкоцитов уменьшилось на 18,326 × 109/л, СОЭ – на 20,92%, количество лимфоцитов возросло на 10,4% (р < 0,05). Повышенные значения глюкозы в крови, а также мочевины и креатинина сохранялись до 20–39-го дня. В основной группе лабораторные критерии эндогенной интоксикации и анемии после проведения терапии изменились значительнее. Уровень гемоглобина увеличился на 18,05%, СОЭ уменьшилась на 25,78%, лейкоцитоз – на 23,54 × 109/л, соотношение лимфоцитов в формуле возросло на 14,8% (р < 0,05). Значения глюкозы, мочевины и креатинина крови приблизились к нормальным уже к 15–31-му дню от начала лечения.
Улучшение лабораторных показателей у пациентов основной группы коррелировало с клиническим улучшением. Так, 45% больных отмечали снижение либо полное исчезновение болевого синдрома к 6–8-м суткам. Пациенты также указывали на уменьшение общего недомогания, улучшение сна, аппетита, подвижности.
В контрольной группе интоксикация снизилась в среднем через 15,0 ± 4,7 дня (р < 0,05), болевой синдром – через 24,0 ± 8,9 дня (р < 0,05). В основной группе купирование клиники эндогенной интоксикации отмечено через 5,0 ± 1,7 дня (р < 0,05), болевого синдрома – через 15,0 ± 6,2 дня (р < 0,05).
В основной группе на фоне комплексной терапии, включавшей тиоктовую кислоту, обнаружено достоверное укорочение срока пребывания больных в стационаре. Так, в отсутствие гнойно-некротических осложнений время пребывания в стационаре пациентов контрольной группы составило 28,7 ± 0,4 койко-дня (р < 0,05), пациентов основной группы – 23,5 ± 0,8 койко-дня (р < 0,05), при наличии осложнений – 44,3 ± 0,6 и 36,1 ± 0,5 койко-дня соответственно (р < 0,05 для обеих групп).
Количество ампутаций уменьшилось с 12 до 7%.
Полученные данные указывают на обоснованное с клинической и экономической точек зрения включение препарата тиоктовой кислоты в комплексное лечение пациентов с синдромом диабетической стопы.
Заключение
Добавление к стандартной терапии тиоктовой кислоты оказывает положительное влияние на результаты лечения пациентов с синдромом диабетической стопы. Применение тиоктовой кислоты достоверно улучшает лабораторные показатели и заживление язвенного дефекта. Кроме того, в результате ее применения снижается количество дней пребывания в стационаре и случаев ампутации нижних конечностей.
S.N. Styazhkina, MD, PhD, Prof., A.Yu. Mikhailov, PhD, I.A. Kazakova, MD, PhD, Prof., A.D. Vasiliev, A.A. Zhuikova
Izhevsk State Medical Academy
Contact person: Svetlana N. Styazhkina, sstazkina064@gmail.com
Diabetic foot syndrome remains the significant problem of surgery, which is explained by purulent-necrotic complications associated with a high frequency of amputation of the lower extremities, as well as mortality. As a result, it is necessary to include new methods of this pathology correction, in particular thioctic acid, in the treatment regimen. Preparations of thioctic acid have an antioxidant effect, regulate energy balance, and improve tissue trophism.
The article provides data on the effectiveness of complex therapy with the addition of thioctic acid in 134 patients with diabetic foot syndrome. Special attention is paid to the effect of the drug on the wound process.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.