Клиническая фармакология ингибиторов дипептидилпептидазы 4: сравнительный обзор
- Аннотация
- Статья
- Ссылки
- English


Введение
Согласно оценкам экспертов Международной федерации диабета (International Diabetes Federation – IDF), в 2019 г. в мире сахарным диабетом (СД) страдало порядка 463 млн человек в возрасте от 20 до 79 лет, или 9,3% населения [1]. У 1,1 млн лиц в возрасте до 20 лет имел место СД 1 типа. Большая доля (90–95%) случаев приходилась на СД 2 типа. Именно за счет этих пациентов обеспечивается основной прирост заболеваемости, масштаб которой уже сравнили с неинфекционной эпидемией [2]. По прогнозам экспертов IDF, к 2030 г. в мире будет насчитываться 578 млн взрослых с СД, к 2045 г. – более 700 млн [1].
Однако данные официальной статистики могут быть существенно занижены. Считается, что более чем у половины больных диагноз не установлен. Так, согласно результатам национального эпидемиологического исследования NATION, истинная распространенность СД 2 типа среди взрослого населения России составляет 5,4% [3].
К наиболее значимым проблемам СД 2 типа относят высокую частоту осложнений, влияющих на общий прогноз. В частности, распространенность сердечно-сосудистых заболеваний среди пациентов с СД 2 типа в два – четыре раза выше, чем среди лиц без диабета [4]. Сахарный диабет без других традиционных сердечно-сосудистых факторов риска ассоциируется с увеличением сердечно-сосудистой смертности в 4,4 раза среди лиц одной возрастной группы [2].
У пациентов с диабетом велика вероятность наличия коморбидной патологии, то есть патологии, которая чаще наблюдается в данной популяции. В настоящее время к таковой относят аутоиммунные заболевания (для СД 1 типа), злокачественные новообразования различной локализации, когнитивные нарушения и деменцию, неалкогольную жировую болезнь печени, гепатит С, панкреатит, переломы костей, обструктивное апноэ во сне и др. [1]. Наконец, у пациентов с СД 2 типа имеют место те или иные проявления метаболического синдрома: избыточная масса тела или ожирение, артериальная гипертензия, атерогенная дислипидемия, гиперурикемия, микроальбуминурия, нарушение гемостаза.
Все перечисленные выше факторы наряду с преобладающим паттерном патогенеза СД 2 типа определяют необходимость индивидуального подхода к каждому пациенту при выборе тактики лечения.
В настоящее время в терапии СД 2 типа используется несколько классов препаратов, действующих как секретогены, инсулиновые сенситайзеры, инкретиномиметики, ингибиторы абсорбции глюкозы в кишечнике и реабсорбции глюкозы в почках. Каждый класс препаратов имеет дополнительные точки приложения, обладает достоинствами и недостатками.
В статье речь пойдет об общих свойствах класса ингибиторов дипептидилпептидазы 4 (ДПП-4) и клинически значимых фармакологических особенностях отдельных его представителей.
Ингибиторы ДПП-4, или глиптины, относятся к пероральным сахароснижающим препаратам, активным в отношении инкретинов и стимулирующим секрецию инсулина глюкозозависимым (физиологическим) образом.
Характеристика инкретиновой системы в норме и при сахарном диабете 2 типа
Инкретины – гормоны желудочно-кишечного тракта, которые выделяются в ответ на прием пищи и стимулируют секрецию инсулина. Наиболее изученными являются глюкагоноподобный пептид 1 (ГПП-1) и глюкозозависимый инсулинотропный полипептид (ГИП). В настоящее время известно, что инкретины образуются в энтерохромаффинных клетках кишечника: ГПП-1 – в L-клетках дистального отдела кишечника, ГИП – в K-клетках проксимальной части тонкой кишки (двенадцатиперстной и тощей). Высвобождение ГПП-1 и ГИП в кровь происходит уже при контакте нутриентов (углеводов, триглицеридов, аминокислот и протеинов) с соответствующими клетками, а также под влиянием нейрогуморальных стимулов [5]. Стимуляция секреции инсулина осуществляется через их рецепторы на β-клетках поджелудочной железы. Кроме того, ГПП-1 подавляет секрецию глюкагона, а также замедляет скорость опорожнения желудка и снижает аппетит [6].
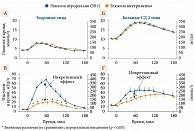
Доказано, что для физиологической стимуляции секреции инсулина инкретины имеют гораздо большее значение, чем степень гипергликемии. Внутривенное введение глюкозы в отличие от перорального повышает концентрацию инсулина лишь на одну треть, несмотря на одинаковый уровень достигаемой гликемии [7]. Эта разница в приросте инсулина при пероральном (действие гипергликемии плюс инкретинов) и внутривенном введении глюкозы (действие «чистой» гипергликемии) была названа инкретиновым эффектом (рис. 1) [5]. В зависимости от углеводной нагрузки инкретиновый эффект может обусловливать 25–70% постпрандиальной секреции инсулина у здоровых людей [8]. Важно подчеркнуть, что инкретиновый эффект является глюкозозависимым, то есть потенцирование секреции инсулина (как и ослабление секреции глюкагона посредством ГПП-1) возможно только при высоких значениях гликемии [7]. Дело в том, что для высвобождения инсулина из секреторных гранул нужно закрытие калиевых каналов, деполяризация β-клеток и вход ионов кальция, что инициируется гипергликемией. Соответственно чем выше гликемия, тем более выражен эффект инкретинов. Как только уровень глюкозы плазмы снижается до нормальных значений, инсулинотропный и антиглюкагоновый эффект исчезает. Глюкозозависимый механизм действия инкретинов позволяет избежать гипогликемии.
Однако ГПП-1 и ГИП в организме быстро расщепляются ДПП-4: период полужизни ГПП-1 составляет одну-две минуты, ГИП – две-три минуты [6].
Дипептидилпептидаза 4 – наиболее изученный фермент класса сериновых дипептидаз, включающего также ДПП-7 (ДПП II), ДПП-8, ДПП-9, белок активации фибробластов α (FAP-α, сепраза) и пролилкарбоксипептидазу (ангиотензиназа С) [9–11]. Данные ферменты по-разному распределяются в организме и обладают субстратной специфичностью. Так, ДПП-4 экспрессируется на поверхности различных типов клеток, преимущественно на эпителии экзокринных желез, тонкой и толстой кишки, проксимальных извитых канальцев почек, эндотелии сосудов, мембране гепатоцитов, фибробластов, активированных лимфоцитов, а также свободно циркулирует в крови [12, 13]. Она играет ключевую роль в инактивации ГПП-1, ГПП-2 и ГИП. Помимо инкретинов ДПП-4 метаболизирует как минимум 60 субстратов, включая ростовые факторы, хемокины, нейропептиды и вазоактивные пептиды [14]. В качестве неэнзиматической функции ДПП-4 указывается участие в стимуляции Т-лимфоцитов, регуляции воспалительного ответа в клетках врожденного иммунитета (моноцитов и дендритных клеток) [14, 15]. В последнее десятилетие накоплены данные о роли ДПП-4 и ГПП-1 во внутриклеточных механизмах передачи сигнала, инсулинорезистентности, оксидативном стрессе, метаболизме липидов, апоптозе, воспалении и атеросклерозе [16]. Фермент ДПП-4 (антиген CD26), экспрессируемый на поверхности лейкоцитов, участвует в медиации провоспалительных сигналов [17]. Активность ДПП-4 рассматривается как основной предиктор развития воспаления и атеросклероза [18].
У пациентов с СД 2 типа инкретиновый эффект значительно снижен (см. рис. 1). Причины и патогенез данного феномена до конца не ясны. Наиболее вероятными считаются уменьшение количества функционально активных β-клеток и развитие резистентности к эффектам инкретинов [7]. Необходимо отметить, что количество ГПП-1 или ГИП, как правило, не изменяется.
Введение ГИП оказывает минимальное влияние на секрецию инсулина у пациентов с СД 2 типа, особенно на ее позднюю фазу – с 20-й по 120-ю минуту (предполагается резистентность к эффекту). ГПП-1 способствует секреции инсулина, однако этот эффект слабее, чем у здоровых лиц, вероятно вследствие снижения количества активных β-клеток [5, 19]. Результаты ряда исследований позволяют сделать вывод, что нарушение инкретинового ответа, скорее всего, является следствием диабета, а не его причиной [8, 20].
Общая характеристика ингибиторов дипептидилпептидазы 4
Идею ингибирования ДПП-4 как перспективного подхода к лечению СД 2 типа впервые высказали 25 лет назад C.F. Deacon и соавт. [21]. Разработка препаратов, препятствующих разрушению инкретинов, вызывала интерес с точки зрения глюкозозависимой секреции инсулина, что обеспечивало минимальный риск гипогликемий в отличие от традиционных секретогенов – производных сульфонилмочевины.
Первый ингибитор ДПП-4 – ситаглиптин (Янувия) был одобрен для клинического применения в 2006 г. В течение последующих десяти лет на рынок были выведены еще 11 ингибиторов ДПП-4: вилдаглиптин, саксаглиптин, линаглиптин, алоглиптин (применяются во всем мире), гозоглиптин, гемиглиптин, эвоглиптин (зарегистрированы в Российской Федерации и ряде стран Азии и Латинской Америки), анаглиптин, омариглиптин, тенелиглиптин и трелаглиптин (используется преимущественно в Японии). Таким образом, на сегодняшний день в России доступны восемь ингибиторов ДПП-4.
Интерес к разработке новых препаратов данного класса не угас – на разных стадиях клинических исследований находятся несколько молекул (дутаглиптин, кармеглиптин, мелоглиптин, ретаглиптин и др.), запатентованы десятки перспективных соединений, идентифицированы даже природные ингибиторы ДПП-4, выделенные из растений, водорослей и рыб [22–24].
Согласно национальным и зарубежным клиническим рекомендациям, ингибиторы ДПП-4 могут использоваться как в виде монотерапии (как правило, при непереносимости или наличии противопоказаний для применения метформина) в дополнение к модификации образа жизни, так и в составе комбинированной двойной и тройной терапии, в том числе с инсулином [4, 25].
Общими свойствами ингибиторов ДПП-4 являются умеренный сахароснижающий эффект и переносимость, сопоставимая с переносимостью плацебо [26, 27].
Согласно результатам модельного метаанализа, ингибиторы ДПП-4 в режиме монотерапии за 26 недель снижали уровень гликированного гемоглобина (HbA1c) в среднем на 0,5–1,0% и по данному показателю уступали метформину, тиазолидиндионам, ингибиторам натрий-глюкозного котранспортера 2 (НГЛТ-2) и агонистам рецепторов ГПП-1 [28]. По сравнению с производными сульфонилмочевины сахароснижающий эффект ингибиторов ДПП-4 в краткосрочных исследованиях был менее выраженным, однако в исследованиях продолжительностью более одного года он оказался сопоставимым [29, 30].
Ингибиторы ДПП-4 не проникают через гематоэнцефалический барьер и в отличие от агонистов рецепторов ГПП-1 не имеют прямого влияния на аппетит, а также не изменяют скорость опорожнения желудка [31]. Исключением является омариглиптин (не зарегистрирован в России). Это ингибитор ДПП-4 длительного действия (принимается один раз в неделю), который благодаря низкой молекулярной массе и высокой липофильности способен преодолевать гематоэнцефалический барьер [32]. Более того, омариглиптин рассматривается как перспективный препарат для лечения нейродегенеративных заболеваний, в частности болезни Паркинсона [32]. Важно подчеркнуть, что нейропротективные эффекты были обнаружены и у других препаратов данного класса – ситаглиптина [33–35], вилдаглиптина [36], саксаглиптина [37] и линаглиптина [38], продемонстрировавших антиоксидантную активность, антиапоптотическое и нейрорегенеративное действие на модели паркинсонизма у животных. Эти данные требуют изучения. До настоящего времени ингибиторы ДПП-4 применяются исключительно для контроля гликемии у пациентов с СД 2 типа.
Что касается профиля безопасности, то терапия ингибиторами ДПП-4 ассоциируется с низким риском гипогликемий и отсутствием негативного влияния на массу тела. Кроме того, для препаратов не характерны побочные эффекты со стороны урогенитального тракта. В рамках клинических исследований наиболее часто сообщалось о гастроинтестинальных нежелательных явлениях и назофарингитах [26]. К редким относят кожные реакции гиперчувствительности и артралгии [25, 27]. Назофарингит, головная боль, тошнота и аллергия в определенной мере могут быть обусловлены ингибированием активности ДПП-4 и увеличением концентрации брадикинина и субстанции Р, способствующих повышению проницаемости сосудов [39]. Необходимо напомнить, что в деградации брадикинина и субстанции Р помимо ДПП-4 участвует ангиотензинпревращающий фермент, поэтому фармакологическое ингибирование обоих ферментов, особенно одновременное, теоретически может спровоцировать накопление вазоактивных кининов и увеличить риск аллергических реакций, в том числе ангионевротического отека [40].
Помимо гликемических описаны эффекты, напрямую не связанные с инсулинотропным действием ингибиторов ДПП-4. Это так называемые плейотропные эффекты. Во многом они опосредованы влиянием ГПП-1, ГИП и прочих субстратов ДПП-4, однако могут быть непосредственно связаны с нарушением внутриклеточных сигнальных путей ДПП-4 [41]. В данном случае речь идет о способности улучшать функцию β-клеток. В ряде экспериментальных исследований на моделях диабета у грызунов введение ингибиторов ДПП-4 в течение двух-трех месяцев приводило к увеличению количества функционально активных β-клеток за счет стимуляции пролиферации и ингибирования апоптоза [42, 43]. Несмотря на то что в других исследованиях не подтвердилось значимого влияния ингибиторов ДПП-4 на увеличение общей массы β-клеток [44, 45], в большинстве работ отмечалось восстановление нормального соотношения α- и β-клеток [46, 47] и содержания инсулина в островках поджелудочной железы [48].
В клинических исследованиях улучшение функции β-клеток у пациентов с СД 2 типа на фоне терапии ингибиторами ДПП-4 установлено на основании показателей базальной секреции инсулина – увеличение индекса гомеостатической модели оценки функции β-клеток (Homeostasis Model Assessment β-cell function – HOMA-β) и уменьшение соотношения «проинсулин/инсулин», а также параметров стимулированной секреции (более релевантных для оценки действия инкретиномиметиков) – повышение инсулиногенного индекса (отражает раннюю фазу секреции инсулина), увеличение площади под кривой концентрации (AUC) постпрандиального инсулина, скорректированной по глюкозе (отражает секрецию инсулина в течение всего постпрандиального периода), улучшение результатов перорального глюкозотолерантного теста и гипергликемического клэмп-теста [49]. Положительные изменения на фоне приема ингибиторов ДПП-4 поддерживались до двух лет в рамках продолженной фазы клинических исследований [49].
Недавно выполненный метаанализ, включавший 21 рандомизированное контролируемое клиническое исследование, показал, что ингибиторы ДПП-4 у пациентов с СД 2 типа обладают более выраженным протективным воздействием на функцию β-клеток по сравнению с ингибиторами α-глюкозидазы, но более скромным по сравнению с агонистами рецепторов ГПП-1 (на основании оценки HOMA-β и соотношения «проинсулин/инсулин») [50]. Кроме того, в отношении сохранения функции β-клеток ингибиторы ДПП-4 превосходили ингибиторы НГЛТ-2, но уступали метформину (если принимать во внимание только соотношение «проинсулин/инсулин», но не величину HOMA-β, которая значимо не различалась между данными классами препаратов).
К спектру плейотропных эффектов ингибиторов ДПП-4 относят влияние на сердечно-сосудистую систему. Последнее было предметом многочисленных экспериментальных и клинических исследований, а также метаанализов. В частности, метаанализ 15 исследований (n = 5636) свидетельствовал, что у пациентов с СД 2 типа ингибиторы ДПП-4 по сравнению с плацебо (или отсутствием терапии) способствовали умеренному снижению артериального давления: систолического – в среднем на 3,04 мм рт. ст. (p < 0,00001), диастолического – на 1,47 мм рт. ст. (p < 0,00001) [51]. Снижение артериального давления при приеме ингибиторов ДПП-4 у больных СД 2 типа было сопоставимо с эффектом других антидиабетических средств, включая агонисты рецепторов ГПП-1, пиоглитазон, производные сульфонилмочевины, метформин и ингибиторы α-глюкозидазы. Более выраженное антигипертензивное действие выявлено только у ингибиторов НГЛТ-2: средняя разница с эффектом ингибиторов ДПП-4 по систолическому давлению составила 4,44 мм рт. ст. (p < 0,00001), диастолическому – 2,15 мм рт. ст. (p < 0,00001).
В многоцентровых проспективных открытых рандомизированных клинических исследованиях ситаглиптина SPIKE (n = 282) и алоглиптина SPEAD-A (n = 341) с двухлетним периодом наблюдения обнаружено статистически значимое положительное воздействие ингибиторов ДПП-4 на толщину комплекса «интима – медиа» сонных артерий (суррогатного маркера атеросклероза сосудов) у пациентов с СД 2 типа, получавших инсулин и не имевших явных проявлений сердечно-сосудистых заболеваний [52, 53]. В данных исследованиях терапия ситаглиптином и алоглиптином по сравнению с традиционным лечением способствовала значимому уменьшению средней и максимальной толщины комплекса «интима – медиа» левой (ситаглиптин) или обеих (алоглиптин) общих сонных артерий. Однако в проспективном рандомизированном контролируемом исследовании PROLOGUE (n = 442) 24-месячная терапия ситаглиптином не оказала дополнительного значимого эффекта на динамику толщины комплекса «интима – медиа» у пациентов с СД 2 типа по сравнению с традиционной терапией (диета, физическая нагрузка, неинкретиновая терапия) [54]. Среди возможных причин различий результатов трех исследований с аналогичным дизайном авторы называют исходные характеристики пациентов (тяжесть диабета, уровень HbA1c, изначальная толщина комплекса «интима – медиа») и более высокую частоту приема статинов участниками исследования PROLOGUE.
Антиатеросклеротические свойства ингибиторов ДПП-4 могут быть связаны с противовоспалительной активностью, улучшением эндотелиальной функции, влиянием на метаболизм липидов. В частности, на фоне приема ингибиторов ДПП-4 у больных СД 2 типа отмечалось снижение концентрации маркеров системного вялотекущего воспаления (low grade inflammation), в том числе С-реактивного белка, интерлейкинов 1β, 6 и 18, фактора некроза опухоли α, секреторной фосфолипазы А2, маркера активации макрофагов sCD163. При этом уровень противовоспалительного интерлейкина 10 в плазме крови и циркулирующих моноцитах, напротив, возрастал [55–60]. Эти изменения, по-видимому, обусловлены блокадой ДПП-4 (антигена CD26) лейкоцитов, нарушением медиации провоспалительных сигналов и подавлением экспрессии генов воспаления с последующим изменением концентрации цитокинов [55].
В ряде клинических исследований ингибиторы ДПП-4 продемонстрировали способность уменьшать эндотелиальную дисфункцию у пациентов с СД 2 типа, что проявлялось в улучшении показателя поток-зависимой вазодилатации плечевой артерии [61–63]. Улучшение эндотелиальной функции может быть опосредовано увеличением эндотелиальных прогениторных клеток, регулируемых стромальным фактором 1α, который является одним из субстратов ДПП-4 [64, 65]. Кроме того, на фоне приема ингибиторов ДПП-4 отмечалось уменьшение количества веществ клеточной адгезии – растворимой молекулы межклеточной адгезии 1 и Е-селектина [66]. Тем не менее протективный эффект ингибиторов ДПП-4 в отношении эндотелия сосудов подтвержден не во всех исследованиях [67–69]. Сообщалось также о негативном влиянии препаратов на эндотелиальную функцию [70].
Обобщенные данные клинических исследований свидетельствуют о наличии слабого положительного влияния ингибиторов ДПП-4 на липидный спектр крови у пациентов с СД 2 типа. В метаанализе 17 клинических исследований ингибиторов ДПП-4 установлено снижение общего холестерина относительно исходного уровня на 0,18 ммоль/л (95%-ный доверительный интервал (ДИ) 0,06–0,29; p = 0,002), триглицеридов – на 0,15 ммоль/л (95% ДИ 0,03–0,26; p = 0,013) [71]. В метаанализе 11 клинических исследований ситаглиптина в режиме моно- или комбинированной терапии (n = 2338) у пациентов с СД 2 типа выявлено снижение концентрации триглицеридов плазмы крови на 0,24 ммоль/л (95% ДИ 0,09–0,40; p = 0,002) и повышение уровня холестерина липопротеинов высокой плотности на 0,05 ммоль/л (95% ДИ 0,02–0,07; p < 0,001) по сравнению с контролем (плацебо или другими сахароснижающими средствами – метформином, тиазолидиндионами, инсулином) [72]. Более подробно протективные эффекты ингибиторов ДПП-4 в отношении сердечно-сосудистой патологии обобщены в специальных обзорах [73–75].
Обсуждаются также нефропротективные свойства ингибиторов ДПП-4 у больных СД 2 типа. Они могут быть обусловлены антиоксидантной и противовоспалительной активностью препаратов, улучшением эндотелиальной функции на фоне их приема, натрийуретическим действием [76]. В реализации данных эффектов наряду с ГПП-1 определенную роль могут играть и другие пептиды из числа субстратов ДПП-4, в том числе мозговой натрийуретический пептид, стромальный фактор 1α, нейропептид Y, пептид YY, субстанция P, субъединица β меприна A [77, 78]. На экспериментальных моделях диабета ингибиторы ДПП-4 вызывали уменьшение микроальбуминурии и протеинурии, интенсивности тубулоинтерстициального воспаления, нефросклероза, предупреждали повреждение подоцитов за счет уменьшения экскреции нефрина и апоптоза клеток, способствовали улучшению функции гломерулярного фильтра и повышению скорости клубочковой фильтрации (СКФ) [79–85].
Объединенный анализ результатов четырех рандомизированных двойных слепых плацебоконтролируемых клинических исследований фазы III (n = 217) продемонстрировал положительный эффект линаглиптина на фоне стандартной ренопротективной терапии ингибиторами ренин-ангиотензин-альдостероновой системы на гломерулярную функцию у пациентов с СД 2 типа и альбуминурией (альбумин-креатининовое соотношение 30–3000 мг/г) [86]. За 24 недели терапии разница в снижении альбумин-креатининового соотношения по сравнению с плацебо составляла 28% (95% ДИ -47– -2; p = 0,0357), причем уменьшение альбуминурии не зависело от снижения гликемии и систолического артериального давления. В рамках двухлетнего исследования SAVOR-TIMI 53 (n = 16 492) саксаглиптин также способствовал значимому уменьшению альбумин-креатининового соотношения и/или замедлению прогрессирования альбуминурии у пациентов с СД 2 типа и нормо-, микро- и макроальбуминурией и различной исходной СКФ [87]. Аналогично линаглиптину уменьшение альбуминурии на фоне саксаглиптина не коррелировало с сахароснижающим действием. Положительное влияние на функцию почек у пациентов с СД 2 типа отмечалось также у ситаглиптина [87] и вилдаглиптина [88]. Тем не менее из-за отсутствия доказательств улучшения почечных исходов (снижения риска развития или прогрессирования нефропатии) влияние ингибиторов ДПП-4 на функцию почек в настоящее время расценивается как нейтральное [4, 25].
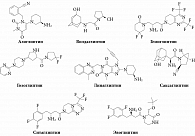
Наряду с общим механизмом действия и классовыми эффектами ингибиторы ДПП-4 существенно различаются по химической структуре (рис. 2), что обусловливает особенности фармакокинетики и фармакодинамики отдельных препаратов. Основные различия между ингибиторами ДПП-4 касаются активности и селективности, биодоступности, периода полувыведения, степени связывания с белками крови, метаболизма, экскреции, ограничений по применению у пациентов с нарушением функции почек и печени, потенциала лекарственных взаимодействий.
Фармакокинетические особенности
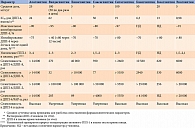
Основные параметры, характеризующие всасывание, распределение, метаболизм и экскрецию ингибиторов ДПП-4, представлены в табл. 1 [13, 22, 26, 31, 89–100].
Всасывание
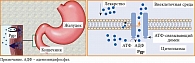
Большинство ингибиторов ДПП-4 обладают высокой биодоступностью при приеме внутрь, при этом она не зависит от приема пищи. Наибольшей биодоступностью характеризуются алоглиптин, гозоглиптин и ситаглиптин. Причина наименьшей биодоступности линаглиптина кроется в особенностях его всасывания в кишечнике. Являясь субстратом гликопротеина P (Pgp), линаглиптин активно выводится из энтероцитов, что снижает его поступление в системный кровоток [101].
Как известно, Pgp представляет собой транспортер, зависимый от аденозинтрифосфата (АТФ) (насос), который находится на цитоплазматической мембране различных клеток и осуществляет выброс липофильных ксенобиотиков во внеклеточное пространство. Pgp обнаружен на мембране эпителия кишечника и проксимальных канальцев почек, клеток печени и эндотелиоцитов гистогематических барьеров, в том числе гематоэнцефалического [102]. Главная задача Pgp заключается в ограничении поступления и ускорении выведения ксенобиотиков, включая лекарства, из организма. Описаны гендерные различия в содержании Pgp. Так, у мужчин экспрессия гена MDR1, кодирующего Pgp, в 2,4 раза выше, чем у женщин [103]. Кроме того, функция Pgp подвержена генетической вариабельности ввиду полиморфизма гена MDR1 [102]. Неодинаковое количество и/или активность Pgp могут быть причинами вариабельной фармакокинетики и эффективности препарата у разных пациентов. Активность Pgp может уменьшаться и увеличиваться под влиянием других препаратов, что требует учета потенциальных лекарственных взаимодействий. Среди препаратов разных фармакотерапевтических групп известно множество ингибиторов Pgp, например амиодарон, аторвастатин, верапамил, дипиридамол, итраконазол, кетоконазол, карведилол, кларитромицин, никардипин, спиронолактон, сертралин, флуоксетин [104]. К индукторам Pgp относятся, в частности, рифампицин, дексаметазон, морфин. Соответственно ингибиторы Pgp могут увеличить всасывание или замедлить экскрецию препарата – субстрата Pgp, что усилит его эффект. Индукторы Pgp способны привести к противоположному результату. Примечательно, что многие препараты являются одновременно субстратами Pgp и изоформы CYP3A4 цитохрома Р450. Следует обратить внимание на предупреждение в инструкции по медицинскому применению линаглиптина о том, что ритонавир как потенциальный ингибитор Pgp и CYP3A4 может вдвое увеличить площадь под кривой «концентрация – время» (AUC). Рифампицин как потенциальный индуктор Pgp и CYP3A4 способен снизить значение AUC линаглиптина в период равновесного состояния фармакокинетики [98].
Функционирование Pgp представлено на рис. 3 [105].
Максимальная концентрация препарата в плазме крови (Cmax) и время ее достижения (Tmax) не имеют определяющего значения при выборе и применении ингибитора ДПП-4. Во-первых, более значимым в терапии хронического заболевания является поддержание эффекта в течение суток, а не скорость достижения максимального эффекта. Во-вторых, контроль гликемии ингибиторами ДПП-4 опосредован инкретиновым эффектом ГПП-1 и «привязан» к постпрандиальным периодам на протяжении дня, а не ко времени приема препарата. Наконец, Tmax у большинства препаратов находится в среднем диапазоне полтора – два часа и существенно не различается, а Cmax зависит от принимаемой дозы препарата.
Распределение
Ингибиторы ДПП-4 имеют низкую или среднюю степень связывания с белками плазмы крови, варьирующуюся от 9% у вилдаглиптина до 70% у линаглиптина [31, 89, 90]. Таким образом, для ингибиторов ДПП-4 практически исключается лекарственное взаимодействие, обусловленное конкуренцией за переносчика, при одновременном приеме с препаратами, которые интенсивно (более чем на 90%) связываются с белками плазмы, например многими нестероидными противовоспалительными препаратами, амитриптилином, бензодиазепинами, верапамилом, фуросемидом. Объем распределения (Vd) от 70 до 1000 л у наиболее исследованных ингибиторов ДПП-4 свидетельствует о хорошем их проникновении в ткани [31, 89, 90].
Метаболизм
Алоглиптин, линаглиптин, ситаглиптин практически не метаболизируются в организме и выводятся преимущественно в неизмененном виде [26, 31]. В ходе метаболизма алоглиптина образуется около 1% малоактивного метаболита, вклад которого в общий эффект препарата, по-видимому, клинически незначим [31]. Около половины гемиглиптина подвергается метаболизму в печени, в основном с участием CYP3A4 [90, 91]. В результате метаболизма образуется активный метаболит, доля которого составляет 10% общего количества вещества, однако его активность в два раза превышает активность исходной молекулы [91]. Остальные ингибиторы ДПП-4 подвергаются более интенсивному метаболизму в печени, характер которого имеет качественные различия у разных препаратов. Так, вилдаглиптин метаболизируется с помощью CYP-независимого гидролиза, поэтому, несмотря на свою интенсивность, он не зависит от влияния модуляторов системы цитохрома или уридин-5-дифосфат глюкуронилтрансферазы, что минимизирует риск лекарственных взаимодействий на данном этапе [26]. Для саксаглиптина характерен интенсивный печеночный CYP3A4-зависимый метаболизм, в ходе которого образуется активный метаболит, однако его активность в два раза меньше активности исходного вещества [26, 31]. При одновременном приеме с сильными ингибиторами CYP3A4 (итраконазолом, кетоконазолом, кларитромицином, ингибиторами ВИЧ-протеазы) дозу саксаглиптина необходимо снизить до 2,5 мг/сут во избежание риска развития нежелательных эффектов [26, 99]. Эвоглиптин и гозоглиптин метаболизируются в печени при участии CYP3A4 с образованием неактивных метаболитов [89, 94, 95, 106].
Экскреция
Ингибиторы ДПП-4 существенно различаются по периоду полувыведения (Т1/2). Данный показатель важен для поддержания эффекта на протяжении суток. Алоглиптин, гемиглиптин, гозоглиптин, линаглиптин, ситаглиптин и эвоглиптин имеют достаточный Т1/2, что позволяет принимать препарат один раз в день. Существенно меньший Т1/2 у саксаглиптина и вилдаглиптина. Однако в отличие от препаратов, обладающих длительным Т1/2, но образующих нековалентную связь с ДПП-4, цианопирролидиновые производные вилдаглиптин и саксаглиптин связываются с ДПП-4 прочной ковалентной связью, что обеспечивает продолжительное ингибирование фермента, выходящее за ожидаемый интервал времени [107, 108]. Высвобождение этих двух препаратов происходит путем медленного гидролиза ковалентной связи. На практике это означает, что, несмотря на небольшой Т1/2 (менее пяти часов), саксаглиптин можно принимать один раз в сутки [26, 99]. В то же время для поддержания стационарной плазменной концентрации и стабильного эффекта вилдаглиптин необходимо принимать два раза в день [26, 97]. В рандомизированном плацебоконтролируемом открытом исследовании с перекрестным дизайном у пациентов с СД 2 типа показано, что при применении вилдаглиптина в дозе 50 мг/сут (в частности, согласно рекомендуемой схеме в составе двойной комбинированной терапии с производными сульфонилмочевины [97]), а также саксаглиптина в дозе 5 мг/сут (рекомендованная средняя суточная доза) в течение пяти дней степень ингибирования ДПП-4 через 24 часа после приема последней дозы была значимо ниже, чем при аналогичной схеме приема ситаглиптина в дозе 100 мг/сут [108].
Экскреция ингибиторов ДПП-4 осуществляется почками и печенью. Вклад почечного и печеночного путей элиминации для разных препаратов неодинаков. Все рассматриваемые ингибиторы ДПП-4, за исключением линаглиптина и эвоглиптина, выводятся преимущественно почками посредством фильтрации и канальцевой секреции [22, 109, 110]. Следует отметить, что в этом случае почки являются основным путем элиминации, в том числе для активных метаболитов и неизмененной части препаратов [26]. Линаглиптин практически полностью экскретируется с желчью и выводится с калом, поскольку почечному пути элиминации препятствует связь с белками крови [111]. Эвоглиптин выводится почками и печенью в равном соотношении [89].
Применение у особых категорий пациентов
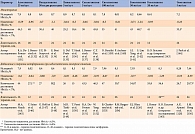
Особенности метаболизма и экскреции ингибиторов ДПП-4 определяют тактику назначения препаратов пациентам с нарушенной функцией почек и печени. Ингибиторы ДПП-4 можно назначать при нарушенной функции почек. Однако для всех препаратов, за исключением линаглиптина (преимущественно печеночный путь элиминации), гемиглиптина (63% выводится почками) и эвоглиптина (с гепаторенальной элиминацией), требуется редукция дозы на 50% в случае средней и тяжелой степени нарушения функции почек (табл. 2) [93–100]. Более строгие ограничения касаются ингибиторов ДПП-4, для которых почечный путь элиминации является основным и большая часть препарата экскретируется в неизмененном виде, – алоглиптина, гозоглиптина и ситаглиптина. Пациентам с тяжелым нарушением функции почек, включая лиц с хронической почечной недостаточностью, находящихся на гемодиализе, применение алоглиптина и гозоглиптина противопоказано, тогда как ситаглиптин может использоваться в одной четвертой суточной дозы.
Следует подчеркнуть, что рекомендации по снижению дозы ингибиторов ДПП-4 у пациентов с нарушенной функцией почек связаны не с вопросами безопасности, а с изменением фармакокинетики – при сниженном почечном клиренсе требуется меньшая доза препарата для достижения терапевтической концентрации в крови [26]. Маловероятно, что накопление препарата в крови приведет к появлению или усилению нежелательных явлений. Во-первых, ингибиторы ДПП-4 отличаются широтой терапевтического воздействия. Во-вторых, механизм их сахароснижающего эффекта не прямой, а опосредованный ГПП-1. И по-видимому, невозможно добиться сверхмаксимального ингибирования ДПП-4 и существенного прироста активного ГПП-1 при увеличении дозы препарата. В-третьих, многочисленные клинические исследования свидетельствуют о переносимости ингибиторов ДПП-4, сопоставимой с переносимостью плацебо, у пациентов с нарушенной функцией почек, в том числе находящихся на гемодиализе [112, 113].
Согласно инструкциям по медицинскому применению ингибиторов ДПП-4, имеющих преимущественно почечный путь элиминации, при их назначении рекомендуется осуществлять оценку функции почек до начала и в процессе лечения. В то же время регулярный контроль функции почек входит в число диагностических процедур при диспансерном наблюдении за пациентами с СД 2 типа [4]. Поэтому указание в инструкции об отсутствии необходимости контроля функции почек должно восприниматься критически.
Ввиду благоприятного профиля безопасности (минимального риска развития гипогликемии, отсутствия нефро-, гепато- и кардиотоксичности), низкого риска лекарственных взаимодействий, переносимости, сопоставимой с плацебо, сохранения эффекта независимо от возраста ингибиторы ДПП-4 признаны препаратами выбора для лечения СД 2 типа у пожилых [4]. При этом как таковых возрастных ограничений, требующих коррекции дозы препаратов, не существует. Тем не менее у лиц старше 65 лет рекомендуется более аккуратный подбор дозы ингибитора ДПП-4 в связи с возрастным снижением функции почек [93–100].
Большинство ингибиторов ДПП-4, за исключением алоглиптина, вилдаглиптина и гозоглиптина, могут применяться при нарушении функции печени разной степени тяжести без дополнительных ограничений и контрольных исследований. Это касается и линаглиптина, экскретируемого преимущественно печенью. Показано, что у пациентов с тяжелым нарушением функции печени однократный или повторный прием линаглиптина не сопровождался увеличением общего количества препарата в крови (AUC) [114]. Предполагается, что нарушение метаболической функции печени не имеет значения для фармакокинетики линаглиптина, который на 90% выводится в неизмененном виде (при условии сохранности билиарного пути экскреции). Очевидно, у больных с тяжелой степенью нарушения функции печени не следует ожидать значимого изменения фармакокинетики ситаглиптина, так же как других ингибиторов ДПП-4 со значительной первичной почечной экскрецией, хотя о применении препарата у данной категории больных не сообщалось [100].
Для применения саксаглиптина, подвергающегося интенсивному печеночному метаболизму, также отсутствуют дополнительные ограничения, связанные с патологией печени, поскольку даже при тяжелой печеночной недостаточности увеличение количества препарата в плазме крови расценивалось в исследованиях как клинически незначимое [115]. В этом случае, вероятно, возрастает нагрузка на почечный путь элиминации саксаглиптина. До настоящего времени вилдаглиптин запрещен к применению у пациентов с любым нарушением функции печени, в том числе с уровнями трансаминаз печени, в три раза и более превышающими верхнюю границу нормы [97]. Запрет связан с отдельными сообщениями об увеличении активности печеночных ферментов на фоне приема вилдаглиптина. Вместе с тем проведенный метаанализ 38 исследований не выявил увеличения риска гепатотоксичности, в том числе возрастания активности трансаминаз, при применении вилдаглиптина в средней суточной дозе 50 мг два раза в день в течение 12–104 недель по сравнению с контролем [116]. Алоглиптин и гозоглиптин противопоказаны при тяжелом нарушении функции печени [94, 97].
Лекарственные взаимодействия
В целом для класса ингибиторов ДПП-4 лекарственные взаимодействия нечасты, поэтому необходимость коррекции дозы возникает редко.
Как было отмечено ранее, фармакокинетические лекарственные взаимодействия могут быть связаны с модуляцией системы цитохрома P450 и гликопротеина P. Сами ингибиторы ДПП-4 либо не влияют на активность цитохрома и Pgp, либо являются их слабыми ингибиторами [31, 93–100]. Таким образом, ингибиторы ДПП-4 не оказывают клинически значимого воздействия на одновременно применяемые препараты, относящиеся к субстратам метаболических и транспортных систем организма. Однако фармакокинетика гемиглиптина, линаглиптина, саксаглиптина и эвоглиптина может изменяться под влиянием сильных модуляторов CYP3A4. В случае линаглиптина – при совместном приеме с модуляторами Pgp (см. табл. 2).
Тактика минимизации риска лекарственных взаимодействий для данных препаратов включает различные меры – от мониторинга состояния пациента до изменения дозы или отказа от применения сильного модулятора цитохрома P450.
Фармакодинамические особенности
Параметры, характеризующие активность (силу действия) и селективность ингибиторов ДПП-4, представлены в табл. 3 [13, 22, 26, 31, 89–91, 106, 109, 110].
Активность
Ингибирующая активность препаратов in vitro оценивается по величине константы ингибирования (Ki) или концентрации полумаксимального ингибирования (IC50). Применительно к ингибиторам ДПП-4 величина IC50 показывает, сколько препарата необходимо для уменьшения активности ферментативного процесса, управляемого ДПП-4, на 50% [31, 109]. Чем меньше IC50, то есть чем меньше требуется препарата для снижения активности ДПП-4, тем он активнее.
Современные ингибиторы ДПП-4 представляют собой высокоактивные препараты с IC50 в диапазоне от ~1 нмоль/л у линаглиптина и эвоглиптина до 50–62 нмоль/л у саксаглиптина и вилдаглиптина [13, 22, 26, 31, 89, 90, 106, 109, 110]. Таким образом, менее активными являются саксаглиптин и вилдаглиптин.
С клинической точки зрения критерием активности является максимальная степень ингибирования ДПП-4 и еще более важный параметр – процент ингибирования ДПП-4 через 24 часа после приема препарата (на минимуме концентрации препарата в крови). Ингибирование ДПП-4 на 90% и выше достигается примерно через 15 минут после приема алоглиптина, эвоглиптина, вилдаглиптина и ситаглиптина (наибольшая величина – 97%) [22, 89, 90, 106, 117]. Через 24 часа наиболее стойкий эффект (ингибирование более 80% плазменной ДПП-4) демонстрируют ситаглиптин, гозоглиптин, эвоглиптин, а также вилдаглиптин с учетом приема полной суточной дозы с интервалом 12 часов [22, 89, 90, 106, 117]. Показано, что для поддержания концентрации ГПП-1 и ГИП, достаточной для достижения клинически значимого гликемического эффекта, необходимо ингибирование как минимум 80% активности ДПП-4 в течение суток [118].
Активность ингибиторов ДПП-4 также можно оценить по постпрандиальному приросту концентрации активного ГПП-1 в плазме крови. У здоровых добровольцев при приеме ингибиторов ДПП-4 она возрастала в полтора – четыре раза. Наиболее выраженный прирост отмечался на фоне алоглиптина [31].
Селективность
Избирательность действия ингибитора ДПП-4 – важный параметр, влияющий на безопасность препарата. Как было упомянуто выше, ДПП-4 принадлежит к семейству гомологичных дипептидаз, включающему также ДПП-8, 9 и 2, FAP-α. Степень аминокислотной идентичности ДПП-4 с родственными ферментами варьируется от 26 (с ДПП-8) до 52% (с FAP-α) [119]. Однако субстратная специфичность и, следовательно, функция ферментов различна и в отношении прочих дипептидаз до конца не раскрыта. Некоторые прототипы ингибиторов ДПП-4 в доклинических исследованиях продемонстрировали значительную токсичность, которая, как предполагается, могла быть связана с ингибированием ДПП-8 и/или ДПП-9. В частности, селективное ингибирование ДПП-8 и ДПП-9 ассоциировалось с повышением смертности, развитием ретикулоцитопении, увеличением селезенки и поражением желудочно-кишечного тракта у животных [109]. Избирательные ингибиторы ДПП-2 также вызывали ретикулоцитопению. Несмотря на дискутабельный характер связи патологических изменений с ингибированием гомологичных дипептидилпептидаз [120], высокая селективность препарата в отношении ДПП-4 рассматривается с точки зрения минимизации риска побочных эффектов [15, 121].
Селективность действия ингибитора ДПП-4 оценивается по соотношению IC50 для гомологичных дипептидаз (ДПП-8, 9 и 2, FAP-α) и IC50 для ДПП-4 [109]. Чем выше величина этого соотношения, тем более селективным в отношении ДПП-4 является препарат. Аналогичным образом для оценки селективности действия препаратов можно использовать величину Ki. За некую суррогатную границу селективности принята 100-кратная разница [109]. На этом основании выделяют высокоселективные ингибиторы ДПП-4 (препараты второго поколения по определению T.W. Geldern и J.M. Trevillyan), которые ингибируют ДПП-4 как минимум в 100 раз избирательнее, чем ДПП-2, 8, 9 и FAP-α [15, 90, 117, 122]. К высокоселективным относятся алоглиптин, ситаглиптин, гемиглиптин, гозоглиптин и эвоглиптин [15, 90, 117]. Если селективность в отношении ДПП-4 и одной из гомологичных дипептидаз менее 100, препарат считают умеренно селективным (препарат первого поколения). Соответственно к умеренно селективным относятся вилдаглиптин, линаглиптин и саксаглиптин [90, 117].
Несмотря на существенные различия в селективности ингибиторов ДПП-4 in vitro, до настоящего времени не получено данных о возникновении у пациентов нежелательных эффектов, связанных с неселективным ингибированием дипептидаз [26].
Лекарственные взаимодействия
При применении ингибиторов ДПП-4 в составе комбинированной сахароснижающей терапии возможно развитие гипогликемических состояний. С целью уменьшения риска развития гипогликемии при одновременном применении с ингибиторами ДПП-4 производных сульфонилмочевины и инсулина рекомендуется снижение дозы последних.
Как отмечалось ранее, комбинация ингибиторов ДПП-4 с ингибиторами АПФ может увеличить риск ангионевротического отека вследствие накопления брадикинина и субстанции Р [39].
Известно также о редком лекарственном взаимодействии линаглиптина с метформином или производными сульфонилмочевины, проявляющемся в виде кашля (2,4% линаглиптин против 1,1% плацебо) [123]. Кашель может быть обусловлен накоплением кининов, однако требуется дополнительное изучение данного эффекта, поскольку о нем не сообщалось при применении других ингибиторов ДПП-4. Кроме того, необходимо уточнение роли метформина и производных сульфонилмочевины в его возникновении.
Гликемический профиль
Метаанализ 83 рандомизированных контролируемых исследований, в котором сравнивалась эффективность алоглиптина, вилдаглиптина, линаглиптина, саксаглиптина и ситаглиптина в режиме монотерапии и в комбинации с другими пероральными сахароснижающими препаратами и инсулином, не выявил значимой разницы между ингибиторами ДПП-4 в отношении динамики HbA1c, массы тела, доли пациентов, достигших HbA1c менее 7%, а также частоты гипогликемических событий [124]. Сетевой метаанализ восьми рандомизированных контролируемых исследований также свидетельствовал об одинаковом гликемическом эффекте алоглиптина, вилдаглиптина, линаглиптина, саксаглиптина и ситаглиптина в составе тройной комбинированной терапии с метформином и производными сульфонилмочевины [125].
Проведено несколько прямых сравнительных исследований ингибиторов ДПП-4 с репрезентативной выборкой и достаточной для оценки гликемического эффекта продолжительностью терапии. Эти исследования планировались с целью доказать не меньшую эффективность препаратов по сравнению с ситаглиптином, то есть заранее устанавливалось критическое значение верхней границы 95% ДИ для разницы средних концентраций HbA1c между группами. Так, в двойном слепом рандомизированном контролируемом исследовании (n = 425) 24-недельный прием гемиглиптина в дозе 50 мг/сут или ситаглиптина в дозе 100 мг/сут в дополнение к метформину способствовал снижению HbA1c в параллельных группах на 0,77 и 0,80% соответственно [126]. Доля достигших HbA1c менее 7% составила 54 и 49% соответственно.
В аналогичном по дизайну 18-недельном исследовании (n = 801) применение саксаглиптина в дозе 5 мг/сут или ситаглиптина в дозе 100 мг/сут, добавленных к метформину, привело к снижению HbA1c в среднем на 0,52 и 0,62% [127]. У 26 и 29% пациентов по окончании исследования уровень HbA1c не превышал 6,5%. При этом ситаглиптин эффективнее саксаглиптина контролировал уровень гликемии натощак. Концентрация глюкозы снизилась на 0,90 и 0,60 ммоль/л (средняя разница 0,30 ммоль/л, 95% ДИ 0,08–0,53).
В двойном слепом рандомизированном исследовании (n = 184) подтверждена не меньшая эффективность эвоглиптина по сравнению с эффективностью ситаглиптина. У пациентов с недостаточным эффектом на фоне метформина добавление ингибиторов ДПП-4 способствовало уменьшению уровня HbA1c через 24 недели на 0,55 и 0,48% соответственно [128].
Сопоставимый гликемический эффект отмечался у вилдаглиптина и ситаглиптина в рандомизированном двойном слепом 24-недельном исследовании у пациентов с СД 2 типа и тяжелым нарушением функции почек (n = 148) [129].
В отечественном исследовании 12-недельная монотерапия гозоглиптином в дозе 20–30 мг/сут или вилдаглиптином в дозе 50–100 мг/сут привела к снижению HbA1c на 0,93 и 1,03% соответственно. Целевого уровня НbА1с ≤ 7% достигли 41,0 и 44,5% пациентов (р = 0,53) [130].
Гликемический эффект конкретных ингибиторов ДПП-4, применяемых в режиме монотерапии и в дополнение к оптимальным дозам метформина, на основании результатов двойных слепых рандомизированных контролируемых исследований продолжительностью 24–26 недель или иной продолжительности в отсутствие альтернативы представлен в табл. 4 [126, 128, 131–156].
Принцип индивидуального подхода к терапии СД 2 типа предполагает назначение стартовой двойной терапии, если исходный НbА1с превышает целевой уровень на 1,0–2,5% [4]. В таблице 5 приведены результаты рандомизированных контролируемых исследований стартовой комбинированной терапии ингибиторами ДПП-4 и метформином [134, 136, 142, 157–159]. Средний исходный уровень НbА1с в рамках данных исследований был относительно более высоким, чем в исследованиях со стартовой монотерапией метформином и добавлением ингибиторов ДПП-4 в последующем.
Необходимо подчеркнуть, что на величину гликемического эффекта помимо свойств препарата существенно влияют особенности пациента (анамнез СД, степень приверженности рекомендациям по модификации образа жизни, исходный уровень НbА1с и др.). В частности, метаанализ 59 рандомизированных исследований десяти групп сахароснижающих препаратов, включая инсулин, показал, что наиболее выраженный эффект достигался у пациентов с исходно более высокой гипергликемией (уровнем HbA1c), независимо от класса препарата [160]. Эта тенденция прослеживается при анализе результатов, представленных в табл. 4 и 5.
Что касается зависимости гликемического эффекта от фармакологических характеристик ингибиторов ДПП-4, то наиболее тесная связь амплитуды снижения НbА1с обнаружена со средним процентом ингибирования ДПП-4 в течение интервала дозирования [161]. Имеет также значение положительная корреляция с долей времени в течение 24 часов, когда сохранялось ингибирование более 80% ДПП-4, и процент ингибирования ДПП-4 на фоне минимальной концентрации препарата в крови (или в конце интервала дозирования) [161]. Данный факт объясняет сопоставимую эффективность ранних ингибиторов ДПП-4, обладающих оптимальными фармакодинамическими параметрами (ситаглиптина, вилдаглиптина и алоглиптина), с более поздними. Вместе с тем обращает внимание несопоставимо меньший объем качественных клинических исследований новых ингибиторов ДПП-4, что требует определенной сдержанности в интерпретации доступных результатов.
В одном из ранних метаанализов, обобщившем результаты долгосрочных рандомизированных клинических исследований, показано снижение гликемической эффективности ингибиторов ДПП-4 на втором году терапии [162]. В этот период наблюдалось увеличение уровня HbA1c. Однако в более позднем метаанализе было установлено, что прием ингибиторов ДПП-4 по сравнению с использованием производных сульфонилмочевины ассоциировался со значимо меньшим увеличением уровня HbA1c с 24–28-й по 104-ю недели терапии (средняя разница -0,16% (95% ДИ -0,21– -0,11; p < 0,001)) и с 52-й по 104-ю недели (средняя разница -0,06% (95% ДИ -0,10– -0,02; p = 0,001)) [163]. Это свидетельствует о несколько более стойком характере сахароснижающего эффекта глиптинов по сравнению с производными сульфонилмочевины при длительном (более двух лет) лечении.
Результаты долгосрочных сравнительных исследований эффективности ингибиторов ДПП-4 и производных сульфонилмочевины при интенсификации монотерапии метформином представлены в табл. 6 [164–168]. Анализируя данные, можно выделить ингибиторы ДПП-4 с менее выраженным гликемическим эффектом, чем у производных сульфонилмочевины (линаглиптин), и схожим, однако более стойким (алоглиптин и ситаглиптин). При этом ситаглиптин по сравнению с алоглиптином способствовал более выраженному снижению массы тела. Гипогликемические эпизоды при приеме ингибиторов ДПП-4 были редки. Их относительная частота была сопоставима с таковой на фоне применения препарата сульфонилмочевины.
Стабильный гликемический эффект ситаглиптина подтвержден в ретроспективном исследовании стартовой комбинированной терапии с метформином [169]. Согласно полученным результатам, через год ответ на лечение (в виде поддержания целевого уровня HbA1c ≤ 7% или снижения HbA1c на 0,8% и более) сохранялся у 72,2% пациентов. Через четыре года терапии у 35,4% больных уровень HbA1с не превышал 7,0 ± 0,9%. Это позволило сделать вывод о сохранении эффекта ситаглиптина при длительном (более четырех лет) применении. Наиболее значимым независимым предиктором стойкости эффекта признан высокий исходный уровень HbA1с. При всех различиях и ограничениях, связанных с дизайном исследования, четырехлетний гликемический эффект ситаглиптина при ретроспективном анализе оказался сопоставим с двухлетней эффективностью других ингибиторов ДПП-4 в проспективных исследованиях (см. табл. 6).
Части пациентов со значительной гипергликемией в дебюте заболевания (HbA1с более чем на 2,5% превышает индивидуальное целевое значение [4]), а также пациентам с недостаточным контролем гликемии на фоне комбинированной терапии с метформином [4, 25] возможно назначение комбинации из трех сахароснижающих средств.
Сетевой метаанализ восьми рандомизированных контролируемых исследований (n = 3261), в котором сравнивалась эффективность 24–26-недельной терапии с добавлением одного из ингибиторов ДПП-4 (алоглиптина в дозе 25 мг/сут, вилдаглиптина в дозе 100 мг/сут, линаглиптина в дозе 5 мг/сут, саксаглиптина в дозе 5 мг/сут или ситаглиптина в дозе 100 мг/сут) к комбинации метформина с препаратом сульфонилмочевины, не выявил статистически значимых различий в снижении НbА1с [125]. В самостоятельных исследованиях у пациентов, получавших комбинацию метформина с производным сульфонилмочевины, ингибиторы ДПП-4 способствовали дополнительному снижению НbА1с на 0,62% (алоглиптин, линаглиптин), 0,66% (саксаглиптин), 0,76% (вилдаглиптин) и 0,89% (ситаглиптин) [125].
В последние годы особое внимание уделяется изучению комбинаций ингибиторов ДПП-4 с ингибиторами НГЛТ-2 в качестве стартовой терапии [170–172] или для интенсификации терапии метформином [173–181].
Метаанализ семи рандомизированных контролируемых исследований (n = 2082) с минимальной продолжительностью 12 недель показал, что двойная комбинированная терапия ингибитором НГЛТ-2 и ингибитором ДПП-4 по сравнению с монотерапией ингибитором ДПП-4 способствовала большему снижению HbA1c (средняя взвешенная разница составила 0,6% (95% ДИ 0,5– 0,7)), глюкозы натощак и постпрандиальной гликемии, а также массы тела [182]. При этом не отмечалось повышения риска гипогликемических событий, как и инфекций мочевых путей, но не генитальных инфекций – характерных побочных эффектов ингибиторов НГЛТ-2.
Важные выводы относительно частоты урогенитальных инфекций на фоне двойной терапии ингибиторами ДПП-4 и НГЛТ-2 сделаны в метаанализе пяти рандомизированных контролируемых исследований [183]. Оказалось, что по сравнению с монотерапией ингибиторами НГЛТ-2 комбинированная терапия ингибиторами ДПП-4 и НГЛТ-2 сопровождалась снижением частоты генитальных инфекций. Так, относительный риск составил 0,51 (95% ДИ 0,28–0,92). Кроме того, при анализе базы данных системы фармаконадзора США, Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration – FDA) установлена значимо меньшая частота сообщений о возникновении урогенитальных инфекций, связанных с возможным приемом комбинации ингибиторов ДПП-4 и НГЛТ-2, чем с использованием только ингибиторов НГЛТ-2. Разница составила 26%. Пропорциональный риск 0,74 (95% ДИ 0,61–0,90). Авторы сделали вывод о способности ингибиторов ДПП-4 снижать частоту урогенитальных инфекций, ассоциированных с терапией ингибиторами НГЛТ-2.
Еще один метаанализ был проведен для оценки эффективности двойной ингибиторной терапии [184]. Он включал 14 рандомизированных контролируемых исследований (n = 4828) продолжительностью 24–52 недели. Показано, что добавление ингибитора НГЛТ-2 к ингибитору ДПП-4, в том числе в комбинации с метформином, способствовало снижению HbA1c в среднем на 0,71%, глюкозы натощак – на 25,62 мг/дл (1,4 ммоль/л), постпрандиальной гликемии – на 44 мг/дл (2,4 ммоль/л), массы тела – на 2,05 кг, систолического артериального давления – на 5,90 мм рт. ст. При этом ингибиторы НГЛТ-2 повышали концентрацию общего холестерина плазмы крови на 3,24%, в основном за счет увеличения уровня липопротеинов высокой плотности на 6,15%. Уровень липопротеинов низкой плотности повысился на 2,55%. Добавление ингибитора ДПП-4 к ингибитору НГЛТ-2 (в том числе в комбинации с метформином) ассоциировалось с меньшим гликемическим эффектом. Так, уровень HbA1c снизился на 0,31%, глюкозы натощак – на 8,94 мг/дл (0,5 ммоль/л). Однако такая терапия привела к снижению концентрации общего холестерина на 1,48%, триглицеридов – на 3,25%. Кроме того, комбинация с ингибитором ДПП-4 позволила уменьшить дозу ингибитора НГЛТ-2, поскольку способствует достижению одинаковой или даже большей эффективности последних в меньших дозах. К сожалению, в данном метаанализе не подтвердилась способность ингибиторов ДПП-4 снижать частоту генитальных инфекций, связанных с приемом ингибиторов НГЛТ-2. По сравнению с терапией ингибиторами ДПП-4 комбинированная терапия ингибиторами НГЛТ-2 и ДПП-4 повышала риск генитальных инфекций более чем в пять раз. Относительный риск составил 5,31 (95% ДИ 1,39–20,32). Тем не менее комбинированная терапия двумя ингибиторами была связана с меньшим риском хронических генитальных инфекций по сравнению с терапией только ингибиторами НГЛТ-2. Относительный риск – 0,61 (95% ДИ 0,39–0,96).
Отдельные аспекты безопасности
Одним из важных преимуществ ингибиторов ДПП-4 является благоприятный профиль переносимости и безопасности. В большинстве случаев побочные эффекты в рамках исследований фазы III носили легкий характер и не требовали отмены препаратов [29, 185]. Долгосрочные клинические исследования, в том числе в отношении сердечно-сосудистой безопасности, а также более чем десятилетнее использование в клинической практике и, соответственно, пострегистрационный фармаконадзор не выявили серьезных отклонений в профиле безопасности и непредвиденных рисков применения ингибиторов ДПП-4 [29, 164–168, 186–189]. Особенно важно, что благоприятный профиль безопасности ингибиторов ДПП-4 распространяется на пожилых лиц и пациентов с нарушением функции почек [26, 185].
Гипогликемические эпизоды
Из анализа 63 систематических обзоров следует, что частота гипогликемий при приеме ингибиторов ДПП-4 сопоставима с таковой при использовании плацебо и агонистов рецепторов ГПП-1 и значительно ниже, чем при лечении производными сульфонилмочевины [190]. В метаанализе 16 исследований (n = 15 176 пациентов) частота гипогликемических событий при приеме ингибиторов ДПП-4 и препаратов сульфонилмочевины на протяжении 12, 52 и 104 недель составила 6, 3, 4 и 20, 24, 27% соответственно [191].
Панкреатическая безопасность
Дискуссия о безопасности инкретиновой терапии в отношении поджелудочной железы [192, 193] побудила экспертов Европейского медицинского агентства и Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США к всесторонней оценке доклинических и клинических данных. В результате этой оценки не было выявлено причинно-следственной связи между инкретиновой терапией и поражением поджелудочной железы [194, 195].
Данные о наличии связи между приемом ингибиторов ДПП-4 и увеличением риска развития острого панкреатита противоречивы. Они не подтвердились в объединенном анализе результатов исследований фазы III и исследований безопасности. Отношение шансов составило 1,07 (95% ДИ 0,72–1,58) [196]. В метаанализе 60 исследований, 55 из которых были рандомизированными (n = 33 350), отношение шансов также составило 1,11 (95% ДИ 0,57–2,17) [197]. Однако выполненный в 2019 г. метаанализ рандомизированных контролируемых исследований продолжительностью 24 недели и более (n = 59 404) выявил статистически значимую связь между использованием ингибиторов ДПП-4 и риском развития острого панкреатита. Отношение шансов составило 1,72 (95% ДИ 1,18–2,53), величина индекса потенциального вреда (Number Needed to Harm – NNH) – 1066 пациентов [198]. Наконец, метаанализ 2020 г., включавший 164 рандомизированных контролируемых исследования, в том числе новых ингибиторов ДПП-4 (гемиглиптина, эвоглиптина, анаглиптина, омариглиптина, тенеглиптина и трелаглиптина), продолжительностью 24 недели и более (n = 130 255), не выявил связи между приемом препаратов и повышением риска острого панкреатита. Отношение шансов – 1,13 (95% ДИ 0,86–1,47) [199].
Необходимо учитывать, что риск возникновения острого панкреатита у пациентов с СД 2 типа в отсутствие каких-либо внешних факторов повышен приблизительно в два раза [200]. Информация о риске острого панкреатита, его симптомах и мерах предосторожности, а также предупреждение для лиц с острым панкреатитом в анамнезе включаются в инструкции по медицинскому применению ингибиторов ДПП-4. При возникновении острого панкреатита на фоне терапии ингибиторами ДПП-4 ее прекращают и далее не возобновляют.
Повышенный риск развития рака поджелудочной железы при приеме ингибиторов ДПП-4 в вышеупомянутых метаанализах 2019 и 2020 гг. не подтвердился, Отношение шансов составило 0,65 (95% ДИ 0,35–1,21) [198] и 0,86 (95% ДИ 0,60–1,24) [199].
Сердечно-сосудистая безопасность
Крупномасштабные исследования сердечно-сосудистой безопасности ингибиторов ДПП-4 CARMELINA, CAROLINA, EXAMINE, SAVOR-TIMI, TECOS не выявили негативного влияния линаглиптина, алоглиптина, саксаглиптина и ситаглиптина на частоту атеросклеротических сердечно-сосудистых событий, а также на течение хронической сердечной недостаточности (за исключением саксаглиптина) [186–189]. Данные исследования проводились с учетом требований FDA к пред- или пострегистрационной оценке сердечно-сосудистых исходов новых препаратов для лечения СД 2 типа (рекомендации 2008 г. в настоящее время пересматриваются [201]). Эти требования касаются продолжительности исследования (минимум два года), включения пациентов высокого риска (пожилых, с прогрессирующими сердечно-сосудистыми заболеваниями, сниженной функцией почек) и оценки композитной конечной точки (как минимум трех больших сердечно-сосудистых событий – сердечно-сосудистой смерти, нефатального инфаркта миокарда или инсульта) и др. Все четыре вышеуказанных ингибитора ДПП-4 не увеличивали частоту наступления композитной конечной точки по сравнению с плацебо или активным контролем. Прием саксаглиптина в отличие от трех других ингибиторов ДПП-4 ассоциировался с небольшим, но статистически значимым увеличением частоты госпитализаций по поводу хронической сердечной недостаточности при сравнении с плацебо. Абсолютная частота госпитализаций составила 3,5 и 2,8% соответственно, отношение рисков – 1,27% (95% ДИ 1,07–1,51) [186].
Вилдаглиптин, как и новые ингибиторы ДПП-4, не зарегистрированные в США (в том числе гемиглиптин, гозоглиптин и эвоглиптин), не проходил подобных испытаний. Однако сердечно-сосудистая безопасность вилдаглиптина подтверждена в двух метаанализах [202, 203]. В частности, установлено отсутствие увеличения частоты больших сердечно-сосудистых событий и риска развития или прогрессирования хронической сердечной недостаточности (включались исследования с участием пациентов группы высокого риска, имевших застойную сердечную недостаточность, нарушение функции почек средней или тяжелой степени).
Заключение
Ингибиторы ДПП-4 – современный класс сахароснижающих препаратов второй линии терапии СД 2 типа при недостаточной эффективности или непереносимости метформина, в особенности у пациентов, склонных к гипогликемии (пожилых, с нарушением функции почек) или набору веса и отдающих предпочтение пероральной терапии. Внедрению ингибиторов ДПП-4 в клиническую практику предшествовало изучение физиологии инкретиновых гормонов и глюкозозависимого характера их действия.
Как класс ингибиторы ДПП-4 характеризуются умеренным гликемическим эффектом и благоприятным профилем безопасности, отсутствием воздействия на массу тела, нейтральным влиянием на сердечно-сосудистые и почечные исходы, низким риском гипогликемии, возможностью комбинации с другими сахароснижающими препаратами, в том числе инсулином, низким риском лекарственных взаимодействий, устойчивостью эффекта и наличием плейотропных свойств. Они всесторонне изучены и имеют потенциал для расширения сферы применения, в частности в неврологии.
Вместе с тем ингибиторы ДПП-4 отличает значительная химическая гетерогенность, с которой связывают различия в фармакокинетике и фармакодинамике: метаболизме, элиминации, продолжительности действия, ингибирующей активности и селективности. Минимальные различия тем не менее позволяют максимально индивидуализировать подбор ингибитора ДПП-4 и его дозы пациенту с хронической болезнью почек, нарушением функции печени, принимающего препараты по поводу сопутствующих заболеваний. Кроме того, нельзя исключить разную активность и неодинаковую устойчивость гликемического эффекта ингибиторов ДПП-4 при длительной терапии.
Новые препараты ингибиторов ДПП-4, доступные в России, уступают давно зарекомендовавшим себя представителям данного класса по объему клинических исследований, прежде всего долгосрочных, включая оценку сердечно-сосудистой безопасности. Напротив, первый в классе ситаглиптин сохраняет позиции эталонного ингибитора ДПП-4, обладающего высокой ингибирующей активностью и устойчивым на протяжении длительного времени гликемическим эффектом, минимальным риском лекарственных взаимодействий и подтвержденной безопасностью, в том числе в отношении риска госпитализаций по поводу сердечной недостаточности у пациентов с сердечно-сосудистой патологией и нарушением/недостаточностью функции почек.
A.V. Sidorov, MD, PhD
Yaroslavl State Medical University
Contact person: Alexander V. Sidorov, alekssidorov@ya.ru
The review discusses the class properties of dipeptidyl peptidase 4 (DPP-4) inhibitors, including pleiotropic effects, as well as clinically meaningful pharmacological peculiarities of eight drugs approved to date in the Russian Federation: alogliptin, vildagliptin, hemigliptin, gozogliptin, linagliptin, saxagliptin, sitagliptin, evogliptin. Based on randomized controlled trials and meta-analyses, the glycemic effect of DPP-4 inhibitors in monotherapy and combination therapy is analyzed. The article deals with the use of the drugs in special populations, including elderly and patients with renal function impairment. Potential drug interactions and topical safety aspects are considered utilizing the data obtained from long-term studies and recent meta-analyses.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.