Клиническая фармакология миорелаксантов
- Аннотация
- Статья
- Ссылки
- English


Введение
Миорелаксанты широко используются в комплексном лечении спастичности при рассеянном склерозе или после инсульта, а также болевых синдромов.
Ученые из США установили, что лишь у 16% пациентов с рассеянным склерозом спастичность отсутствовала, в 31% случаев она была выражена в минимальной степени, в 19% – в легкой, в 17% – средней, в 13% – тяжелой, в 4% случаев – носила тотальный характер, делая невозможной повседневную активность [1].
Еще одну группу пациентов, которым требуется назначение миорелаксантов, составляют перенесшие инсульт [2]. Так, в первые три месяца после инсульта, чаще геморрагического, спастичность наблюдалась у 17–25% больных [3].
Миорелаксанты также применяются при боли в нижней части спины, преимущественно острой и ассоциированной с мышечным спазмом [4]. Согласно данным разных исследователей, распространенность боли в нижней части спины варьируется от 1,4 до 20,0% [5]. В Российской Федерации, по данным Всемирной организации здравоохранения, боль в нижней части спины среди лиц старше 50 лет встречается в 56% случаев [6]. В то же время установлено, что от 50 до 80% взрослого населения сталкивается с такой болью хотя бы раз в жизни [7, 8].
Для сравнения эффективности миорелаксантов при боли в нижней части спины R. Chou и соавт. провели систематический обзор [9]. Ученые отметили, что для оценки таковой недостаточно качественных клинических исследований [9].
Поскольку наиболее эффективный миорелаксант при лечении боли в нижней части спины не определен, при выборе препарата следует уделять внимание его переносимости и профилю безопасности.
Особенно важна хорошая переносимость при лечении в амбулаторных условиях, так как развитие нежелательных лекарственных реакций может сопровождаться снижением комплаентности и даже прекращением приема препарата [10].
В статье рассмотрена фармакология наиболее изученных и широко применяемых в клинической практике миорелаксантов: тизанидина, баклофена и толперизона.
Фармакодинамика и фармакокинетика
Тизанидин
Тизанидин относится к миорелаксантам центрального действия. Препарат является агонистом альфа-2-адренергических рецепторов. Их стимуляция в области пресинаптической мембраны приводит к уменьшению секреции аминокислот (глутамата и аспартата), активирующих мотонейроны спинного мозга [11, 12]. Как следствие, угнетаются полисинаптические рефлексы спинного мозга, ответственные за гипертонус мышц. Наряду с этим ингибирование межнейрональной активности, также вызванное стимуляцией альфа-2-адренергических рецепторов, обусловливает дополнительную антиноцицептивную и противосудорожную активность [12].
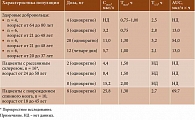
Фармакокинетический профиль тизанидина изучался в ряде клинических исследований как с участием здоровых добровольцев, так и с участием пациентов с повреждением спинного мозга или рассеянным склерозом. Установлено, что при пероральном приеме тизанидин быстро абсорбируется (53–66% принятой дозы). Максимальная концентрация в плазме крови (Cmax) при однократном пероральном приеме в дозах 5 и 8 мг варьируется от 3,2 до 25,8 мкг/л соответственно [13]. Время достижения максимальной концентрации (Tmax) в плазме крови составляет 0,75–2,00 часа (табл. 1) [13].
В исследовании с участием здоровых добровольцев продемонстрировано, что прием пищи не оказывал значимого влияния на фармакокинетику тизанидина [13].
Абсолютная биодоступность тизанидина при пероральном приеме составляет от 20 до 34%, что обусловлено выраженным эффектом первого прохождения через печень [12].
Метаболизируется тизанидин в печени путем окисления при участии изоферментов системы цитохрома Р450 (CYP1A2) с образованием неактивных метаболитов, 19–23% из которых выводятся с фекалиями, 53–66% – с мочой. В неизмененном виде с мочой выводится менее 3% дозы тизанидина [14].
В большинстве клинических исследований показано, что период полувыведения (T1/2) тизанидина составляет 2,1–4,2 часа [13]. При нарушении функции почек (клиренс креатинина менее 1,5 л/ч (25 мл/мин)) период полувыведения при однократном приеме в дозе 4 мг увеличивается до 13,6 часа [13].
Баклофен
Баклофен также относится к миорелаксантам центрального действия. Препарат является липофильным производным гамма-аминомасляной кислоты (ГАМК) и имеет высокую аффинность с ее В-рецепторами. Он активирует рецепторы В к ГАМК на моно- и полисинаптических нейронах спинного и головного мозга. Воздействуя на В-рецепторы, баклофен вызывает уменьшение спастичности.
Как известно, ГАМК влияет на два типа рецепторов – А и В [15]. Рецепторы А являются ионотропными. При связывании с ними ГАМК в мембране нервной клетки открывается ионный канал, ионы хлора приникают в клетку, снижая ее реактивность. Данный тип рецепторов является мишенью бензодиазепинов, барбитуратов, летучих анестетиков и алкоголя [15]. Рецепторы В относятся к метаботропным. Опосредованно, через систему G-белков, они снижают уровень возбуждения в клетке. Уменьшение чувствительности клетки к возбуждающему воздействию обеспечивается благодаря влиянию на кальциевые и калиевые каналы. В-рецепторы могут располагаться как пресинаптически, так и постсинаптически [16].
Считается, что тормозящее влияние на головной мозг при активации В-рецепторов реализуется за счет уменьшения высвобождения возбуждающих клетку аминокислот (например, глутамата), а также за счет гиперполяризации постсинаптических нейронов [16].
Следует отметить, что для баклофена характерен синдром отмены. Это может проявляться в виде галлюцинации, дезориентации, спутанности сознания, тахикардии, тремора, судорог и ригидности мышц, а также в виде гипертензии и гипертермии. Развитие данных состояний обусловлено быстрым прекращением тормозящего воздействия препарата на рецепторы ГАМК. Факторами риска возникновения синдрома отмены считаются прием высоких доз, длительная терапия и быстрая ее отмена [17].
При пероральном применении баклофен быстро всасывается из желудочно-кишечного тракта, биодоступность составляет 70–85% [18]. Однако при увеличении дозы абсорбция может снижаться. При однократном пероральном приеме в дозе 50 мг Cmax у здоровых добровольцев составляла 737,6 нг/мл, Tmax – 1,9 ± 0,3 часа [19].
Необходимо отметить, что результаты проспективного исследования, в котором принимали участие 15 добровольцев мужского пола в возрасте от 19 до 30 лет [20], позволили предположить отсутствие значимых фармакокинетических взаимодействий между баклофеном и тизанидином. Исследование состояло из трех периодов: первый – прием тизанидина по 4 мг три раза в сутки в течение семи дней, второй – прием баклофена по 10 мг три раза в сутки в течение семи дней, третий – совместный прием тизанидина и баклофена в вышеперечисленных дозах также в течение семи дней. Между данными периодами проводились периоды отмывки длительностью четыре дня. Cmax баклофена при его отдельном приеме достигала 211 нг/мл, при совместном с тизанидином – 208 нг/мл [20].
Баклофен обладает относительно коротким T1/2 – от двух до шести часов.
Около 15% баклофена метаболизируется в печени путем дезаминирования. В клинических исследованиях с использованием меченного радиоактивным изотопом препарата установлено, что порядка 85% выводится в неизмененном виде преимущественно с мочой, а также с фекалиями [18].
Полное выведение препарата из организма отмечается через 72 часа после приема.
Толперизон
Толперизон – миорелаксант центрального действия, схожий по химической структуре с местными анестетиками (лидокаином). Препарат преимущественно применяется в странах Европы. В США он не зарегистрирован.
Механизм действия толперизона до конца не изучен. Однако установлено, что он блокирует потенциал-зависимые натриевые и калиевые каналы на уровне спинного мозга, вызывая торможение пресинаптического высвобождения нейромедиаторов [21]. Кроме того, препарат подавляет моно- и полисинаптические рефлексы на уровне спинного мозга, оказывает лидокаиноподобное обезболивание и стабилизирует мембраны нервных клеток [21]. Наряду с этим толперизон усиливает периферический кровоток, облегчает произвольные мышечные движения [21].
Толперизон быстро и практически полностью абсорбируется из желудочно-кишечного тракта. За счет эффекта первого прохождения через печень его абсолютная биодоступность составляет 17–20% [21, 22]. Время достижения максимальной концентрации – от 0,5 до 1,0 часа [21]. Период полувыведения в среднем составляет 1,7 часа [22].
Отличительной чертой толперизона является значительная вариабельность фармакокинетических параметров в зависимости от генетических особенностей. Так, в исследовании M. Pawlowska и соавт. (2015 г.) [22] приняли участие 28 здоровых мужчин европеоидной расы в возрасте 27,3 ± 7,7 года [22]. Добровольцы однократно перорально получили толперизон в дозе 150 мг. С помощью полимеразной цепной реакции в режиме реального времени у них было выявлено носительство аллелей генов CYP2D6 и CYP2C19 цитохрома Р450, которые ответственны за метаболизм толперизона.
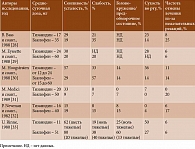
Сmax препарата варьировалась от 4,47 до 336,43 нг/мл, в среднем она составляла 90,88 ± 86,04 нг/мл (табл. 2) [22].
В исследовании также было установлено, что частота генетических полиморфизмов генов, обеспечивающих медленный/замедленный метаболизм толперизона, у здоровых добровольцев для изоферментов CYP2D6 и CYP2C19 составляла 46,43 и 0% соответственно [22]. Результаты исследования Z. Desta и соавт. свидетельствуют, что количество лиц европеоидной расы с генетически обусловленным медленным метаболизмом толперизона не превышает 6% [23]. Для получения точной информации требуется более широкое изучение проблемы в разных популяциях и странах.
Аналогичные данные о вариабельности фармакокинетических параметров толперизона представили J.W. Bae и соавт. (2007 г.) [24]. Исследование проводилось с участием 15 здоровых добровольцев монголоидной расы (корейцы). Средний возраст мужчин – 23,6 ± 1,3 года. Толперизон назначался внутрь в дозе 450 мг однократно. Cmax варьировалась от 64,2 до 784,9 нг/мл. Площадь под фармакокинетической кривой (AUC), начиная с нулевого значения до бесконечности (AUC0-∞), – от 125,9 до 1241,3 нг × ч/мл [24].
Таким образом, в зависимости от генетических особенностей человека максимальная концентрация толперизона в плазме крови может значительно колебаться. Как следствие, либо неэффективность терапии (при низких концентрациях, обусловленных высоким уровнем метаболизма толперизона), либо высокий риск развития нежелательных и токсических реакций (при низком уровне метаболизма, приводящем к высоким концентрациям препарата в крови).
Выводится толперизон преимущественно почками (85%). При этом 98% препарата элиминируется из организма в течение 24 часов после приема [21].
Нежелательные реакции
Тизанидин
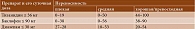
Тизанидин, как правило, хорошо переносится. Согласно результатам клинических исследований, у пациентов со спастичностью, принимавших тизанидин ≤ 36 мг/сут, наиболее частыми нежелательными реакциями были сухость во рту (23–57%), сонливость (24–48%), мышечная слабость (18–48%) и головокружение (10–19%). В 5–7% случаев отмечалось клинически значимое повышение уровня печеночных ферментов, разрешавшееся после отмены препарата [25–27].
В сравнительных исследованиях среди наиболее частых побочных эффектов на фоне приема тизанидина ≤ 32 мг/сут также указывались сонливость, сухость во рту и мышечная слабость [13]. При этом частота развития сонливости у получавших тизанидин и принимавших баклофен была сопоставимой – от 15 до 67% (табл. 3) [13].
Следует отметить, что наиболее высокой частота отмены препарата в связи с мышечной слабостью была у баклофена (0–25%), далее по уменьшению показателя следовали диазепам (4–6%) и тизанидин (0–6%) (табл. 4) [28–33].
Серьезные нежелательные реакции на фоне терапии тизанидином зафиксированы у 0,18% пациентов [34]. Таковые были представлены галлюцинациями и тяжелыми нарушениями функции печени. В большинстве случаев поражение печени на фоне терапии тизанидином проявляется в виде повышения уровня печеночных ферментов (аланинаминотрансферазы и аспартатаминотрансферазы) – 5% больных.
Помимо профиля безопасности важной характеристикой любого препарата считается переносимость. Опрос пациентов со спастичностью, получавших тизанидин, показал, что общая переносимость препарата была хорошей или превосходной в 44–100% случаев (табл. 5) [13].
В сравнительных исследованиях переносимость тизанидина была лучше, чем баклофена и диазепама, что может влиять на приверженность терапии, особенно в амбулаторных условиях [13].
Баклофен
Частота нежелательных реакций при пероральном приеме баклофена колеблется от 10 до 75% [35]. К наиболее распространенным относятся сонливость, чрезмерная общая слабость, выраженная мышечная слабость и головокружение.
Пациентам с нарушенной функцией почек препарат должен назначаться с осторожностью в связи с более высоким риском развития нежелательных реакций. Данные об этом были получены F.T. Muanda и соавт. при проведении крупного ретроспективного когортного исследования с участием 15 942 пожилых пациентов (66 лет и старше), имевших хроническую болезнь почек (расчетная скорость клубочковой фильтрации (рСКФ) < 60 мл/мин/1,73 м2), но не находившихся на гемодиализе [36]. Ученые оценивали 30-дневный риск развития энцефалопатии на фоне приема баклофена в дозах ≥ 20 и < 20 мг/сут. Среди включенных в исследование 61% были женщины. Средний возраст участников – 77 лет. Стартовая доза баклофена 20 мг/сут и более назначена 61% пациентов, менее 20 мг/сут – 39%. Частота госпитализаций по причине энцефалопатии среди принимавших баклофен в дозе 20 мг/сут и более составила 1,11%, менее 20 мг/день – 0,42% [36]. Частота госпитализаций увеличивалась по мере ухудшения функции почек. При рСКФ 45–59 мл/мин/1,73 м2 она составляла 0,42%, рСКФ 30–44 мл/мин/1,73 м2 – 1,23%, рСКФ < 30 мл/мин/1,73 м2 – 2,90%.
Сравнивали также относительный риск госпитализаций по причине энцефалопатии у принимавших и не принимавших баклофен (n = 284 263). Взвешенный относительный риск госпитализаций на фоне приема препарата в дозе менее 20 мг/сут составил 5,9 (при 95%-ном доверительном интервале (ДИ) 3,59–9,70), в дозе 20 мг/сут и более – 19,8 (95% ДИ 14,0–28,0).
Таким образом, было установлено, что у пациентов с нарушением функции почек баклофен в течение первых 30 дней приема способствовал развитию энцефалопатии, требующей госпитализации, поэтому при его назначении таким больным следует оценить соотношение «польза/риск» [36].
Толперизон
Наиболее часто на фоне терапии толперизоном наблюдаются слабость и боль в мышцах, головокружение, крапивница, тошнота, рвота, сухость во рту [21]. Данные реакции обычно нивелируются после отмены препарата. Однако в литературе описаны и тяжелые нежелательные реакции, такие как анафилактический шок [37]. Следует отметить, что толперизон не обладает седативным эффектом [6].
Согласно данным пострегистрационных исследований и системы спонтанных сообщений, примерно в 50% случаев возникали аллергические реакции, далее следовали нежелательные реакции со стороны желудочно-кишечного тракта [38]. Среди аллергических реакций наиболее часто отмечались крапивница (5,1%), зуд (4,8%), одышка (4,2%), ангионевротический отек (3%), эритема (2,6%), сыпь (1,8%) и анафилактический шок (1,2%). Порядка 30% аллергических реакций развивались при применении толперизона с другими препаратами, наиболее часто с нестероидными противовоспалительными препаратами [38]. Аллергические реакции на фоне терапии толперизоном стали основанием для Европейского медицинского агентства рекомендовать воздержаться от назначения пероральных форм толперизона, за исключением взрослых пациентов со спастичностью после инсульта (2012 г.) [39]. Это заявление было сделано после оценки соотношения «польза/риск» при разных заболеваниях.
Данные пострегистрационных исследований и системы спонтанных сообщений также позволили выявить серьезные побочные эффекты в виде реакций гиперчувствительности, а также недостаток данных, подтверждающих эффективность толперизона при лечении ряда заболеваний. В связи с этим эксперты Европейского медицинского агентства рекомендовали ограничить применение перорального толперизона, за исключением лечения спастичности после инсульта, при которой польза от применения препарата перевешивает потенциальный риск [39].
Заключение
На сегодняшний день миорелаксанты широко применяются в лечении спастичности различной природы и боли в нижней части спины. Данные клинических исследований не позволяют достоверно выделить наиболее эффективный миорелаксант, в связи с чем одними из ключевых факторов при выборе препарата становятся профиль безопасности и переносимость. Следует отметить, что выбирать миорелаксант следует индивидуально, учитывая спектр возможных нежелательных реакций, переносимость и наличие сопутствующей патологии, предрасполагающей к развитию нежелательных лекарственных реакций.
Одним из наиболее изученных и обладающих благоприятным профилем безопасности миорелаксантов является тизанидин (Сирдалуд®), который при постепенной титрации дозы, как правило, хорошо переносится пациентами и не вызывает серьезных нежелательных реакций.
Ye.V. Dovgan, PhD
Smolensk Regional Clinical Hospital
Contact person: Yevgeny V. Dovgan, dovganrus@mail.ru
Muscle relaxants are currently widely used in the treatment of spasticity and various pain syndromes. This article reviews the clinical pharmacology of three muscle relaxants, such as: tizanidine, baclofen and tolperisone. Special attention is paid to the safety and tolerability of these drugs.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.