Клиническое применение модифицированного антиглаукомного устройства
- Аннотация
- Статья
- Ссылки
- English
Введение
Основной целью хирургических вмешательств при глаукоме является снижение внутриглазного давления (ВГД) для уменьшения негативного воздействия на зрительный нерв [1]. Операциями выбора считаются синустрабекулэктомия, вмешательства с применением шунтов ExPress, бесклапанных (Molteno) и клапанных дренажных устройств (Ahmed, Baerveldt) [1–3]. Данные методики высокоэффективны в достижении целевых значений ВГД и предотвращении развития глаукомы, но также ассоциируются с высоким риском послеоперационных осложнений [1, 2].
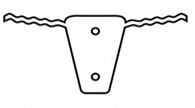
Непроникающая глубокая склерэктомия (НГСЭ) была предложена в 1980 г. С.Н. Федоровым и соавт. [4] как более безопасная альтернатива стандартным антиглаукомным операциям. В ходе данного вмешательства удаляются глубокий слой корнеосклеральных тканей, наружная стенка и эпителиальный слой внутренней стенки шлеммова канала [3]. Основным преимуществом такого хирургического лечения глаукомы является то, что не происходит вскрытия передней камеры глаза, за счет чего снижаются риск и тяжесть осложнений в интра- и послеоперационном периодах. Вместе с тем данная операция менее эффективна по сравнению с операциями проникающего типа [5–7]. По данным исследований, отмечается избыточное рубцевание, что приводит к невысокой продолжительности гипотензивного эффекта непроникающей глубокой склерэктомии [6–8]. Для увеличения срока гипотензивного эффекта указанная операция подлежит корректировке. Например, для уменьшения рубцевания в зоне операции Е.Х. Тахчиди была предложена микроинвазивная НГСЭ, в ходе которой уменьшаются разрез конъюнктивы и размер склерального лоскута [9]. Однако даже в этом случае может иметь место послеоперационное рубцевание. В связи с этим в ходе НГСЭ могут быть использованы антиглаукомные имплантаты, которые также дополнительно усиливают гипотензивный эффект [10]. Одним из таких устройств является Репер-НН А2, представляющий собой пластину в виде трапеции в осевой части длиной 3 мм и основаниями 1 и 2 мм (рис. 1). На расстоянии 0,25 мм от широкого основания трапеции отходят два ответвления, предназначенные для имплантации в просвет шлеммова канала, шириной 0,25 мм, длиной 2,1 мм, за счет неправильной формы которых поддерживается просвет в открытом состоянии, а также происходит фиксация данного устройства. В области широкого основания имплантата имеется отверстие, улучшающее эффективность возможной десцеметогониопунктуры. Второе отверстие, располагающееся ближе к короткому основанию, служит для дополнительной шовной фиксации при необходимости. Имплантат изготовлен из биосовместимого пространственно-сшитого полимера на основе лапрола, монометакрилового эфира этиленгликоля и метакриловой
кислоты.
Для дополнительного уменьшения зоны хирургического вмешательства данный имплантат предложено изменять в ходе операции. У короткого основания ширину данного устройства уменьшили до 0,5 мм, убрали дополнительное фиксационное отверстие, размер длинного основания уменьшился до 1,0 мм, сохранилось отверстие, позволяющее улучшить результаты проводимой по показаниям десцеметогониопунктуры. Сохранено одно извитое ответвление, позволяющее фиксировать имплантат в шлеммовом канале и дополнительно поддерживающее его просвет. За счет данных изменений достигается уменьшение зоны проводимой операции, увеличивается гипотензивный эффект и снижается выраженность рубцевания в области фильтрационной подушки
(рис. 2).
Клинический случай
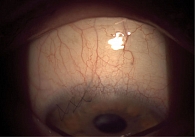
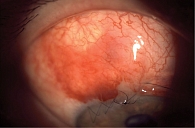
Пациент Д. поступил в офтальмологическое отделение ГБУЗ МО МОНИКИ с диагнозом: открытоугольная глаукома стадии IIIА, артифакия правого глаза. Заболевание выявлено на осмотре врачом-офтальмологом по месту жительства летом 2023 г. Была назначена консервативная терапия: бринзоламид 1,0% + тимолол 0,5 в форме фиксированной комбинации по одной капле два раза в день, бримонидин 0,15% по одной капле три раза в день. Терапия оказалась мало эффективна, и пациенту рекомендовали хирургическое лечение. В анамнезе у пациента имела место операция по удалению катаракты с имплантацией интраокулярной линзы (ИОЛ) зрачковой фиксации на правом глазу. При поступлении: максимально корригированная острота зрения (МКОЗ) правого глаза – 0,1, МКОЗ левого глаза – 1,0. ВГД (по Маклакову) – OD: 28 мм рт. ст., OS: 18 мм рт. ст. При биомикроскопии отмечались характерные для глаукомы изменения. Осмотр глазного дна: диск зрительного нерва бледный, с серым оттенком, границы четкие, экскавация 0,8–0,9 (рис. 3).
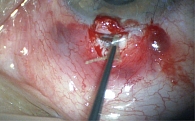
Для нормализации значений ВГД с учетом сохраняющихся высоких показателей пациенту провели непроникающую глубокую склерэктомию с имплантацией модифицированного антиглаукомного имплантата Репер-НН А2 под местной анестезией. В ходе вмешательства данное устройство было изменено с помощью хирургического инструмента и имплантировано в шлеммов канал (рис. 4).
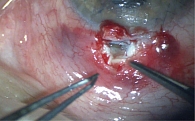
На первые сутки после операции зафиксировано снижение ВГД до 14 мм рт. ст. МКОЗ на правом глазу – 0,4. При осмотре переднего отдела глаза отмечались высокая фильтрационная подушка, субконъюнктивальное кровоизлияние во внутреннем отделе, передняя камера средней глубины (рис. 5).
Во время госпитализации пациенту проводилась консервативная терапия антибактериальными препаратами, а также нестероидными противовоспалительными средствами в форме глазных капель.
В связи с компенсацией ВГД и увеличением остроты зрения было принято решение о выписке пациента под наблюдение офтальмолога по месту жительства с назначением стероидных противовоспалительных препаратов, назначена дата контрольного осмотра.
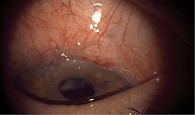
На контрольном осмотре через две недели острота зрения сохранялась. Целевые значения ВГД – 18 мм рт. ст. (с использованием прибора iCare). Отмечалась высокая фильтрационная подушка (рис. 6). У пациента появились жалобы на ощущение инородного тела в правом глазу, в связи с чем швы были сняты. Продолжено консервативное лечение с применением кортикостероидных глазных
капель.
Заключение
Проведение микроинвазивных операций с применением различных моделей антиглаукомных устройств может улучшить прогноз после вмешательства, что подтверждено в ряде исследований [11, 12].
Предложенный способ модификации имплантата позволяет сохранить открытым просвет шлеммова канала, снизить потенциальный риск послеоперационных осложнений, а также сократить срок госпитализации пациента.
При избыточном рубцевании в зоне вмешательства возможно проведение процедуры нидлинга или ревизии фильтрационной подушки с целью рассечения образовавшихся спаек [13]. Если гипотензивный эффект недостаточен, сохраняется возможность проведения десцеметогониопунктуры за счет сохранения отверстия в имплантированном изделии.
Таким образом, применение модифицированного антиглаукомного имплантата Репер-НН А2 признано перспективным направлением в развитии хирургического лечения глаукомы.
S.S. Khaldeev, I.A. Loskutov, PhD, O.М. Andryukhina
M.F. Vladimirsky Moscow Regional Research Clinical Institute
Contact person: Igor A. Loskutov, loskoutigor@mail.ru
Non-penetrating deep sclerectomy is one of the common methods of surgical treatment of glaucoma, which reduces the incidence of complications in the pre- and postoperative period, but it is less effective compared to trabeculectomy or operations using shunt devices. To improve the prognosis after the intervention, the use of a modified antiglaucoma implant was proposed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.