Клиническое значение суточного мониторирования гликемии у больных с нарушением углеводного обмена
- Аннотация
- Статья
- Ссылки




Согласно заключению экспертов ВОЗ, представленного в Кейптауне на Всемирном конгрессе диабетологов в 2006 году, к 2025 году прогнозируется рост больных СД до 380 млн человек, что составит 7% от населения земного мира (5, 10).
Согласно современным представлениям о регуляции метаболизма глюкозы, основу патогенеза СД 2 типа составляют два патофизиологических дефекта, контролирующих динамику уровней гликемии:
-
инсулинорезистентность (ИР) – снижение чувствительности к инсулину инсулинозависимых тканей (мышечная, жировая, печеночная);
-
нарушение функции ß-клеток поджелудочной железы (десенситизация клеток) (5).
Суммарно, на первом этапе (доклиническая форма СД 2 типа) гипергликемия (ГГ) обусловлена снижением потребления глюкозы мышечной, жировой тканями в результате первичной ИР и компенсаторной гиперпродукции глюкозы печенью. В ответ на гипергликемию, для сохранения нормального гомеокинеза глюкозы, происходит повышенная секреция инсулина ß-клетками поджелудочной железы – гиперинсулинемия (ГИ). Сохраняющаяся или прогрессирующая «первичная» ИР на фоне неадекватной секреции инсулина ведут к развитию нарушения толерантности к глюкозе (НТГ).
На втором этапе хроническая персистирующая ГГ сопровождается глюкозотоксичностью, что способствует развитию вторичной ИР и десенситизации ß-клеток поджелудочной железы, с ухудшением их секреторной активности (2, 4, 11).
К моменту клинической манифистации СД 2 типа у большинства пациентов уже присутствуют выше описанные компоненты, при этом глюкозотоксичность – неэнзиматическое гликирование белков ведет к развитию нейро-, микро- и ангиопатий, лежащих в основе СС, неврологических, почечных и периферических сосудистых заболеваний. Исследования последних лет указывают на ведущую роль уровней гликемии натощак и постпрандиальной гипергликемии (1-2 часа после приема пищи) в процессе гликирования белков при СД (6, 8, 12).
Нарушения метаболизма глюкозы при ИР облигатно сопровождаются повышенным высвобождением свободных жирных кислот (СЖК) из висцерального депо жировой ткани. Избыточное накопление СЖК в островках поджелудочной железы оказывает липотоксический эффект на функциональную активность ß-клеток. В свою очередь, избыточное поступление СЖК в воротную вену печени препятствует адекватной деятельности печени в снижении концентрации инсулина в крови, ведет к прогрессированию ИР и увеличению синтеза атерогенных липопротеидов. Атерогенная дислипидемия при СД 2 типа характеризуется повышением уровня триглицеридов – гипертриглицеридемия (ГТг), увеличением количества высокоатерогенных мелких плотных липопротеидов низкой плотности (ЛПОНП) и снижением антиатерогенных липопротеидов высокой плотности (ЛПВП).
Фоновая и постпрандальная ГГ сопровождается интенсивным образованием активных свободных радикалов, которые через оксидативные механизмы, связываясь с молекулами липидов, приводят к увеличению продуктов перекисного окисления липидов (ПОЛ) и способствуют раннему развитию атеросклероза, формированию высоких цифр АД, повышению риска ИБС. Гипертриглицеридемия у больных СД 2 типа в два раза увеличивает риск ИБС, снижение уровня ХС ЛПВП – в 4 раза, а при преобладании мелких плотных частиц ХС ЛПНП – в 6 раз (12).
В настоящее время, гипергликемия и гиперинсулинемия рассматриваются как одни из ведущих независимых факторов риска ССЗ, что позволило Американской кардиологической ассоциации причислить СД 2 типа к сердечно-сосудистым заболеваниям (1, 9, 10).
Так, в Фрамингемском эпидемиологическом исследовании была показана связь нарастания риска застойной сердечной недостаточности у больных СД: у молодых мужчин, страдающих СД, недостаточность кровообращения встречалась в 4 раза чаще, а у женщин с СД – в 8 раз чаще по сравнению с аналогичной возрастной группой пациентов без СД (1, 9, 13). В связи с этим, в январе 2007 года были опубликованы совместные рекомендации Европейского общества кардиологов и Европейской ассоциации лечения сахарного диабета по комплексному лечению ХСН в сочетании с СД, которые представлены в таблице 1 (10).
В исследовании UKPDS (UK Prospective Diabetes Study) было продемонстрировано, что при естественном прогрессировании СД 2, количество нормально функционирующих ß-клеток поджелудочной железы уменьшается со скоростью 5% в год, а повышение уровня гликированного гемоглобина (HbA1c) на 1% повышает риск смертности, связанный с СД на 21%, развитие ИМ – на 14%, прогрессирование болезней периферических сосудов – на 43%, микрососудистых осложнений – на 37%, экстракции катаракты – на 19%, что требует более тщательного контроля за уровнем гликемии и компенсации углеводного обмена (5, 11, 14).
В соответствии с рекомендациями European Diabetes Policy Group приняты более жесткие критерии компенсации углеводного и липидного обменов (таблица 2).
Учитывая патогенетические процессы, лежащие в основе прогрессирования СД и развития его осложнений, тактика лечения должна быть направлена на уменьшение ИР, нормализацию уровней глюкозы натощак и постпрандиальной гликемии, снижение концентрации HbA1c до нормы – ≤ 6%, коррекцию дислипидемии в сторону антиатерогенности, достижение целевого уровня АД – ≤ 130/85 мм рт. ст. (3, 7).
Контроль гликированного гемоглобина достаточно осуществлять раз в 3 месяца, т.к. этот показатель изменяется в течение длительного периода времени, соответствующего длительности жизни эритроцитов.
Контроль гликемии обычно осуществляется с помощью индивидуальных глюкометров, но как показывает практика, точечные измерения не дают полноценной картины колебаний гликемии в течение суток. Особенно проблематично выявить скрытую гипогликемию в ночное время, которая может спровоцировать комплекс патологических реакций с развитием «рикошетной» гипергликемии.
В последние годы в практическую медицину активно внедряются методы длительного мониторирования глюкозы – Continuous Glucose Monitoring System (CGMS), которые позволяют идентифицировать периоды спонтанной постпрандиальной гипергликемии и скрытой гипогликемии. Эти методы, в сопоставлении с почасовым дневником пациента, обеспечивают информацию о направлении, величине, продолжительности, частоте и причинах изменений глюкозы в крови, позволяя, таким образом, более адекватно осуществлять контроль за течением болезни и лечением больных СД.
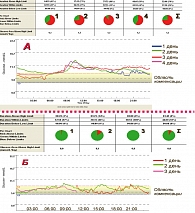
Система постоянного мониторирования глюкозы – CGMS – дает возможность круглосуточно (288 раз в сутки) контролировать уровни гликемии, на протяжении 3-4 дней, с количественным анализом и графическим представлением полученных результатов, что позволяет лечащему врачу, в сопоставлении с дневником пациента, составить четкое представление о характере метаболизма глюкозы в организме и наметить рациональные пути лечения. Система постоянного мониторирования глюкозы – CGMS – состоит из монитора (аппарата), блока соединения с компьютером, программного обеспечения и одноразового сенсора. Сенсор фиксируется подкожно сроком до 3-4 дней, тестирование глюкозы происходит автоматически в интерстициальной жидкости 288 раз в сутки. Перед установкой датчика-сенсора врачом индивидуально задаются допустимые границы колебаний гликемии (диапазон компенсации). Результаты записываются в память монитора и через 3-4 дня врач, анализируя информацию, корректирует дозы инсулина и схему лечения. При расшифровке данных врач и пациент получают графики изменения гликемии на протяжении суток, по которым компьютерная программа высчитывает процент отклонений регистрируемых параметров глюкозы как «гипогликемия» или «гипергликемия» (рисунок 1).
Под нашим наблюдением находилось 75 пациентов с СД 2 типа, которым в программу обследования и до и после лечения (через 3 и 6 месяцев) была включена система непрерывного мониторирования уровня глюкозы – CGMS GOLD.
При мониторном исследовании состояния углеводного обмена для каждого пациента в память прибора задавались параметры допустимых колебаний уровня гликемии: нижняя граница на уровне 3,8-4,0 ммоль/л, верхняя граница – 7,8-8,1 ммоль/л. Отклонения ниже минимального порога в программе оценивались как гипогликемические состояния, отклонения выше допустимого порога – как гипергликемические состояния и рассчитывались в процентах.
Среди 75 пациентов с СД 2 типа было 26 женщин (34,7%) и 49 мужчин (65,3%). Возраст пациентов колебался от 45 до 60 лет и в целом по группе больных СД 2 типа средний возраст составил 54,8 ± 3,8 лет, статистически не отличался в подгруппах (женщины, мужчины). Длительность анамнеза заболевания с момента постановки диагноза СД 2 типа не превышала 5 лет и в среднем составила 3,9 ± 0,8 лет.
На момент первичного обследования только у 9 пациентов СД 2 типа (12%) показатели мониторинга гликемического профиля и уровень гликированного гемоглобина (не более 6,5%) соответствовали критериям компенсации, что позволило не проводить коррекции терапии сахароснижающими препаратами.
В зависимости от исходного суточного колебания уровней гликемии (по данным первичного мониторинга) определяли режим приема инсулиновых сенситайзеров – бигуанидов (начальная доза метформина – 850 мг/сутки). Через 5-7 дней при отсутствии побочного эффекта со стороны желудочно-кишечного тракта дозу метформина увеличивали до 1000-2000 мг/сут. К инсулиновым сенситайзерам добавляли комплексную терапию: фибраты (Трайкор 145 мг, 1-2 раза в сутки), антиоксиданты (Актовеегин 800-1000 мг/сутки), гепатопротекторы (Гептрал 400 мг, 1-2 раза в сутки, липоевая кислота 0,025 г, 2-3 раза в день).
Результаты обследования до и после лечения (6 месяцев) представлены в таблице 3.
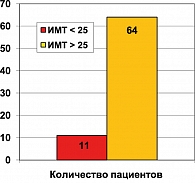
В группе обследуемых больных СД 2 типа индекс массы тела > 25,0 кГ/м2 был зарегистрирован у 64 пациентов (85,3%), в среднем составил 31,4 ± 2,5 кГ/м2 (рисунок 2).
К концу контрольного исследования у 71 пациента (94,7%) по данным суточного мониторирования гликемии удалось достигнуть компенсации углеводного обмена – минимальных колебаний гликемического профиля в пределах допустимых границ (рисунок 3).
Согласно данным, представленным в таблице 3, к концу лечения отмечена статистически не достоверная тенденция к снижению ИМТ на 4,1%, показатели уровня сахара натощак и постпрандиальной гликемии суммарно по группе статистически достоверно снизились соответственно на 20,4% и 19,6% (p< 0,01). Средний показатель HbАс1 при первичном обследовании больных СД 2 типа равнялся 10,8 ± 1,1%, к концу контрольного обследования после лечения уровень HbАс1 в целом по группе снизился на 31,5% (до 7,4 ± 0,8%).
Аналогично к концу контрольного срока лечения отмечена статистически достоверная положительная динамика со стороны липидного спектра крови: уровень триглицеридов снизился на 39,1% (от 2,3 ± 0,3 ммоль/л до 1,4 ±0,3 ммоль/л, р < 0,001); концентрация ХС ЛПВП увеличилась на 27,3% (от 0,86 ± 0,04 ммоль/л до 1,1 ± 0,1 ммоль/л, р < 0,01), что суммарно привело к снижению ИА на 41,1% (р < 0,001).
Таким образом, суточное мониторирование уровней гликемии позволяет объективно оценить характер и уровни колебаний гликемического профиля, корректно определить схему лечения СД 2 типа сахароснижающими препаратами (бигуаниды), а в сочетании с гепатопротекторами (Гептрал, липоевая кислота), гиполипидемическими (фибраты) и антиоксидантными препаратами (Актовегин), добиться эффективной компенсации и предупредить сосудистые осложнения при этой патологии.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.