Клинико-лабораторные аспекты хронической сердечной недостаточности у больных метаболическим синдромом
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Обследованы 74 больных ХСН II–III функционального класса, включая 37 (50%) пациентов с признаками МС. Оценивались возрастная структура, клиническое течение, данные лабораторных и инструментальных исследований. Специальная программа включала определение концентрации лептина, аполипопротеинов А1 (апоА1) и B (апоВ), С-реактивного белка (СРБ) высокочувствительным методом. Проведено эхокардиографическое исследование с определением морфофункциональных показателей миокарда, определена толщина эпикардиального жира.
Результаты и обсуждение. Показано, что у пациентов с МС ХСН характеризуется более ранним развитием и тяжелым течением. Эхокардиографические исследования выявили значительное увеличение размеров камер сердца, толщины миокарда левого и правого желудочков, легочную гипертензию. Морфофункциональные изменения по ряду параметров превысили таковые у больных ХСН в отсутствие МС. Зафиксировано значительное повышение уровня лептина, являющегося маркером ожирения, фиброза и воспаления. Показатели лептина и СРБ у больных МС достоверно превысили уровни в группе больных ХСН. Отмечался дисбаланс аполипопротеинов с тенденцией к снижению апоА1 и увеличению апоВ в группе больных ХСН и МС. Установлены корреляционные связи уровня лептина, СРБ, аполипопротеинов с массой миокарда левого желудочка, толщиной эпикардиального жира, фракцией выброса.
Заключение. Данные исследования свидетельствуют о важной роли воспалительных и дисметаболических процессов в развитии и прогрессировании ХСН у пациентов с МС.
Материал и методы. Обследованы 74 больных ХСН II–III функционального класса, включая 37 (50%) пациентов с признаками МС. Оценивались возрастная структура, клиническое течение, данные лабораторных и инструментальных исследований. Специальная программа включала определение концентрации лептина, аполипопротеинов А1 (апоА1) и B (апоВ), С-реактивного белка (СРБ) высокочувствительным методом. Проведено эхокардиографическое исследование с определением морфофункциональных показателей миокарда, определена толщина эпикардиального жира.
Результаты и обсуждение. Показано, что у пациентов с МС ХСН характеризуется более ранним развитием и тяжелым течением. Эхокардиографические исследования выявили значительное увеличение размеров камер сердца, толщины миокарда левого и правого желудочков, легочную гипертензию. Морфофункциональные изменения по ряду параметров превысили таковые у больных ХСН в отсутствие МС. Зафиксировано значительное повышение уровня лептина, являющегося маркером ожирения, фиброза и воспаления. Показатели лептина и СРБ у больных МС достоверно превысили уровни в группе больных ХСН. Отмечался дисбаланс аполипопротеинов с тенденцией к снижению апоА1 и увеличению апоВ в группе больных ХСН и МС. Установлены корреляционные связи уровня лептина, СРБ, аполипопротеинов с массой миокарда левого желудочка, толщиной эпикардиального жира, фракцией выброса.
Заключение. Данные исследования свидетельствуют о важной роли воспалительных и дисметаболических процессов в развитии и прогрессировании ХСН у пациентов с МС.


Введение
В последние десятилетия отмечается рост распространенности хронической сердечной недостаточности (ХСН) в экономически развитых странах [1–3]. В США число больных, выписанных из клиники с диагнозом ХСН, за последние 20 лет возросло до 155% [4, 5]. В целом ХСН страдают около 5 млн пациентов. В России, согласно результатам исследования ЭПОХА-О-ХСН, 7,9 млн человек имеют признаки ХСН [6]. Распространенность ХСН I–IV функционального класса (ФК) в европейской части России достигает 12,3% среди женщин и 9,86% среди мужчин [6–8]. Рост распространенности ХСН в значительной мере связан с увеличением продолжительности жизни населения. Немаловажную роль играют повышение качества диагностики и лечения, в том числе инфаркта миокарда, эффективное хирургическое лечение ишемической болезни сердца (ИБС), пороков сердца, нарушений сердечного ритма [9]. В возрастной группе 70–79 лет распространенность ХСН многократно возрастает, достигая 34,3%. Годовая смертность при клинически выраженной ХСН составляет 612 тыс. случаев [6, 7]. В то же время эпидемиологические исследования свидетельствуют о том, что в России рост ХСН обусловлен не только увеличением пожилых больных (средний возраст амбулаторных пациентов с ХСН – 59,6 года), но и широкой распространенностью факторов риска (артериальной гипертензии (АГ), сахарного диабета (СД), злоупотребления алкоголем и др.) [5, 10, 11].
Сочетание нескольких атерогенных факторов (абдоминального ожирения (АО), инсулинорезистентности (ИР), АГ, гипергликемии, дислипидемии), объединенных понятием «метаболический синдром» (МС), обусловливает более быстрое развитие ХСН [12, 13].
На Международном конгрессе по предиабету и МС (критерии IDF-2005 (International Diabetes Federation – Международная федерация диабета)) в 2005 г. АО было признано основополагающим критерием диагностики МС [12].
Основанием для диагностики МС служат наличие у пациента АО (окружность талии > 80 см у женщин и > 94 см у мужчин) и двух из следующих критериев:
- АГ (артериальное давление (АД) > 140/90 мм рт. ст.);
- повышение уровня триглицеридов (ТГ) > 1,7 ммоль/л;
- снижение концентрации липопротеинов высокой плотности (ЛПВП) < 1,0 ммоль/л у мужчин и < 1,2 ммоль/л у женщин;
- повышение содержания липопротеинов низкой плотности (ЛПНП) > 3,0 ммоль/л; гипергликемия натощак (глюкоза в плазме крови натощак > 6,1 ммоль/л);
- нарушение толерантности к глюкозе (НТГ) (глюкоза в плазме крови через два часа после теста толерантности к глюкозе в пределах > 7,8 и < 11,1 ммоль/л) [14].
Эпидемиологические данные говорят о высокой распространенности МС, которая в общей популяции варьируется от 14 до 25%. В России, согласно данным Всемирной организации здравоохранения, МС диагностируется у 18,6% мужчин в возрасте до 40 лет и 44,4% мужчин в возрасте от 40 до 55 лет. У женщин МС встречается реже – у 7,3% до 40 лет и 20,8% от 40 до 55 лет [12, 15]. Чаще МС наблюдается у лиц среднего и старшего возраста (30–40%). Соответственно увеличивается и распространенность МС. У лиц старше 60 лет МС выявляется в 45% случаев [12].
Среди больных ХСН и МС отмечается более высокая смертность по сравнению с больными без МС [16].
Висцеральная жировая ткань является активным эндокринным органом, синтезирующим и секретирующим в кровоток биологически активные вещества с множеством эффектов [17, 18]. Процессы подострого воспаления при МС поддерживаются различными провоспалительными цитокинами. Не последнюю роль играют лептин и адипонектин, ответственные за метаболические нарушения.
Лептин, продуцируемый висцеральными адипоцитами, активирует важнейший фактор тканевого фиброгенеза – TGF-бета (transforming growth factor beta), что может способствовать увеличению скорости фиброза в сердечной мышце. Кроме того, лептин снижает чувствительность периферических тканей к инсулину, что сопровождается повышением степени выраженности ИР – основной составляющей процесса нарушения углеводного обмена. Установлена связь между гиперлептинемией и степенью коронарного атеросклероза [19].
Важное звено липидного обмена – аполипопротеины, белки, составляющие структурную основу липопротеинов – комплексов – переносчиков липидов. Так, основным белковым компонентом ЛПВП является аполипопротеин А1 (апоА1) (65%). Все липопротеины, несущие липиды к периферическим тканям, имеют в своей структуре аполипопротеин В (апоВ), рецепторы к которому находятся практически во всех клетках тканей, кроме клеток нервной системы и эритроцитов. У больных ХСН отмечается снижение уровня апоА1, более выраженное при III–IV ФК [20]. Низкий уровень апоА1 коррелирует с высоким уровнем фибриногена [21], натрийуретического пептида [8]. Установлено, что низкий уровень апоА1 у пациентов с ХСН повышает вероятность смерти в течение пяти лет [22].
Материал и методы
Обследовано 74 больных с ХСН II–III ФК, включая 37 (50%) пациентов с признаками МС, находившихся на лечении в Городской клинической больнице им. С.П. Боткина в период с 2014 по 2019 г. и впоследствии находившихся под наблюдением амбулаторно в течение полугода.
Диагноз ХСН устанавливали согласно Национальным рекомендациям по диагностике и лечению ХСН Всероссийского научного общества кардиологов (ВНОК) и Общества специалистов по сердечной недостаточности.
ФК ХСН оценивали по NYHA (New York Heart Association – Нью-Йоркская ассоциация кардиологов). МС диагностировали по критериям ВНОК 2009 г. (табл. 1).
Наличие у пациента центрального ожирения и двух дополнительных критериев служило основанием для диагностики МС.
Плановое клинико-лабораторное и инструментальное обследование пациентов включало сбор жалоб, анамнеза, объективный осмотр, измерение массы тела, роста, окружности талии и бедер, расчет индекса массы тела (ИМТ), общий анализ крови, биохимическое исследование крови, общий анализ мочи, проведение электрокардиографии (ЭКГ).
Специальная программа исследования предусматривала определение:
- уровня СРБ высокочувствительным (hsСРБ) иммунотурбидиметрическим методом на анализаторе KONELAB20;
- лептина в сыворотке крови методом иммуноферментного анализа;
- аполипопротеинов (апоА1 и апоВ-100) на анализаторе белков Turbox+ методом мефелометрии;
- ЛПВП, ЛПНП энзиматическими методами на биохимическом анализаторе KONELAB20.
Эхокардиографическое исследование (ЭхоКГ) проводилось на ультразвуковых приборах Tehnos и MaLab 90 (Esaote SpA, Италия) секторными анулярными механическими и секторными фазированными датчиками с частотой 2,5–5,0 МГц с применением стандартных эхокардиографических доступов – левого парастернального, апикального и субкостального.
В исследовании оценивали толщину межжелудочковой перегородки, задней стенки левого желудочка, конечный диастолический размер левого и правого желудочков, диаметр аорты, размер левого предсердия и состояние клапанного аппарата аорты, легочной артерии, количество папиллярных мышц и сократимость миокарда левого и правого желудочков. Определяли степень митральной регургитации, пролапса митрального клапана, аортальной регургитации. Оценивали систолическую функцию левого желудочка.
Всем пациентам проводилось измерение толщины эпикардиального жира с помощью стандартной двухмерной ЭхоКГ. Визуализация осуществлялась из парастернального доступа по длинной оси левого желудочка (ориентиром служило аортальное кольцо). Толщину слоя эпикардиального жира измеряли в конце систолы за свободной стенкой правого желудочка.
Исследование проводилось при поступлении и выписке из стационара на фоне проводимой терапии, после чего динамику состояния больных оценивали клинически в течение шести месяцев.
Все больные получали стандартную терапию ХСН, включавшую ингибиторы ангиотензинпревращающего фермента (ИАПФ), бета-адреноблокаторы, спиронолактон, петлевые диуретики, при необходимости дигоксин.
Статистическая обработка результатов осуществлялась на персональном компьютере с помощью пакета прикладных программ SPSS version 21 и Microsoft Excel 2010. Определялись среднее значение (М) и стандартная ошибка среднего (m). Для сравнения средних значений зависимых выборок использовали критерий Уилкоксона, для сравнения независимых выборок – метод медиан, критерий Манна – Уитни. Количественные показатели представлены в виде М ± m (среднее значение ± стандартная ошибка среднего). Все параметры также оценивались с помощью корреляционного анализа с определением коэффициента корреляции (r). Критическим уровнем достоверности различий считался уровень 0,05.
Результаты и обсуждение
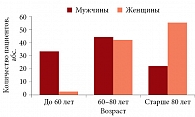
В исследовании участвовали 13 (17,6%) пациентов в возрасте до 60 лет, 32 (43,2%) – от 60 до 80 лет, 29 (39,2%) пациентов старше 80 лет. Средний возраст мужчин – 67,7 ± 13,8 года, женщин – 79,5 ± 7,9 года.
Пик заболеваемости ХСН приходился на пожилой и старческий возраст (у мужчин – от 60 до 80 лет, у женщин – старше 80 лет) (рис. 1).
При поступлении в стационар II ФК ХСН установлен в 19 (25,7%) случаях, III ФК – в 55 (74,3%).
Причиной ХСН у всех пациентов была ИБС. 18 (24,3%) больных перенесли инфаркт миокарда (ИМ), двое (2,7%) – дважды. Средний возраст больных с первым перенесенным ИМ составил 64,6 ± 11,4 года. 15 (20,3%) пациентов имели дегенеративные пороки сердца. Троим (4%) выполнена операция аортокоронарного и/или маммарно-коронарного шунтирования в связи с многососудистым поражением коронарного русла. У 41 (55,4%) пациента выявлена фибрилляция предсердий, у восьми (10,8%) из них – пароксизмальная форма, у 34 (45,9%) – постоянная. Острое нарушение мозгового кровообращения (ОНМК) перенесли восемь (10,8%) больных, в том числе двое (2,7%) – дважды.
В исходе госпитализации у 22 (29,7%) больных отмечалось улучшение (переход на фоне лечения в более низкий ФК по NYHA), у 46 (62,2%) пациентов – отсутствие динамики (сохранялся прежний ФК по NYHA). Летальный исход имел место в шести (8,1%) случаях.
Через шесть месяцев наблюдения у 33 (45,6%) больных отмечалось улучшение, у 35 (48,6%) – ухудшение. Общая полугодовая смертность составила 14,9%.
Участники исследования были разделены на две группы. В первую вошли 37 больных ХСН и МС, во вторую (контрольную) – 37 пациентов с ХСН без признаков МС.
Критерии включения в первую группу:
- возраст старше 18 лет;
- доказанная ХСН (клинические симптомы, объективный осмотр, ЭхоКГ);
- наличие абдоминального ожирения (объем талии у мужчин > 94 см, у женщин > 80 см).
Кроме того, в первую группу включались пациенты при наличии двух из следующих признаков:
- ТГ ≥ 1,7 ммоль/л;
- ЛПВП у мужчин < 1,0 ммоль/л, у женщин < 1,2 ммоль/л;
- ЛПНП > 3,0 ммоль/л;
- АД ≥ 130/85 мм рт. ст.;
- глюкоза натощак ≥ 6,1 ммоль/л;
- НТГ ≥ 7,8 ммоль/л и ≤ 11,1 ммоль/л.
Критерии включения во вторую группу:
- возраст старше 18 лет;
- доказанная ХСН (клинические симптомы, объективный осмотр, ЭхоКГ);
- отсутствие признаков метаболического синдрома.
Критерии невключения в исследование и исключения из него:
- острый инфаркт миокарда в течение одного месяца;
- острая хирургическая патология;
- инфекционный эндокардит;
- острый миокардит в течение одного месяца;
- хроническая обструктивная болезнь легких (ХОБЛ) в стадии обострения;
- бронхиальная астма в стадии обострения.
В первую группу вошли 21 (56,8%) мужчина и 16 (43,2%) женщин, во вторую – 15 (40,5%) мужчин и 22 (59,5%) женщины.
В первой группе восемь (21,6%) пациентов были младше 60 лет, 15 (40,5%) больных – в возрасте от 60 до 80 лет, 14 (37,8%) пациентов – старше 80 лет. Во второй группе также преобладали пациенты в возрасте от 60 до 80 лет – 17 (45,9%), больных старше 80 лет насчитывалось 15 (40,5%), пятеро (13,5%) были младше 60 лет.
Операция аортокоронарного шунтирования, по данным анамнеза, выполнена двум (5,4%) пациентам первой группы и одному (2,7%) – второй группы. В первой группе чаще, чем во второй, регистрировались дегенеративные пороки сердца – 86,5 и 73% соответственно. Частота фибрилляции предсердий в обеих группах была одинаковой (48,6% – во второй, 46,5% – в первой).
В первой группе ХСН клинически протекала тяжелее: более высокий ФК ХСН (III ФК – 89,2% в первой группе и 75,7% – во второй), в полтора раза чаще наблюдалась одышка в покое (21,6 и 16,2% соответственно), застойные явления в легких (54,1 и 40,5%), выраженные отеки нижних конечностей (78,4 и 73%), односторонний гидроторакс (30,6 и 24,3%), диффузный цианоз (18,9 и 10,8% соответственно).
В первой группе дебют гипертонической болезни, СД 2-го типа, ИБС, манифестация симптомов ХСН наступали раньше, чем в группе контроля (табл. 2). Больные первой группы чаще страдали АГ, СД 2-го типа. Частота перенесенного ОНМК определялась в обеих группах одинаково часто (10,8%). В первой группе чаще регистрировались повторные ОНМК.
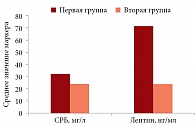
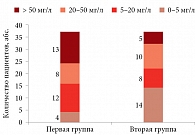
Повышенный уровень СРБ зафиксирован у 98% больных первой группы и 57% пациентов второй. Средние показатели в первой группе составили 32,97 ± 26,36 мг/л (рис. 2). При этом у 15 из 37 больных уровень белка превышал референсные значения (0–5 мг/л) в 10 раз и более и в отдельных случаях достигал 73,1–87,9 мг/л (рис. 3). У пациентов с II ФК средний уровень СРБ составил 24,44 ± 6,3 мг/л, с III ФК – 29,28 ± 4,11 мг/л (p > 0,05).
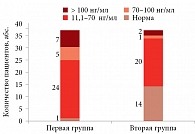
Уровень лептина – маркера ожирения, фиброза и воспаления был увеличен у всех больных ХСН и МС. У 30% пациентов показатели превышали референсные значения (2,0–5,6 нг/мл для мужчин, 3,7–11,1 нг/мл для женщин) в десятки раз. В 11 случаях данные показатели превышали 70 нг/мл, в семи – 100 нг/мл (рис. 4). У 15 больных первой группы уровень лептина не превышал референсных значений, большинство показателей находились в диапазоне 10–30 нг/мл. Средний уровень маркера в первой группе составил 69,46 ± 13,84 нг/мл, во второй – 23,44 ± 13,84 нг/мл (p < 0,01) (рис. 2). В целом у пациентов с III ФК уровни лептина почти в два раза превышали таковые у пациентов с II ФК (52,84 ± 10,24 и 27,96 ± 6,19 нг/мл соответственно).
При исследовании уровня апоА1 у 50% больных первой группы определялись пониженные показатели или близкие к нижней границе референсных значений (1,07–1,77 г/л – для мужчин, 1,07–2,05 г/л – для женщин). Во второй группе аналогичные показатели зафиксированы в 30% случаев.
Средний уровень апоА1 в первой группе составил 1,23 ± 0,05 г/л, во второй – 1,51 ± 0,28 г/л (p > 0,05). Разница значений маркера у пациентов с II и III ФК оказалась недостоверной.
Показатели апоВ у большинства больных обеих групп находились в пределах референсных значений (0,6–1,38 г/л – для мужчин, 0,52–1,29 г/л – для женщин). У восьми больных первой группы и пяти пациентов второй группы уровень апоВ был повышен. Средние показатели у больных ХСН с МС составили 1,21 ± 0,07 г/л, во второй – 0,94 ± 0,05 г/л (p > 0,05). Достоверных различий апоВ у пациентов с II и III ФК ХСН не установлено.
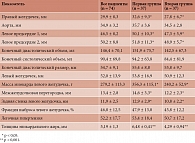
По данным ЭхоКГ, у больных обеих групп отмечалась дилатация левых отделов сердца. У пациентов первой группы выявлена более выраженная дилатация правого желудочка, что могло быть обусловлено развитием легочной гипертензии на фоне ожирения при МС помимо поражения дистальных отделов коронарных артерий (табл. 3).
Отмечалась прямая корреляционная связь толщины эпикардиального жира (ТЭЖ) с массой миокарда левого желудочка и размерами правого желудочка (р < 0,05).
У больных ХСН и МС при корреляционном анализе выявлены прямые корреляционные связи показателей лептина с уровнем СРБ (r = 0,371; p < 0,01), массой миокарда левого желудочка (r = 0,68; p < 0,05), ТЭЖ (r = 0,546; p < 0,05), обратные – с фракцией выброса левого желудочка (r = 0,264; p < 0,05), достоверная обратная корреляционная связь апоА1 и СРБ (r = 0,239; p < 0,05).
В исходе госпитализации больные первой группы (62,2%) чаще, чем пациенты второй группы (59,9%), выписывались без существенного улучшения. Госпитальная летальность в первой группе составила 10,8% (четыре случая), во второй – 8,1% (три случая). Через шесть месяцев наблюдения у 43,2% больных первой группы и 40,5% пациентов второй отмечались клиническое ухудшение течения ХСН, нарастание ФК ХСН. Летальность через шесть месяцев наблюдения в первой группе составила 16,2% (шесть случаев), во второй – 13,5% (пять случаев).
Заключение
Как показали результаты исследования, у пациентов с метаболическим синдромом хроническая сердечная недостаточность отличается более ранним развитием и тяжелым течением. При проведении ЭхоКГ отмечаются значительное увеличение размеров камер сердца, толщины миокарда левого и правого желудочков, легочной гипертензии. Степень морфофункциональных изменений по ряду параметров превышает таковые у больных ХСН без МС. ТЭЖ ассоциируется с увеличением массы миокарда левого желудочка. Взаимосвязь воспалительных и дисметаболических процессов, вызывающих системные и локальные изменения, с высоким уровнем СРБ, закономерным значительным увеличением синтеза лептина жировой тканью, оказывающих провоспалительный эффект и поддерживающих процессы гипертрофии и фиброза в миокарде, нарушением липидного обмена, в частности соотношения аполипротеинов, приобретает патогенетическое значение и играет важную роль в развитии и прогрессировании ХСН у больных МС.
Авторы заявляют об отсутствии конфликта интересов.
T.A. Fyodorova, Ye.A. Ivanova, N.A. Semenenko, A.P. Roitman, S.Ya. Tazina, N.V. Loshchits, M.K. Rybakova
I.M. Sechenov First Moscow State Medical University
Russian Medical Academy for Continuing Professional Education
Botkin City Clinical Hospital
Contact person: Yevgeniya A. Ivanova, ivanova_evgand@mail.ru
Chronic heart failure (CHF) is a major medical and social problem. The increase of morbidity results from both an increase of life expectancy of the population, and influence of various risk factors contributing to development and increase of heart failure. The combination of several atherogenic mechanisms (abdominal obesity, insulin resistance, arterial hypertension, hyperglycemia, dyslipidemia), combined as ‘metabolic syndrome’ (MS), causes a more rapid development of CHF.
Material and methods. The research finding of 74 patients with class II–III of CHF, including 37 patients (50%) with MS, are presented. The age structure of the pathology, severity of clinical course, data of laboratory and instrumental examination in various groups of patients were evaluated. A special program included an echocardiographic test with an assessment of various myocardial parameters.
Results and discussion. Research materials find out a number of characteristics of CHF clinical course (its earlier development and severe course) in patients with MS. Echocardiographic tests reveal an increase of heart chambers sizes, thickness of left and right ventricle, pulmonary hypertension. Myocardium morpho-functional changes are more significant in patients with CHF and MS than in those without MS. An increase in leptin levels, a marker of obesity, fibrosis and inflammation, has been found. Leptin and CRP in patients with MS significantly exceeded those in patients with CHF. An apolipoproteins imbalance with a tendency to apoA1 decrease and an apoB increase in patients with CHF and MS was noted. Correlations of leptin levels, CRP, apolipoproteins and left ventricular mass, thickness of epicardial fat, ejection fraction were established.
Conclusion. Materials of the research indicate the important role of inflammatory and dysmetabolic processes in development and progression of CHF in patients with MS.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


