Успешное применение комбинации иммунотерапии пембролизумабом и химиотерапии препаратом платины и пеметрекседом в качестве первой линии у пациента с метастатическим неплоскоклеточным немелкоклеточным раком легкого
- Аннотация
- Статья
- Ссылки
- English
Введение
По заболеваемости рак легкого занимает первое место среди других злокачественных опухолей у мужчин в России, а по смертности – первое место среди мужчин и женщин как в России, так и в мире. В 2019 г. выявлено 49 145 случаев рака легкого, в Сибирском федеральном округе – 7020, Иркутской области – 991 новый случай. В большинстве случаев заболевание диагностировано на III–IV стадии. В Иркутской области у 50,4% пациентов рак легкого обнаружен на IV стадии. Практически половина таких больных умирает в течение первого года [1, 2].
До 80% пациентов с немелкоклеточным раком легкого (НМРЛ) не имеют драйверных мутаций. До недавнего времени основным методом лечения именно этой группы пациентов оставалась химиотерапия. Но частота объективного ответа на нее в первой линии не превышает 30%, а медиана общей выживаемости (ОВ), по разным данным, не превышает одного года. Кроме того, химиотерапия сопровождается развитием множества побочных эффектов, что в ряде случаев приводит к нарушению сроков лечения или досрочному завершению терапии и, как следствие, ухудшению прогноза заболевания [3, 4].
Появление в клинической практике ингибиторов контрольных точек иммунитета стало настоящим прорывом в лечении больных метастатическим НМРЛ. В основе механизма действия этих препаратов лежит блокирование взаимодействия рецептора программируемой клеточной гибели PD-1 на мембране активированных T-лимфоцитов и лигандов программируемой клеточной гибели PD-L1/PD-L2 на опухолевых клетках. Высокая экспрессия PD-L1/PD-L2 используется опухолью для блокирования иммунного ответа [5]. Монотерапия пембролизумабом в случае высокой экспрессии PD-L1 (не менее 50%) сегодня является традиционной опцией выбора и позволяет достигать 23% трехлетней безрецидивной выживаемости и 32% пятилетней ОВ у больных метастатическим НМРЛ [6]. Тем не менее высокая экспрессия PD-L1 ограничивает контингент больных, которым показана монотерапия пембролизумабом. Решением проблемы селективности моноиммунотерапии стало использование комбинированных режимов химиоиммунотерапии. Эффективность одной из таких комбинаций оценивали в многоцентровом двойном слепом рандомизированном плацебоконтролируемом исследовании фазы III KEYNOTE-189. Преимущество от включения пембролизумаба в схему лечения отмечалось во всех подгруппах пациентов независимо от возраста, пола, статуса по шкале ECOG, курения, наличия метастазов в головном мозге, используемого производного платины, а также экспрессии PD-L1 [7].
Клинический случай
Пациент А., 60 лет, инженер, профессиональные вредности отсутствуют. Курение в течение 40 лет по одной пачке сигарет в день. В феврале 2019 г. появились непродуктивный кашель, одышка при физической нагрузке, постепенное снижение маcсы тела. За медицинской помощью обратился в августе 2019 г. после обнаружения прожилок крови в мокроте. В лечебно-профилактическом учреждении по месту жительства выявлена опухоль легкого. Пациента направили в Иркутский областной онкологический диспансер (ИООД).
На момент обращения больной отмечал общую слабость, утомляемость, потливость, непродуктивный кашель в течение дня, одышку при подъеме на второй этаж. Состояние по шкале ECOG – 1 балл, по шкале Карновского – 90%. В ИООД проведено комплексное обследование.
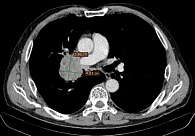
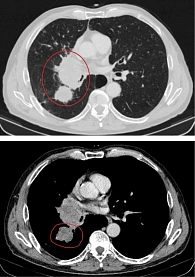
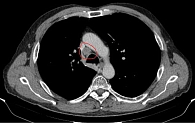
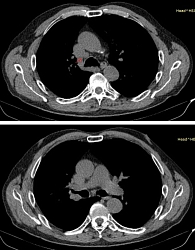
Данные мультиспиральной компьютерной томографии (МСКТ): в корне правого легкого образование неправильной формы (рис. 1) до 58 мм в диаметре с неровными бугристыми нечеткими контурами, солидной структуры, интенсивно и неоднородно накапливающее контраст. Полностью обтурирован среднедолевой бронх, деформирован и сдавлен просвет дистального отдела главного бронха. Сдавлена дистальная часть ствола правой легочной артерии в толще образования. В S6 еще два образования, аналогичные по структуре и накоплению контраста, размерами 31 и 13 мм (рис. 2). Увеличен передний паратрахеальный лимфоузел до 20 мм (рис. 3). В проекции левого надпочечника забрюшинно определяется образование в виде эллипсоида с неровными, нечеткими контурами с неоднородной, мягкотканной структурой размерами 124 × 93 × 160 мм.
По данным эндоскопического исследования, промежуточный бронх правого легкого стенозирован инфильтрирующей опухолью, распространяющейся на устье верхнедолевого бронха и правый главный бронх с верхней границей на расстоянии менее 1 см от карины бифуркации трахеи. Выполнена биопсия опухоли в промежуточном бронхе правого легкого. При микроскопическом исследовании – фрагменты слизистой бронхиального типа с инфильтративным ростом немелкоклеточной карциномы. Активирующих мутаций EGFR, ALK, ROS1 в опухоли не обнаружено.
По результатам иммуногистохимического исследования с использованием антител PD-L1 клон DAKO 22C3, было выявлено до 30% окрашенных опухолевых клеток.
На основании данных обследования установлен диагноз: рак правого легкого, Т3N2М1б, стадия IV. Метастатическое поражение левого надпочечника. На консилиуме ИООД было принято решение о назначении больному пембролизумаба в комбинации с цисплатином и пеметрекседом, в соответствии с клиническими рекомендациями Ассоциации онкологов России, с оценкой эффекта после четырех циклов.
Больной перенес лечение удовлетворительно. Нежелательных явлений 3–4-й степени по СТС АЕ не зафиксировано. Клинически достигнута положительная динамика, полностью купирована одышка, прекратился кашель.
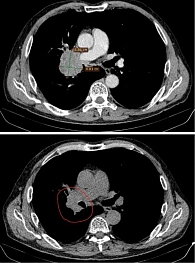
По данным контрольной МСКТ после четырех циклов терапии, достигнут частичный ответ опухоли с уменьшением размеров до 42%. Кроме того, отмечались уменьшение размеров опухоли в корне правого легкого, регресс метастатического образования в S6 правого легкого (рис. 4), уменьшение размеров метастаза нижнего правого паратрахеального лимфоузла до 10 мм (-7 мм). Средняя доля правого легкого расправилась. Размеры опухоли левого надпочечника уменьшились до 85 мм в наибольшем измерении.
В настоящее время продолжается терапия по схеме: пембролизумаб 200 мг в первый день, пеметрексед 500 мг/м² в первый день, цикл – 21 день. Выполнено 18 введений. Клинически и рентгенологически достигнут стойкий частичный ответ (рис. 5).
Контрольная МСКТ (август 2020 г., спустя год от начала лечения) показала положительную динамику. Уменьшились размеры опухоли в корне правого легкого, а также размеры опухоли левого надпочечника – до 61 мм в наибольшем измерении (-24 мм).
Состояние пациента по ECOG – 0 баллов. Нежелательных явлений не зарегистрировано.
Таким образом, у пожилого больного на фоне длительного приема пембролизумаба в комбинации с химиотерапией наблюдалось прогредиентное уменьшение размеров опухолевых образований. Терапия не прерывалась в связи с нежелательными явлениями, и лечение протекает на фоне сохранения высокого уровня качества жизни пациента.
Обсуждение
Длительное время стандартом лекарственной терапии первой линии больных метастатическим НМРЛ, кроме случаев с наличием активирующих мутаций (EGFR, ALK, ROS1), считались платиносодержащие режимы, характеризующиеся низкой эффективностью: медиана ОВ – в пределах 8–13 месяцев, медиана выживаемости без прогрессирования (ВБП) – 4–7 месяцев [8, 9].
Иммунотерапия представляет собой принципиально новый подход к лечению больных раком легкого, позволяющий значительно увеличить показатели выживаемости при диссеминированном НМРЛ. Регистрация пембролизумаба в качестве стандарта лечения позволила расширить возможности терапии пациентов с распространенным НМРЛ [10–13].
Первым исследованием, в котором была продемонстрирована эффективность пембролизумаба в монотерапии у больных НМРЛ, стало исследование фазы I KEYNOTE-001 [14] с участием более тысячи больных метастатической меланомой и НМРЛ. Это исследование до сегодняшнего дня остается самым большим исследованием фазы I в истории онкологии. Результаты исследования продемонстрировали очевидное предиктивное значение PD-L1, уровень экспрессии которого на мембране опухолевых клеток положительно коррелировал с вероятностью ответа на иммунотерапию как в первой, так и в последующих линиях. Однако результаты, полученные в исследовании фазы I, требовали подтверждения. В исследовании фазы III KEYNOTE-024, в котором участвовали 305 пациентов, пембролизумаб продемонстрировал значительное преимущество перед стандартной химиотерапией у пациентов с ранее не леченным метастатическим НМРЛ с высоким уровнем экспрессии PD-L1 (≥ 50%). В настоящее время доступны данные за пятилетний период наблюдения [15]. Согласно обновленным результатам, пятилетняя ОВ в группе пембролизумаба составила 31,9%, статистически значимо превысив выживаемость в контрольной группе. Трехлетняя ВБП достигла 22,8 и 4,1% соответственно. При этом 39 из 154 пациентов группы пембролизумаба завершили двухлетний курс терапии, предусмотренный дизайном исследования, а 31 пациент жив в течение трех лет после окончания терапии без последующего лечения.
Регистрация в 2019 г. еще одного монотерапевтического режима пембролизумаба при положительной экспрессии PD-L1 (не менее 1%) расширила возможности иммунотерапии, в частности, у больных, которым противопоказана химиотерапия [16]. Необходимо отметить, что при низкой экспрессии PD-L1 1–49% монотерапия не обеспечивает такого выраженного эффекта, как в комбинации с химиотерапией, и может использоваться только как исключительная опция. В нашем клиническом случае выбор в пользу комбинированной химиоиммунотерапии у больного с низкой положительной экспрессией PD-L1 был обусловлен распространенностью заболевания и соматическим состоянием пациента, тяжесть которого объяснялась основным заболеванием, а не сопутствующей патологией.
Вместе с тем не всем больным пембролизумаб показан в монорежиме, поскольку высокая экспрессия PD-L1 наблюдается не более чем у 25% пациентов. Для большинства больных метастатическим НМРЛ доступна опция комбинированной химиоиммунотерапии. В частности, эффективность комбинированного режима (пембролизумаб или плацебо в комбинации с пеметрекседом и препаратами платины в первой линии терапии неплоскоклеточного НМРЛ) оценивали в многоцентровом двойном слепом рандомизированном плацебоконтролируемом исследовании фазы III KEYNOTE-189 [7, 17].
В исследование было включено 616 пациентов независимо от уровня экспрессии PD-L1. Больные получали четыре цикла пембролизумаба в фиксированной дозе 200 мг либо плацебо в комбинации с препаратом платины (цисплатином или карбоплатином) и пеметрекседом каждые три недели с последующей терапией пембролизумабом либо плацебо (в течение двух лет либо до прогрессирования/развития неприемлемой токсичности). При прогрессировании разрешался кроссовер, и пациенты контрольной группы переходили на монотерапию пембролизумабом во второй линии. При медиане времени наблюдения 23,1 месяца медиана ОВ в группе пембролизумаба и химиотерапии не была достигнута. В группе химиотерапии медиана ОВ составила 22 месяца, а двухлетняя ОВ независимо от уровня экспрессии PD-L1 – 45,5% [18].
В данном клиническом наблюдении больной без признаков прогрессирования получает соответствующее лечение уже в течение года, и этот опыт подтверждает эффективность терапии, полученную в исследовании: одногодичная ВБП независимо от PD-L1 – 20,5%. В то же время в контрольной группе прогрессирование в течение года отмечалось у 98,5% больных. Важно также, что выбор комбинированной химиоиммунотерапии в первой линии обоснован результатами анализа ВБП2 – показателя, характеризующего время до повторного прогрессирования заболевания при последовательном назначении двух линий терапии. Результаты ВБП2, продемонстрированные в исследовании KEYNOTE-189, крайне актуальны и, на наш взгляд, показательны для данного больного, поскольку позитивный уровень экспрессии PD-L1 позволил бы назначить пембролизумаб во второй линии терапии, ограничившись в первой линии стандартной схемой на основе платиносодержащих агентов. Подобный сценарий был предусмотрен в KEYNOTE-189 в силу возможности кроссовера, частота которого (с учетом больных, получавших иммунотерапию во второй линии вне исследования) составила 53,9%.
Двухлетняя ВБП2 в группе пембролизумаба достигла 38,4% и в два с половиной раза превысила аналогичный показатель в контрольной группе (не более 14%). Подобные статистически значимые отличия (относительный риск (ОР) 0,49; 95%-ный доверительный интервал (ДИ) 0,4–0,59), безусловно, свидетельствуют в пользу выбора наиболее эффективной схемы терапии в первой линии.
Несмотря на достаточно высокую частоту нежелательных явлений 3–4-й степени как в исследуемой, так и в контрольной группе (71,9 и 66,8% соответственно), в данном клиническом наблюдении не зарегистрировано нежелательных явлений, равно как и эпизодов прерывания терапии.
Результаты исследований иммунотерапии больных метастатическим НМРЛ свидетельствуют о значительном увеличении продолжительности жизни пациентов, ранее считавшихся инкурабельными. В связи с этим принципиальное значение приобретает вопрос сохранения качества жизни на фоне лечения. Согласно данным опросников качества жизни больных в KEYNOTE-189, медиана времени до ухудшения таких симптомов заболевания, как кашель, боль в груди или одышка, не была достигнута (95% ДИ 10,2 месяца – НД) в группе пембролизумаба и составила семь месяцев в группе плацебо (ОР 0,81; 95% ДИ 0,60–1,09; p = 0,16), хотя эти отличия не были статистически значимы [16]. В данном клиническом наблюдении у больного с первоначальным соматическим статусом 1 по шкале ECOG отмечалось улучшение общего состояния до ECOG 0.
Заключение
С началом эры иммунотерапии в современной онкологии расширились возможности лечения пациентов с НМРЛ. Иммунотерапия пембролизумабом обеспечивает адекватный выбор режима терапии в зависимости от уровня экспрессии PD-L1 либо в пользу монотерапии, либо в пользу комбинации с химиотерапевтическими агентами. Результаты клинических исследований и собственный опыт позволяют рекомендовать наиболее эффективные терапевтические режимы в первой линии больным метастатическим раком легкого, что обеспечивает не только длительный терапевтический эффект, но и высокое качество их жизни.
S.S. Sidorova, D.Yu. Yukalchuk, D.M. Ponomarenko, D.A. Bogomolov, I.D. Klimova, Ye.V. Seredkin
Irkutsk Regional Oncological Dispensary
Contact person: Svetlana S. Sidorova, s_koninina@mail.ru
The article presents the case of successful use of the combination of pembrolizumab with pemetrexed and cisplatin in first-line therapy in a patient with metastatic non-squamous cell non-small cell lung cancer.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.