количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Комбинированная пероральная сахароснижающая терапия в современной стратегии лечения сахарного диабета 2 типа
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №5 (48)
- Аннотация
- Статья
- Ссылки
- English
В обзорной статье описаны современные подходы к выбору сахароснижающей терапии у пациентов с впервые диагностированным сахарным диабетом 2 типа согласно рекомендациям Международной диабетической федерации (IDF) 2012 г. и Российского общества эндокринологов 2013 г. Акцент сделан на выборе оптимальной комбинации пероральных сахароснижающих препаратов.
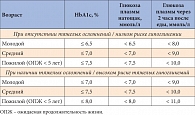
Таблица 1. Индивидуальные цели лечения (критерии контроля) СД
![Рис. 1. Алгоритм лечения СД 2 типа IDF 2012 г. (адаптировано по [27])](/upload/resize_cache/iblock/5d9/195_350_1/5d9f7945f4d5a496773793509a0d7fe1.jpg)
Рис. 1. Алгоритм лечения СД 2 типа IDF 2012 г. (адаптировано по [27])
![Таблица 2. Клиническая эффективность различных классов пероральных сахароснижающих препаратов [33]](/upload/resize_cache/iblock/3a1/195_350_1/3a1db2c6e5f6fecc374189700846af14.jpg)
Таблица 2. Клиническая эффективность различных классов пероральных сахароснижающих препаратов [33]
![Рис. 2. Алгоритм контроля гликемии у больных СД 2 типа с исходным уровнем HbA1c 6,5–7,5%, РАЭ 2013 (адаптировано по [15])](/upload/resize_cache/iblock/cc6/195_350_1/cc678637681371dffe4ce5260a8ab5a9.jpg)
Рис. 2. Алгоритм контроля гликемии у больных СД 2 типа с исходным уровнем HbA1c 6,5–7,5%, РАЭ 2013 (адаптировано по [15])
![Рис. 3. Алгоритм контроля гликемии у больных СД 2 типа с исходным уровнем HbA1c 7,6–9,0%, РАЭ 2013 (адаптировано по [15])](/upload/resize_cache/iblock/139/195_350_1/1399275109a807570ff54681a4f3aa3a.jpg)
Рис. 3. Алгоритм контроля гликемии у больных СД 2 типа с исходным уровнем HbA1c 7,6–9,0%, РАЭ 2013 (адаптировано по [15])
![Рис. 4. Алгоритм контроля гликемии у больных СД 2 типа с исходным уровнем HbA1c > 9,0%, РАЭ 2013 (адаптировано по [15])](/upload/resize_cache/iblock/e98/195_350_1/e98630e6e7ed7b393fd6e7c0cecb04c5.jpg)
Рис. 4. Алгоритм контроля гликемии у больных СД 2 типа с исходным уровнем HbA1c > 9,0%, РАЭ 2013 (адаптировано по [15])
Рост распространенности сахарного диабета (СД) 2 типа в мире превосходит все прогнозы. Если 15 лет назад эксперты Всемирной организации здравоохранения (ВОЗ) предполагали, что к 2025 г. количество больных СД в мире будет равняться 380 млн [1], то, по данным Международной диабетической федерации (International Diabetes Federation, IDF), в 2011 г. их численность уже достигла 366 млн, а в соответствии с новым прогнозом ВОЗ к 2030 г. составит 552 млн человек [2]. Продолжительность жизни больных СД 2 типа в среднем на 5 лет меньше, чем в общей популяции. Это в первую очередь обусловлено быстрым прогрессированием атеросклероза, который повышает смертность лиц с СД 2 типа от сердечно-сосудистых заболеваний в 4–5 раз [3]. В целом от ассоциированных с атеросклерозом заболеваний умирает больше больных СД, чем от всех других причин, вместе взятых [4]. Считается, что такое выраженное поражение сосудистого русла вызывается гипергликемией. Метаанализ 20 исследований с участием 95 783 пациентов (период наблюдения составил 12 лет) позволил сделать вывод о том, что повышенный уровень глюкозы крови является таким же фактором риска развития атеросклероза и сердечно-сосудистых событий, как и повышенный уровень общего холестерина и артериального давления [5].
В серии крупных рандомизированных исследований [6–10] доказано большое значение жесткого контроля гликемии в снижении риска развития сердечно-сосудистых осложнений СД, что требует применения сразу после диагностики заболевания агрессивной тактики лечения пациентов с СД 2 типа с использованием эффективных и безопасных сахароснижающих препаратов и их комбинаций, позволяющих достичь целевого уровня гликемии. Длительные наблюдения показали, что такой терапевтический подход позволяет предупредить быстрое прогрессирование атеросклероза [11, 12].
Однако интенсификация сахароснижающей терапии ограничивается риском развития гипогликемических состояний, увеличения массы тела и, как следствие, повышением смертности от острых сосудистых катастроф. В ходе исследования AСCORD (Action to Control Cardiovascular Risk in Diabetes – Действия по контролю сердечно-сосудистого риска у пациентов с сахарным диабетом) в группе интенсивного лечения эпизоды гипогликемии выявляли в 3 раза чаще по сравнению с группой стандартной терапии [13], а в исследовании VADT (Veterans Affairs Diabetes Trial – Исследование сахарного диабета у ветеранов войн США) – в 2 раза чаще [14], что сопровождалось увеличением общей летальности на 22% в исследовании АССORD и повышением числа сердечно-сосудистых событий в последующие 3 месяца после тяжелой гипогликемии у пожилых людей в исследовании VADT.
В связи с вышеизложенным Российская ассоциация эндокринологов (РАЭ) в конце 2011 г. предложила индивидуализировать целевые уровни гликемического контроля [15] в зависимости от возраста пациента, ожидаемой продолжительности жизни (ОПЖ), риска развития гипогликемических состояний и наличия или отсутствия тяжелых сердечно-сосудистых осложнений (табл. 1).
СД 2 типа характеризуется двумя основными патогенетическими дефектами: снижением чувствительности к инсулину, или инсулинорезистентностью (ИР), и неадекватной секрецией инсулина для преодоления барьера ИР. Инсулинорезистентность зачастую в течение многих лет предшествует развитию СД 2 типа и обычно является генетически обусловленной, хотя и усугубляется такими факторами, как ожирение, снижение физической активности, беременность и избыток контринсулярных гормонов. Изначально ИР компенсируется за счет гиперинсулинемии, что поддерживает нормальную толерантность к углеводам. Нарушение толерантности к углеводам наблюдается при возрастании тяжести ИР или при снижении компенсаторных возможностей инсулиновой секреции, либо при прогрессировании обоих дефектов [16, 17]. По современным представлениям, СД 2 типа манифестирует, когда секреторная функция бета-клеток истощается, то есть бета-клетки становятся не способны поддерживать достаточно высокий уровень секреции инсулина, чтобы преодолеть барьер ИР. Основная роль в этой несостоятельности инсулярного аппарата отводится генетическим нарушениям [17], однако немаловажное значение в снижении секреторных резервов инсулярного аппарата имеет так называемый феномен глюкозотоксичности, за счет которого развиваются апоптоз и гибель бета-клеток. По статистическим данным, к моменту манифестации заболевания у пациентов функционируют только 50% бета-клеток, что подтверждает теорию постепенного прогрессирования нарушений углеводного обмена: от нормогликемии в условиях ИР и гиперинсулинемии до манифестации СД 2 типа через последовательные стадии нарушения гликемии натощак и нарушенную толерантность к глюкозе [18].
На основании вышеизложенного напрашивается вполне логичный вывод о том, что основным стратегическим направлением в лечении СД 2 типа должно быть воздействие на ИР как главное патогенетическое звено в развитии заболевания. Снижая ИР, или, иными словами, повышая чувствительность к инсулину, мы уменьшаем нагрузку на инсулярный аппарат, сохраняя тем самым его секреторные возможности и снижая негативное влияние гиперинсулинемии на повышение аппетита, увеличение массы тела, состояние сердечно-сосудистой системы. Самый простой способ повышения чувствительности к инсулину – уменьшение массы тела путем изменения образа жизни и характера питания. Однако на практике эти меры позволяют достичь целевого уровня гликемии менее чем у 30% пациентов с впервые выявленным СД 2 типа [6]. Таким образом, большинству пациентов необходима медикаментозная терапия, воздействующая на основное патогенетическое звено заболевания – ИР.
Выбор сахароснижающей терапии согласно алгоритму IDF (2012)
Первая линия терапии
Наиболее доступным и эффективным лекарственным средством на сегодняшний день является метформин. Основной механизм действия метформина направлен на снижение ИР за счет повышения активности тирозинкиназы инсулинового рецептора в периферических тканях, вследствие чего улучшается периферическая утилизация и окисление глюкозы [19, 20], подавляется липолиз и окисление свободных жирных кислот как альтернативного энергосубстрата [21, 22]. Именно с повышением чувствительности ткани печени к инсулину связывают снижение активности процессов глюконеогенеза и гликогенолиза [23, 24]. Таким образом, сахароснижающий эффект метформина является не столько гипогликемическим, сколько антигипергликемическим, так как приводит к уменьшению продукции глюкозы печенью и уровня гликемии натощак. С повышением чувствительности периферических тканей к инсулину связывают и снижение потребности в инсулине, и улучшение функциональных возможностей бета-клеток в связи с уменьшением глюкозотоксичности [25]. Кроме того, как показали недавние исследования, метформин может способствовать повышению уровня глюкагоноподобного пептида 1 (ГПП-1), стимулирующего, как известно, секрецию инсулина за счет улучшения абсорбции глюкозы в дистальных отделах тонкой кишки, где в основном и локализованы L-клетки, секретирующие ГПП-1 [26].
В случае непереносимости метформина или при наличии противопоказаний у пациентов, не имеющих избыточной массы тела, возможно применение препаратов сульфонилмочевины (ПСМ) в качестве первой линии лечения, исходя из предположения о том, что основным патогенетическим дефектом в развитии СД 2 типа без ожирения является неадекватная секреция инсулина. Данный вариант начала медикаментозного лечения не только патогенетически обоснован, но и имеет достаточную доказательную базу в отношении эффективности и безопасности применения ПСМ, а также отличается относительной дешевизной и доступностью.
Как указывалось выше, у большинства больных СД 2 типа мероприятия по изменению образа жизни не обеспечивают достижения целевых параметров углеводного обмена либо из-за недостаточного снижения или повторного увеличения массы тела, либо из-за прогрессирования заболевания, а также вследствие сочетания перечисленных и ряда других факторов. Именно поэтому начинать терапию метформином рекомендуется вместе с изменением образа жизни сразу после установления диагноза [27]. В отсутствие противопоказаний метформин необходимо назначать в первую очередь, благодаря его влиянию на снижение гипергликемии, отсутствию на фоне его применения увеличения массы тела и гипогликемических состояний, обычно хорошему профилю переносимости с низкой частотой побочных эффектов, высокой приверженности пациентов лечению и относительно низкой стоимости. Доза метформина должна быть постепенно (в течение одного-двух месяцев) увеличена до максимально эффективной и переносимой.
Вторая линия терапии
Однако даже максимальные терапевтические дозы метформина далеко не всегда позволяют добиться целевого уровня гликемии и снижения показателя HbA1c до < 7,0% в течение первых двух-трех месяцев терапии, как рекомендовано в алгоритме лечения больных СД 2 типа IDF 2012 г. [27]. При сохранении упорной гипергликемии следует быстро решить вопрос о добавлении к схеме терапии других сахароснижающих препаратов. Консенсуса в отношении препарата, добавляемого к метформину, пока нет – следует сделать выбор между ПСМ и ингибитором дипептидилпептидазы-4 (иДПП-4) или тиазолидиндионом (ТЗД) и блокатором альфа-глюкозидазы (альтернативный подход) (рис. 1). В частности, когда риск гипогликемии особенно высок (например, у пациентов, занимающихся тяжелым физическим трудом), целесообразно дополнительное назначение иДПП-4 либо препарата класса ТЗД – пиоглитазона (Актос). В случаях, когда одна из основных целей лечения – снижение массы тела, а уровень HbA1c < 8,0%, предпочтительно назначение блокаторов альфа-глюкозидазы (акарбоза, препарат Глюкобай).
При невозможности достижения целевого уровня гликемического контроля с помощью ПСМ в качестве второй линии терапии предлагается применение метформина, если он не был назначен ранее, либо иДПП-4, или ТЗД, или ингибиторов альфа-глюкозидазы (в качестве альтернативного варианта).
Третья линия терапии
Если изменение образа жизни, лечение метформином и добавление к терапии второго препарата не способствовали достижению целевых параметров контроля углеводного обмена, начинают инсулинотерапию (см. рис. 1). В случае если уровень HbА1с близок к целевому (< 8,0%), вместо инсулинотерапии можно добавить третий пероральный сахароснижающий препарат. В качестве дополнительного сахароснижающего средства алгоритм IDF предусматривает либо блокаторы альфа-глюкозидазы, или иДПП-4, или ТЗД, либо, в качестве альтернативного варианта, агонисты ГПП-1 (эксенатид, лираглутид), когда одна из основных целей лечения – снижение массы тела, а уровень HbA1c < 8,0% [27]. Такой подход более дорогостоящий и не всегда оказывается эффективным по сравнению с переходом на инсулинотерапию или ее интенсификацией.
Четвертая линия терапии
Интенсивная инсулинотерапия обычно заключается во введении дополнительных инъекций инсулина короткого или ультракороткого действия перед отдельными приемами пищи для уменьшения постпрандиальных колебаний гликемии (см. рис. 1). При переходе на интенсивную инсулинотерапию с инъекциями инсулина короткого или быстрого действия следует отменить секретогены инсулина (ПСМ или глиниды), поскольку они действуют синергично с вводимым инсулином.
Стратификация лечебной тактики по алгоритму РАЭ (2013)
Эндокринологи-клиницисты нередко сталкиваются с ситуацией, когда добиться целевого уровня контроля гликемии в течение двух-трех месяцев лечения больного невозможно, что связано с сильными колебаниями исходного уровня HbA1c у пациентов – от 6,5 до 10% и выше. В связи с этим в конце 2011 г. эксперты РАЭ предложили дифференцированный подход к назначению и коррекции сахароснижающей терапии в зависимости от исходного уровня HbA1c с последующим изменением лечения при недостижении цели не ранее чем через 6 месяцев от начала проводимой терапии.
Тактика ведения пациентов с исходным уровнем HbА1с от 6,5 до 7,5%
Если уровень HbA1c не превышает 7,5%, вполне реально достичь целевого значения ниже 6,5% на фоне монотерапии метформином, пиоглитазоном, иДПП-4 или альфа-глюкозидазой, как это представлено на рис. 2. Двойная комбинация при неэффективности монотерапии предполагает добавление препаратов, влияющих на секрецию инсулина вследствие либо стимуляции секреторной функции бета-клеток (ПСМ, глиниды и аналоги ГПП-1), либо блокады расщепления нативного ГПП-1 ингибиторами фермента ДПП-4. В любом случае такая комбинация воздействует на оба патогенетических звена развития СД 2 типа: ИР и неадекватную секрецию инсулина, в результате чего обеспечивается адекватный гликемический контроль не только по параметру «уровень гликемии натощак», но и по показателю «уровень постпрандиальной гликемии», что и приводит к быстрому достижению терапевтической цели.
Возникает вопрос, какая комбинация предпочтительнее у пациентов с исходным уровнем HbA1c от 6,5 до 7,5%. Если брать за основу критерии переносимости и безопасности, то возможный риск гипогликемии при применении секретогенов у больных с исходно невысоким уровнем HbA1c превышает выраженность побочных эффектов со стороны желудочно-кишечного тракта и отечного синдрома, связанных с применением инкретинов и ТЗД соответственно. Именно поэтому авторы алгоритма РАЭ 2013 г. предлагают в качестве наиболее рациональных комбинаций в первую очередь сочетание метформина с иДПП-4 или аналогами ГПП-1, а во вторую – метформина с секретогенами (ПСМ или глинидами). Если изменение образа жизни, применение метформина и второго препарата не способствовали достижению целевых параметров контроля углеводного обмена, на следующем этапе начинают или интенсифицируют инсулинотерапию (рис. 2). Если уровень HbА1с близок к целевому (< 7,5%), можно добавить третий пероральный сахароснижающий препарат. Однако такой подход более дорогостоящий и не всегда оказывается эффективным по сравнению с переходом на инсулинотерапию или ее интенсификацией [28].
Тактика ведения пациентов с исходным уровнем HbА1с от 7,6 до 9%
Подавляющее большинство пациентов с СД 2 типа имеют на момент диагностики заболевания уровень HbА1с > 7,6%. При таком повышении показателя HbА1с на сегодняшний день не существует препаратов, которые бы были способны обеспечить достижение целевого уровня контроля при монотерапии в течение двух-трех месяцев (табл. 2).
Именно поэтому авторы алгоритма РАЭ 2013 г. предлагают изначально использовать комбинированную «двойную» терапию для достижения быстрого и эффективного контроля гликемии (рис. 3). Такой подход основан на данных многочисленных исследований, показавших, что одновременное назначение препаратов с разными точками приложения действия обеспечивает более значимое снижение HbА1с не только за более короткие сроки, но и в значительно меньших дозировках, нежели начальная монотерапия метформином с последующим добавлением второго препарата [29–31]. Метформин является основой всех возможных комбинаций, из которых наиболее безопасная – сочетание метформина с инкретиновыми миметиками (благодаря отсутствию риска гипогликемических состояний и увеличения массы тела), а самая эффективная – сочетание метформина с ПСМ (поскольку обеспечивает хороший контроль не только гликемии, но и уровня холестерина и липидного спектра крови) [31].
В случае неэффективности «двойной» терапии рекомендуется добавить третий препарат. Руководствуясь принципами эффективности и безопасности, и в этой ситуации метформин следует выбрать в качестве основы терапии. С точки зрения риска развития гипогликемических состояний наиболее безопасным представляется добавление к комбинации метформина с инкретиновыми миметиками ТЗД. А наиболее эффективным считается присоединение ПСМ к комбинации метформина с инкретиновыми миметиками. Таким образом, пациентам с уровнем HbА1с, близким к 7,5%, целесообразно назначать комбинацию метформина с ТЗД и инкретиновыми миметиками, тогда как лицам с более высоким уровнем HbА1с – комбинацию метформина с ПСМ и инкретиновыми миметиками. Следующим этапом достижения целевого уровня гликемии при неэффективности комбинации трех препаратов является назначение инсулинотерапии сначала в фоновом, а затем и фоново-болюсном режиме, при переходе к которому необходимо отменить препараты, стимулирующие секрецию инсулина.
Тактика ведения пациентов с исходным уровнем HbА1с > 9%
В клинической практике нередко уже при диагностике СД 2 типа у пациентов имеется значительная гипергликемия и уровень HbA1c превышает 9%, однако отсутствует клиническая симптоматика заболевания, что свидетельствует о достаточной секреторной активности инсулярного аппарата. Тактикой выбора в этой ситуации, по предложению авторов алгоритма, может быть не интенсивная инсулинотерапия, которая абсолютно показана при HbА1с > 10% и выраженной клинической симптоматике, а изначальная «тройная» терапия. Наиболее эффективной при этом считается комбинация метформина с ПСМ и инкретиновыми миметиками, наиболее безопасной в отношении риска гипогликемии – комбинация метформина с инкретиновыми миметиками и ТЗД (рис. 4).
Фиксированные комбинации сахароснижающих препаратов как способ повышения приверженности пациентов лечению
Практикующим врачам хорошо известно о неблагоприятном влиянии сложных схем сахароснижающей терапии на соблюдение пациентами режима терапии. Как показали результаты исследования DARTS (The diabetes audit and research in Tayside Scotland – Аудит и исследование сахарного диабета в области Тейсайд (Шотландия)) [32], только 30% пациентов твердо придерживаются терапии одним лекарственным средством и менее 13% – бóльшим количеством препаратов и в высоких дозах (раздельная комбинация). Этим объясняется появление официнальных комбинированных сахароснижающих препаратов, состоящих из сочетания метформина с различными препаратами других классов. Самой эффективной является комбинация метформина с ПСМ, позволяющая добиться наиболее быстрого и значимого снижения уровня HbА1с при использовании меньших доз каждого из составляющих, чем в случае раздельной комбинации, что, безусловно, снижает риск развития и выраженность побочных эффектов (нарушения со стороны желудочно-кишечного тракта, увеличение массы тела, гипогликемические состояния). Первой фиксированной комбинацией метформина и ПСМ, зарегистрированной в России, стал препарат Глибомет, не утративший своей популярности более чем за 10 лет применения благодаря высокой эффективности, относительной дешевизне и хорошему профилю безопасности. Глибомет представляет собой фиксированную комбинацию 2,5 мг глибенкламида и 400 мг метформина гидрохлорида. Сочетание глибенкламида, стимулятора секреции инсулина, и метформина, повышающего чувствительность тканей к действию гормона, обеспечивает воздействие на оба патофизиологических механизма развития заболевания. По современным представлениям, глибенкламид – препарат сульфонилмочевины второй генерации. Применяющийся в клинической практике с 1969 г., глибенкламид до сих пор остается «золотым стандартом», по которому оцениваются все остальные пероральные сахароснижающие препараты. Это объясняется тем, что глибенкламид обладает самой высокой константой сродства к SUR1-субъединице КАТФ-канала бета-клетки, связываясь с ней как сульфонилмочевинной, так и бензамидной группировкой. В 2010 г. глибенкламиду была присуждена Премия лекарственных средств им. Г.Г. Крейтцфельдта (Германия) как лекарственному препарату, который благодаря своему принципу действия сыграл центральную роль в оптимизации фармакотерапии. Особое значение при этом имеют эффективность препарата, его профиль безопасности и возможные долгосрочные благоприятные эффекты. В свою очередь метформин входит в Перечень жизненно необходимых и важнейших лекарственных препаратов, его эффективность и безопасность доказаны многочисленными исследованиями. Отметим еще одно важное преимущество фиксированной комбинации: фармакокинетические параметры позволяют применять оба препарата 2 раза в день. Глибомет не уступает по эффективности комбинированной терапии двумя сахароснижающими препаратами. При расчете показателя «затраты – эффективность» было показано, что наименьшие затраты на достижение хорошего и удовлетворительного контроля были в группе лечения Глибометом, а наибольшие – в группе комбинированной терапии двумя сахароснижающими средствами [34].
Таким образом, применение Глибомета в терапии СД 2 типа позволяет достичь целевого уровня контроля гликемии как у пациентов, не ответивших на лечение максимальными дозами метформина, либо в случае его непереносимости, так и у лиц, которым изначально показана «двойная» терапия при уровне HbА1с > 8,0% либо «тройная» терапия при уровне HbА1с > 9,0% в сочетании с инкретиновыми миметиками или ТЗД. Глибомет не только оказывает воздействие на оба основных патогенетических звена СД 2 типа, но и позволяет добиться эффекта с использованием меньших доз препарата и низким риском побочных явлений, а также обеспечивает лучшую комплаентность пациентов. Глибомет может быть использован в любой когорте пациентов с СД 2 типа вне зависимости от исходного уровня HbA1c, разумеется, с учетом индивидуальных целей лечения, определяемых исходя из возраста и ожидаемой продолжительности жизни пациента в отсутствие риска развития гипогликемических состояний и тяжелых сосудистых осложнений в анамнезе.
1. The World Health Report 1998. Life in 21st Century – a Vision for all. Geneva: World Health Organisation, 1998.
2. Cунцов Ю.И. Современные сахароснижающие препараты, используемые в России при лечении сахарного диабета 2 типа // Сахарный диабет. 2012. № 1. С. 6–10.
3. Hsueh W.A., Law R.E. Cardiovascular risk continuum: Implications of insulin resistance and diabetes // Am. J. Med. 1998. Vol. 105. № 1А. P. 4S–14S.
4. Доборджгинидзе Л.М., Грацианский Н.А. Роль статинов в коррекции диабетической дислипидемии // Сахарный диабет. 2001. № 2. С. 41–47.
5. Coutinho M., Gerstein H.C., Wang Y., Yusuf S. The relationship between glucose and incident cardiovascular events: a metaregression analysis of published data from 20 studies of 95,783 individuals followed for 12.4 years // Diabetes Care. 1999. Vol. 22. № 2. P. 233–240.
6. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complication in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group // Lancet. 1998. Vol. 352. № 9131. P. 837–853.
7. Ohkubo Y., Kishikawa H., Araki E. et al. Intensive insulin therapy prevents the progression of diabetic microvascular complications in Japanese patients with non-insulin-dependent diabetes mellitus: a randomized prospective 6-year study // Diabetes Res. Clin. Pract. 1995. Vol. 28. P. 103–117.
8. Kahn S.E., Zinman B., Lachin J.M. et al. Rosiglitazone-associated fractures in type 2 diabetes: an analysis from a Diabetes Outcome Progression Trial (ADOPT) // Diabetes Care. 2008. Vol. 31. № 5. P. 845–851.
9. Patel A., MacMahon S., Chalmers J. et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes // N. Engl. J. Med. 2008. Vol. 358. № 24. P. 2560–2572.
10. Wilcox R., Kupfer S., Erdmann E. (PROactive Study Investigators). Effects of pioglitazone on major adverse cardiovascular events in high-risk patients with type 2 diabetes: results from PROspective pioglitAzone Clinical Trial In macro Vascular Events (PROactive 10) // Am. Heart J. 2008. Vol. 155. № 4. P. 712–717.
11. Holman R.R., Paul S.K., Bethel M.A. et al. 10-year follow-up of intensive glucose control in type 2 diabetes // N. Engl. J. Med. 2008. Vol. 359. № 15. P. 1577–1589.
12. Gaede P., Valentine W.J., Palmer A.J. et al. Cost-effectiveness of intensified versus conventional multifactorial intervention in type 2 diabetes: results and projections from the Steno-2 study // Diabetes Care. 2008. Vol. 31. № 8. P. 1510–1515.
13. Gerstein H.C., Miller M.E., Byington R.P. et al. Effects of intensive glucose lowering in type 2 diabetes // N. Engl. J. Med. 2008. Vol. 358. № 24. P. 2545–2559.
14. Duckworth W., Abraira C., Moritz T. et al. Glucose control and vascular complications in veterans with type 2 diabetes // N. Engl. J. Med. 2009. Vol. 360. № 2. P. 129–139.
15. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Вып. 6 / Российская ассоциация эндокринологов; под ред. И.И. Дедова, М.В. Шестаковой. М.: Информполиграф, 2013. 119 с.
16. DeFronzo R.A. Pathogenesis of type 2 diabetes: metabolic and molecular implications for identifying diabetes genes // Diabetes Rev. 1997. Vol. 5. № 3. P. 177–269.
17. Kahn C.R., Vicent D., Doria A. Genetics of non-insulin-dependent (type-II) diabetes mellitus // Annual Rev. Med. 1996. Vol. 47. P. 509–531.
18. Kahn C.R. Banting Lecture. Insulin action, diabetogenes, and the cause of type II diabetes // Diabetes. 1994. Vol. 43. № 8. P. 1066–1084.
19. Kirpichnikov D., McFarlane S.I., Sowers J.R. Metformin: an update // Ann. Intern. Med. 2002. Vol. 137. P. 25–33.
20. Riccio A., Del Prato S., Vigili de Kreutzenberg S., Tiengo A. Glucose and lipid metabolism in non-insulin-dependent diabetes. Effect of metformin // Diabetes Metab. 1991. Vol. 17. № 1. Pt. 2. P. 180–184.
21. Perriello G., Misericordia P., Volpi E. et al. Acute antihyperglycemic mechanisms of metformin in NIDDM. Evidence for suppression of lipid oxidation and hepatic glucose production // Diabetes. 1994. Vol. 43. № 7. P. 920–928.
22. Radziuk J., Bailey C.J., Wiernsperger N., Yudkin J.S. Metformin and its liver targets in the treatment of type 2 diabetes // Curr. Drug Targets. Immune Endocr. Metabol. Disord. 2003. Vol. 3. № 2. P. 151–169.
23. Wollen N., Bailey C.J. Inhibition of hepatic gluconeogenesis by metformin. Synergism with insulin // Biochem. Pharmacol. 1988. Vol. 37. № 22. P. 4353–4358.
24. Ferner R.E., Rawlins M.D., Alberti K.G. Impaired B-cell responses improve when fasting blood glucose concentrate is reduced in non-insulin-dependent diabetes // Q. J. Med. 1988. Vol. 66. № 250. P. 137–146.
25. Lindsay J.R., Duffy N.A., McKillop A.M. et al. Inhibition of dipeptidyl peptidase IV activity by oral metformin in Type 2 diabetes // Diabet. Med. 2005. Vol. 22. № 5. P. 654–657.
26. Sinha Roy R., Bergeron R., Zhu L. et al. Metformin is a GLP-1 secretagogue, not a dipeptidyl peptidase-4 inhibitor // Diabetologia. 2007. Vol. 50. Suppl. 1. P. S284.
27. International Diabetes Federation Clinical Guidelines Task Force. Global Guideline for type 2 diabetes. Brussels, 2012. 117 p.
28. Schwartz S., Sievers R., Strange P. et al. Insulin 70/30 mix plus metformin versus triple oral therapy in the treatment of type 2 diabetes after failure of the two oral drugs // Diabetes Care. 2003. Vol. 26. № 8. P. 2238–2243.
29. De Fronzo R.A., Goodman A.M. Efficacy of metformin in patients with non-insulin-dependent diabetes mellitus. Multicenter Metformin Study Group // N. Engl. J. Med. 1995. Vol. 333. № 9. P. 541–549.
30. Hermann L.S., Schersten B., Bitzen P.-O. et al. Therapeutic comparison of metformin and sulphonylurea alone and in various combinations. A double-blind controlled study // Diabetes Care. 1994. Vol. 17. № 10. P. 1100–1109.
31. Tosi F., Muggeo M., Brun E. et al. Combination treatment with metformin and glibenclamide versus single-drug therapies in type 2 diabetes mellitus: a randomized, double-blind, comparative study // Metabolism. 2003. Vol. 52. № 7. P. 862–867.
32. Morris A.D. Considerations in assessing effectiveness and costs of diabetes care: lessons from DARTS // Diabetes Metab. Res. Rev. 2002. Vol. 18. Suppl. 3. P. S32–S35.
33. Nathan D.M., Buse J.B., Davidson M.B. et al. Management of hyperglycemia in type 2 diabetes: A consensus algorithm for the initiation and adjustment of therapy: a consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes // Diabetes Care. 2006. Vol. 29. № 8. P. 1963–1972.
34. Тюрина И.В., Воробьев П.А., Авксентьева М.В. Клинико-экономический анализ применения препарата глибомет по сравнению с альтернативными схемами лечения сахарного диабета 2 типа // Проблемы стандартизации в здравоохранении. 2003. № 8. С. 36–40.
The role of oral antidiabetic drugs combinations in the current treatment strategy of type 2 diabetes mellitus
L.V. Nedosugova
State Budgetary Educational Institution for Higher Professional Education ‘I.M. Sechenov First Moscow State Medical University’ of the Ministry of Health of Russia, Endocrinology Department of the Faculty for Postgraduate Professional Training of Physicians
Contact person: Lyudmila Viktorovna Nedosugova, profmila@rambler.ru
The review addresses current strategies of hypoglycemic treatment in patients with new-onset type 2 diabetes mellitus according to the 2012 International Diabetes Federation (IDF) clinical guidelines and 2013 Russian Endocrinology Society guidelines, with special focus on the choice of optimal combinations of oral hypoglycemic agents.
Новости на тему
01.07.2022 11:00:00
16.06.2021
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.