Комплексная терапия острой неосложненной инфекции нижних мочевых путей
- Аннотация
- Статья
- Ссылки
- English

Эпидемиология
Острые неосложненные инфекции мочевых путей (ИМП) у взрослых включают спорадические и рецидивирующие эпизоды острых внебольничных циститов, которые наиболее часто встречаются у практически здоровых женщин без органических и функциональных поражений мочевого тракта.
Половина всех женщин имеют хотя бы один эпизод ИМП в течение жизни, при этом у каждой третьей он возникает в возрасте до 24 лет. У 25–50% женщин, перенесших острый цистит, на протяжении года развиваются рецидивы заболевания [1].
У мужчин острый цистит встречается очень редко (шесть – восемь эпизодов в год на 10 000 мужчин в возрасте от 21 до 50 лет) и требует урологического дообследования с целью исключения других заболеваний урогенитального тракта, в частности обструкции мочевых путей [2].
На конгрессе Европейской ассоциации урологов, который состоялся в Мадриде в марте 2015 г., были определены возможные факторы риска развития инфекций нижних мочевых путей у женщин. Для молодых и пременопаузальных женщин – это половые контакты, использование спермицидов, смена сексуального партнера, наследственность (ИМП у матери), ИМП в анамнезе. У постменопаузальных и пожилых женщин спровоцировать эпизод цистита может наличие ИМП до менопаузы, недержание мочи, атрофический вагинит, дефицит эстрогенов, цистоцеле, наличие остаточной мочи, катетеризация и функциональные нарушения мочевого пузыря, антигены группы крови, нахождение в специализированных медицинских учреждениях и интернатах.
Осложняющими факторами течения инфекций нижних мочевых путей являются сахарный диабет, иммуносупрессивные состояния [3].
У женщин, страдающих хроническим рецидивирующим циститом, риск возникновения острого пиелонефрита повышается в три раза [4, 5].
Этиология и патогенез
Почти в 75–90% наблюдений этиологической причиной ИМП является Escherichia coli, в 5–10% – Staphylococcus saprophyticus, реже обнаруживаются Proteus mirabilis, Klebsiella spp. и Staphylococcus epidermidis [6].
Особенности течения ИМП, с одной стороны, определяются местными уроэпителиальными защитными механизмами, с другой – специфической уропатогенностью микроорганизма. К числу наиболее изученных факторов вирулентности Escherichia coli и Proteus mirabilis относят синтез аэробактина и энтеробактина (железосвязывающие белки с высоким сродством к железу, необходимому для размножения бактерий, образования гемолизина и экспрессии фимбрий). Отдельно выделяется способность образовывать фимбрии. При этом различают маннозочувствительные фимбрии (тип 1), которые выявлены и у патогенных, и у непатогенных штаммов Escherichia coli, и маннозорезистентные фимбрии (Р-фимбрии), присущие только уропатогенам. Специфические особенности этого микроорганизма подтверждены способностью прикрепляться к рецепторам эпителия урогенитального тракта и затем подниматься вверх из мочевого пузыря [7].
Исследование биологических свойств уропатогенных штаммов Escherichia coli, имеющих Р-фимбрии и F-адгезины, показало, что они выделяются только у 10–15% пациентов без ИМП, но в 50–65% случаев при цистите и в 75–90% случаев при пиелонефрите [8, 9].
В последнее время у молодых женщин причиной острого цистита или пиелонефрита все чаще становится Staphylococcus saprophyticus, который, обладая дополнительными инвазивными свойствами, проникает в слои, подлежащие переходному эпителию.
Диагностика
В диагностике инфекций нижних мочевых путей особое внимание необходимо уделять симптомам нижних мочевых путей (СНМП): дизурии, частому мочеиспусканию, ургентности, изменениям в половых органах у женщин. Женщин с рецидивирующей ИМП необходимо обследовать на содержание глюкозы в крови, при длительном течении сахарного диабета проводить дифференциальную диагностику инфекций нижних мочевых путей с нейрогенным мочевым пузырем [10].
В настоящее время при неосложненной инфекции нижних мочевых путей рекомендуется выполнение экспресс-анализа мочи (urine dipstick test) или микроскопическое исследование осадка мочи [11]. Культуральное исследование мочи показано в следующих случаях:
- подозрение на острый пиелонефрит;
- возвращение СНМП в течение двух – четырех недель после лечения;
- атипичные СНМП;
- беременность;
- подозрение на инфекцию нижних мочевых путей у мужчин.
У женщин с симптомами острого неосложненного цистита клинически значимым считается титр ≥ 103 КОЕ/мл. При подозрении на инфекцию нижних мочевых путей у мужчин, а также атипичных СНМП и отсутствии эффекта от антибактериальной терапии у женщин рекомендовано проведение дополнительного урологического обследования [12].
Лечение
Важным этапом в лечении неосложненной инфекции нижних мочевых путей является обоснованный выбор эмпирической антибактериальной терапии с учетом [1]:
- спектра и чувствительности уропатогена;
- эффективности, продемонстрированной в клинических исследованиях;
- переносимости и побочных реакций;
- соотношения цены и качества.
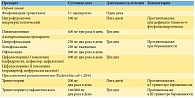
При остром цистите показан однократный прием фосфомицина трометамола или трехдневный курс фторхинолонов (ципрофлоксацин, левофлоксацин, офлоксацин) или цефалоспоринов I и II поколения (табл. 1).
Общепризнанными средствами профилактики рецидивирующей неосложненной ИМП у женщин являются заместительная местная гормональная терапия после консультации гинеколога, вакцины Уро-Ваксом и СолкоУровак, пробиотики (Lactobacillus spp.), препараты клюквы (Vaccinium macrocarpon), D-mannose, инстилляции в мочевой пузырь гиалуроновой кислоты и хондроитина сульфата.
Антимикробная посткоитальная профилактика для женщин с рецидивирующей инфекцией мочевых путей включает нитрофурантоин макрокристаллический 50–100 мг однократно, фосфомицина трометамол 3 г каждые десять дней и во время беременности, цефалексин 125 или 250 мг или цефаклор 250 мг однократно [13].
Перспективным направлением в комплексной терапии ИМП является применение препаратов растительного происхождения. Они, как правило, хорошо переносятся больными, не имеют побочных эффектов, могут применяться длительно, не приводят к гиповитаминозу и дисбактериозу. Фитопрепараты хорошо сочетаются друг с другом и могут оказывать влияние на различные органы и системы, что позволяет лечить одновременно несколько заболеваний.
Теория и практика фитотерапии основываются на семи принципах лечения больных: этапность, системность, индивидуальность, непрерывность, временной принцип лечения, переход от простого к сложному, качество лекарственного сырья [14].
Назначение фитопрепаратов при воспалительных заболеваниях мочеполового тракта основано на их антимикробном, фитонцидном, противовоспалительном, мочегонном, литолитическом, спазмолитическом, обезболивающем действии, способности нормализовать иммунный статус и половую функцию [14].
Благодаря успехам биохимии и научно-техническому прогрессу действующие вещества многих растений были выделены в чистом виде и нашли широкое распространение. Сегодня полученные из растений активные вещества в высокой концентрации обладают выраженными клиническими свойствами. Наиболее эффективны комбинированные препараты из нескольких растительных трав, взаимодополняющих эффект друг друга.
По данным Всемирной организации здравоохранения, лекарственные средства растительного происхождения составляют немалую долю объема фарминдустрии. Значительная часть населения развивающихся стран в рамках системы первичной медико-санитарной помощи использует традиционные препараты природного происхождения. Благодаря внедрению стандартов GMP и производству высокоочищенных эффективных лекарственных средств растительного происхождения в последние годы отмечается неуклонный рост потребления фитопрепаратов в мире [15, 16].
Уролесан в терапии инфекции мочевых путей
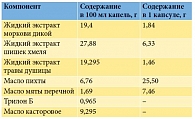
Одним из наиболее изученных и широко применяемых в урологической практике является комбинированный растительный препарат Уролесан, который выпускается в трех лекарственных формах: капли, сироп и капсулы (табл. 2). Богатый фармакодинамический спектр активности препарата обусловлен уникальным составом: масло пихты сибирской, масло мяты перечной, экстракты шишек хмеля, плодов моркови дикой, травы душицы, которые содержат активные вещества (терпены, тимол, токоферол, кумарины, ментол, лимулин).
Компоненты эфирных масел, входящие в состав Уролесана, уменьшают выраженность воспалительных процессов, способствуют усилению кровоснабжения почек, оказывают диуретическое, желчегонное и бактерицидное действие, образуют защитный коллоид в моче, а также нормализуют тонус гладких мышц мочевых путей.
Уролесан быстро всасывается в желудочно-кишечном тракте, начинает действовать через 20–30 минут, достигая максимального эффекта в течение двух-трех часов.
Масло мяты перечной (Menthae piperitae oleum) обладает спазмолитическим эффектом, оказывает антимикробное, противовоспалительное и ангиопротективное действие. Эксперименты на разных видах лабораторных животных показали, что фармакологические эффекты мяты перечной обусловлены основным действующим веществом экстракта листьев данного растения – ментолом. В условиях in vitro на культуре гладких миоцитов доказано, что эмульсия мяты перечной активна как неселективный ингибитор кальциевых каналов и индуцирует расслабление гладкой мускулатуры. В эксперименте на кроликах, у которых индуцировали спазм гладкой мускулатуры кишечника введением субстанции Р, экстракт мяты перечной активировал меченные серотонином рецепторы и оказывал спазмолитическое действие. В двойном слепом плацебоконтролируемом исследовании с участием 69 женщин после операции по поводу разной гинекологической патологии была продемонстрирована эффективность применения экстракта листьев мяты перечной в форме капсул как спазмолитика [17].
Плоды моркови дикой (Dauci carotae fructus) содержат эфирное и жирное масла, флавоноиды, органические кислоты, сахара и более 20 микроэлементов. Благодаря содержанию кумаринов плоды моркови дикой спазмолитически действуют на коронарные сосуды, гладкомышечную ткань желудочно-кишечного тракта, мочевых путей, бронхов и других органов. Испытания антимикробных свойств эфирного масла in vitro показали выраженную противомикробную активность в отношении Escherichia cоlі [18].
Трава душицы обыкновенной (Oríganum vulgáre) содержит эфирные масла, свободные спирты, геранилацетат, дубильные вещества, аскорбиновую кислоту, растительные жиры. Душица обыкновенная усиливает перистальтику кишечника, стимулирует секрецию бронхиальных и пищеварительных желез, повышает тонус и сокращаемость миометрия и гладкой мускулатуры кишечника, действует успокаивающе на центральную нервную систему, а также используется как болеутоляющее, спазмолитическое средство. За счет тимола и терпенов душица обладает выраженными антисептическими (противомикробными) свойствами [19].
Шишки хмеля (Humulus) содержат эфирные масла полифенольных соединений и горечи. Лекарственные средства из шишек хмеля обладают разносторонними фармакологическими свойствами – успокаивающим, обезболивающим, снотворным, противовоспалительным. Нейротропные свойства галеновых препаратов из шишек хмеля связывают с содержанием в них лупулина, который оказывает успокаивающее действие на центральную нервную систему. Эфирное масло хмеля активно в отношении грамположительных бактерий и грибов. Горечи хмеля, особенно бета-кислоты, подавляют развитие грамположительных, а в больших концентрациях – и грамотрицательных бактерий [20].
Масло пихты (Abies sibirica oleum) содержит дубильные вещества, каротин, аскорбиновую кислоту и токоферолы. Благодаря своей высокой биологической активности пихтовое масло обладает ценными лечебными, дезинфицирующими и противовоспалительными свойствами. Его особые свойства связаны с бактерицидным и противовирусным действием [19].
Проведено достаточно клинических исследований, подтвердивших эффективность и безопасность использования Уролесана в урологической практике. Многолетний опыт применения препарата Уролесан и отдельно растительных компонентов, входящих в его состав, также свидетельствует о высокой клинической и фармакоэкономической эффективности, безопасности препарата. В комплексной терапии и с целью профилактики при инфекции нижних мочевых путей целесообразно назначать Уролесан (капсулы, сироп, капли) курсом продолжительностью один месяц.
В 2011–2012 гг. сотрудниками кафедры урологии и андрологии Московского государственного университета им. М.В. Ломоносова было проведено пострегистрационное исследование эффективности применения Уролесана у женщин с острым циститом. В исследование было включено 195 женщин в возрасте от 18 до 50 лет, которые были распределены методом простой рандомизации на три группы.
Базисная терапия для всех групп включала антибактериальную терапию: офлоксацин по 200 мг два раза в день в течение пяти дней, анальгетики (Баралгин М) по требованию.
Первая основная группа пациентов в комплексной терапии принимала Уролесан по 8–10 капель на кусочке сахара или на черном хлебе под язык три раза в сутки до еды. Вторая основная группа – по одной капсуле три раза в сутки до еды. Третья группа (контрольная) получала базисную антибактериальную терапию и обильное питье.
Оценка выраженности острого цистита производилась по шкале оценки симптомов у пациентов с болью в области таза (The Pelvic and Urinary/Frequency (PUF) Patient Symptom Scale).
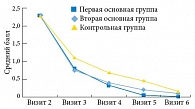
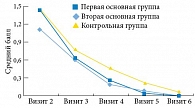
Результаты показали, что клиническая эффективность была сравнимой при включении в комплексную терапию Уролесана как в форме капсул, так и форме капель, составив в первой и второй группах 82,6 и 80,9% соответственно, в отличие от контрольной группы, в которой клиническая эффективность составила 55,4%.
Во всех группах наблюдалась хорошая динамика по уменьшению интенсивности рези при мочеиспускании, дискомфорта или болезненности внизу живота, ощущения неполного опорожнения мочевого пузыря, а также выраженности императивных позывов к мочеиспусканию. Кроме того, отмечено снижение потребности в анальгетиках. Динамика выраженности симптомов отражена на рис. 1–3.
Анализ результатов показал эффективность лекарственной терапии к третьему визиту во всех группах, но в первой и второй группах эффект был более выражен по сравнению с контрольной.
Применение Уролесана у пациентов с острым циститом позволило достичь более быстрого клинического эффекта купирования дизурии и боли внизу живота, что снизило потребность в приеме анальгетиков и подтвердилось статистически достоверным улучшением общего балла оценки дискомфорта по шкале PUF в сравнении с контрольной группой.
Заключение
Персистенция микроорганизмов, их высокая выживаемость и резистентность – одна из причин длительного сохранения симптомов нижних мочевых путей при неосложненной инфекции. Они могут значительно снижать качество жизни пациенток с инфекционно-воспалительным процессом в стенке мочевого пузыря даже после эрадикации возбудителя. Применение фитопрепаратов, в частности Уролесана, в комплексной терапии позволяет быстрее купировать симптомы и снизить их выраженность при острой неосложненной инфекции нижних мочевых путей.
A Combination Therapy of Acute Uncomplicated Lower Urinary Tract Infections
A.A. Kamalov1, L.A. Khodyreva1, 2, A.A. Dudareva1, 2
1 Lomonosov Moscow State University
2 Research Institute of Health and Medical Management of Moscow Health Department
Contact person: Lyubov Alekseyevna Khodyreva, urodepatment@mail.ru
Here we discuss epidemiology, etiology and pathogenesis of the lower urinary tract infection. Diagnostic tools and treatment are characterized. A combined herbal drug Urolesan N exemplified opportunities of plant-based preparations in treatment of urological diseases. It was noted that Urolesan N as a part of a combination therapy let to faster relieve symptoms and lower their intensity during acute uncomplicated lower urinary tract infection.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.