Лечение профессиональной астмы антагонистами лейкотриеновых рецепторов
- Аннотация
- Статья
- Ссылки
Профессиональная бронхиальная астма (ПА) – это заболевание, обусловленное комплексным воздействием факторов производственной среды при участии индивидуальной чувствительности к ним организма. Понятие «факторы производственной среды» включает в себя характеристику неблагоприятных агентов, присутствующих на рабочем месте, а именно: пыли, аллергенов (АГ), токсических веществ, газообразных аэрозолей, их патогенных свойств, дозы, особенностей воздействия в момент контакта и пути экспозиции.
Основным причинным фактором ПА является тот агент производственной среды, который способен вызвать:
- преходящую бронхоконстрикцию;
- неспецифическую гиперреактивность бронхов (НГРБ);
- воспаление дыхательных путей.
По результатам всестороннего изучения патогенеза ПА в последние годы были внесены некоторые коррективы в это положение с акцентом внимания на присутствие в рабочей зоне одновременно агентов–индукторов (основных виновников развития ПА) и триггеров – факторов, провоцирующих бронхоконстрикцию (физическая нагрузка, холодный воздух, снижение или повышение относительной влажности) у лиц с уже имеющейся НГРБ [1].
Таким образом, индукторы несут ответственность за формирование воспаления в дыхательных путях и НГРБ, в то время как триггеры обеспечивают частоту развития симптомов и обострений ПА у лиц с уже имеющимся заболеванием.
Профессиональные АГ делятся на вещества с высокой и низкой молекулярной массой. К первым относятся белки животного и растительного происхождения, микробная флора, которые способны вызвать опосредованную иммуноглобулином Е (IgE) аллергическую реакцию, ко вторым – токсические аэрозоли (пары кислот, щелочей, лаки, краски). Сенсибилизация низкомолекулярными веществами происходит в результате связывания гаптенов с белками хозяина с последующими иммунологическими реакциями. Однако точный механизм этого процесса до сих пор до конца не изучен, в частности, не всегда удается установить участие IgE-антител в развитии астмы, индуцированной химическими агентами.
В противоположность бытовым и пыльцевым АГ многие профессиональные агенты отличаются стойкостью к разрушению под влиянием внешних воздействий: высоких температур, химических растворителей, обработки сильнодействующими веществами и других. Помимо аллергенов развитию ПА и обострению ее течения способствуют неблагоприятные метеофакторы (низкие температуры, повышенная влажность, пониженная циркуляция воздуха и др.), тяжелый физический труд, вибрация, в условиях которых производятся основные трудовые процессы [2]. Как показывают многочисленные исследования, в патогенезе ПА принимают участие аллергические реакции немедленного, позднего и двойного типов. Во многом характер иммунного/неиммунного ответа определяется природой и свойствами производственного агента, а чаще – комбинированным взаимодействием нескольких агентов, каждый из которых вызывает определенный тип гиперчувствительной (ГЧ) реакции [3].
В связи с тем, что верхние дыхательные пути являются входными «воротами» для производственной пыли и аэроаллергенов, развитие аллергического ринита и риносинусита, как правило, предшествует развитию ПА.
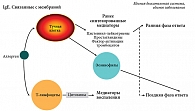
В патогенезе аллергического ринита участвуют аналогичные механизмы, а следовательно, одни и те же клетки и медиаторы воспаления (рис. 1). Как видно на представленной схеме, экспозиция производственного агента может вызвать раннюю и позднюю фазы ГЧ реакций. Ранний ответ (чаще неиммунного генеза) сопровождается участием цистеинил-лейкотриеновых производных арахидоновой кислоты, а также простагландинов и фактора активации тромбоцитов. Поздняя фаза протекает, как правило, с участием IgE-зависимого механизма, клеточного и гуморального звеньев, активацией цитокинов и выбросом провоспалительных медиаторов [4].
Лейкотриены, наряду с отдельными простагландинами и фактором активации тромбоцитов, являются мощными бронхоконстрикторами и играют роль провоспалительных медиаторов в развитии легочных заболеваний. Известно, что в основе развития БА любого генеза лежит хронический воспалительный процесс в бронхиальном дереве. Обострение заболевания характеризуется нарастанием отека слизистой и усилением бронхообструкции, обусловленными выбросом провоспалительных медиаторов, среди которых лейкотриены занимают особое место.
Лейкотриены образуются в результате метаболизма арахидоновой кислоты. Последняя находится в фосфолипидных мембранах эпителиальных и тучных клеток, а также эозинофилов и др. Любые биологические, физические и химические стимулы способствуют высвобождению арахидоновой кислоты, активируя фермент фосфолипазу. Последующий метаболизм фермента может происходить с образованием простагландинов, тромбоксана А2 и лейкотриенов. Этот комплекс веществ носит название «эйкозаноиды» [6].
В патогенезе БА принимают участие сульфидопептидные лейкотриены, известные больше как цистеинил-лейкотриены. К ним относятся LTC4, LTD4 и LTE4. Они продуцируются эозинофилами, тучными клетками, макрофагами, моноцитами и базофилами. Экспериментальными исследованиями было показано активное участие лейкотриенов не только в развитии бронхообструкции за счет спазма гладкой мускулатуры, но и создании предпосылок к астматическим приступам, а именно: в формировании отека слизистой за счет повышения проницаемости капилляров, увеличении секреции слизи и запуске реакции эозинофильного воспаления [7].
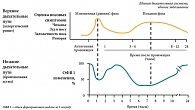
Симптомы профессионального риносинусита и ПА чаще взаимосвязаны, как и в случае астмы и ринита, не обусловленных профессиональными факторами, причем проявление их под воздействием производственных аэрозолей или при экспозиции АГ аналогичным образом коррелирует с фазами ГЧ-реакции, как это показано на рис. 2.
После ингаляционной провокации производственными аэрозолями (тест реэкспозиции агента на рабочем месте) у лиц с подозрением на ПА мы наблюдали появление бронхообструкции, сопровождающейся увеличением числа эозинофилов в индуцированной мокроте и отпечатках со слизистой носа (≥ 2,2%). Назальная аллергенная провокация на рабочем месте также повышала реактивность бронхов аналогично провокации непрофессиональными аллергенами (рис. 3). В связи с этим, наряду с базисными противовоспалительными средствами (глюкокортикостероидами), представляется целесообразным использование в лечении БА антилейкотриеновых препаратов.
Одним из широко известных ингибиторов активности лейкотриенов является препарат «Монтелукаст» (Сингуляр®, MCD, Швейцария). Как антагонист цистеинил-лейкотриенов, Монте-лукаст селективно ингибирует их рецепторное взаимодействие и способен существенно изменять дозозависимый ответ при ингаляции глюкокортикостероидов [10]. Принимается перорально в дозе 10 мг.
На базе медсанчасти производственного предприятия и ФГУ «НИИ пульмонологии» ФМБА России было проведено исследование клинической эффективности препарата «Сингуляр» в лечении больных ПА в сочетании с аллергической риносинусопатией. Целью исследования явилась оценка терапевтического действия Сингуляра при монотерапии и в комбинации с ингаляционными глюкокортико-стероидами [11] у лиц с ПА, продолжающих работать в прежних профессионально-производ-ственных условиях.
Материалы и методы
В исследовании принимали участие 20 человек (работники строительной отрасли – газоэлектросварщики, монтажники, маляры, штукатуры) с БА легкой и средней степени тяжести профессионального генеза, триггерами которой являлись такие факторы, как физическая нагрузка и холодный воздух. Среди них было 11 женщин (55%) и 9 мужчин (45%). Средний возраст составил 41±2,6 года, стаж работы во вредных условиях – 9,7 ± 1,4 года. БА была в сочетании с риносинусопатией у 11 работников (55%), в сочетании с ХОБЛ – у одного (5%).
Обследование всех пациентов проводились общеклиническими, лабораторными и инструментальными методами. Сингуляр в качестве монотерапии в дозе 10 мг ежедневно один раз в сутки получали 14 человек (70%) с легкой персистирующей БА. Тот же препарат и в такой же дозе, но в комбинации с Симбикортом (160/4,5 мкг по две дозы дважды в день) принимали 6 человек (30%) с БА средней степени тяжести, недостаточно контролируемой. Длительность лечения была одинаковой – два месяца.
Всем больным были розданы индивидуальные дневники наблюдения за изменением своих симптомов, таких как кашель, затрудненное дыхание, приступы удушья, водянистый насморк или заложенность носа, чиханье, слезотечение и др. Мониторинг пикфлоуметрии в динамике рабочей смены и периода отдыха проводился в начале лечения и через два месяца. Также регистрировали до начала терапии и после ее завершения количество оксида азота в выдыхаемом воздухе (NO exh, ppb), являющегося маркером аллерговоспалительного процесса в респираторной системе. Лечение проводилось в зимний период при средней температуре наружного воздуха –18,4 ºС. Результаты лечения оценивались по пятибалльной шкале, где высший балл соответствует максимальной выраженности симптомов.
Результаты
Субъективная оценка эффективности лечения
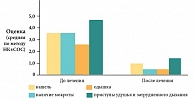
Среди больных БА средней степени тяжести была отмечена следующая положительная динамика. Снижение частоты приступов кашля и затрудненного дыхания в среднем от одного-двух раз в день до одного-трех раз в неделю (у пяти из шести больных); уменьшение отделения мокроты или полное ее отсутствие; сокращение приступов удушья от трех-четырех раз в день до двух-трех в неделю (у четырех из шести больных); улучшение переносимости физической нагрузки (снижение одышки) и отсутствие затрудненного выдоха при резкой смене температуры окружающего воздуха (у пяти из шести больных); уменьшение потребности в ингаляции Симбикорта – снижение его дозы вдвое (у трех из шести больных).
Значительно уменьшились аллергические проявления со стороны верхних дыхательных путей. Абсолютное большинство лиц (12 из 14) с легкой персистирующей БА уже в конце третьей недели лечения Сингуляром отметили улучшение самочувствия с уменьшением (7 из 14 чел.) или полным исчезновением (5 чел.) симптомов заболевания. В целом положительная субъективная динамика клинических симптомов была зарегистрирована у 17 работников (85%). Статистически достоверная разница динамики показателей (средних значений баллов) до и после лечения представлена на рис. 4 (p ≤ 0,05).
Объективная оценка эффективности лечения
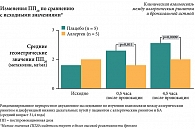
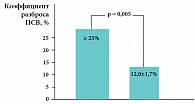
В конце восьмой недели лечения в 80% случаев (т. е. у 16 из 20 больных) была зарегистрирована положительная объективная динамика – уменьшение количества сухих свистящих хрипов в легких, увеличение пиковой скорости на выдохе (ПСВ, л/мин) и снижение разброса показателей в период экспозиции и элиминации производственных аэрозолей. До лечения коэффициент разброса ПСВ в период контакта с АГ и вне его был ≥ 25% при средних данных по группе 20,7 ± 3,4%. После лечения разброс значений ПСВ существенно снизился: до 12,0 ± 1,7% (p = 0,005), свидетельствуя о достоверном уменьшении гиперреактивности и гиперчувствительности бронхов к факторам производственной среды (рис. 5). Эти данные были подкреплены динамикой NO exh, характеризуя уменьшение степени воспаления в дыхательных путях под влиянием Сингуляра. Так, до лечения уровень NO exh был повышен у 15 работников, составляя в среднем 23,8 ± 5,7 ppb (при N = 12 ppb), что указывало на активный воспалительный процесс в дыхательных путях. После завершения восьминедельного курса терапии Сингуляром повышение NO exh было зарегистрировано лишь у четырех человек. Средние показатели NO exh снизились до 11,1 ± 2,0 ppb со значимой статистической достоверностью (p < 0,03).
Анализ полученных данных показал, что положительный клинический эффект от приема Сингуляра у девяти больных (45%) был достигнут уже по истечении пяти-шести недель лечения, у четырех – в конце четвертой недели и у трех работников – после двух-трехнедельного курса. Среди указанных лиц трое были с БА средне-тяжелого течения. Назначение им Сингуляра явилось удачным дополнением к ингаляционному приему глюкокортикостероидов, существенно повысив их физические возможности при работе в холодный период года. Неубедительные данные (статистически недостоверные) положительного влияния Сингуляра имели место у двух больных БА средней степени тяжести. Полностью отсутствовал эффект от лечения у одного больного с сопутствующим диагнозом ХОБЛ и у другого – с искривлением носовой перегородки.
Заключение
Подводя итог проведенного исследования, можно сделать заключение, что прием Сингуляра в суточной дозе, равной 10 мг, на протяжении восьминедельного курса в качестве монотерапии и комбинированного лечения с ингаляционными глюкокортикостероидами (не обеспечивавшими до включения их в исследование полного контроля астмы) оказывает существенное положительное влияние на течение БА (легкой персистирующей и средней степени тяжести) профессионального генеза с сопутствующей риносинусопатией.
Следует особо подчеркнуть позитивное действие препарата при выполнении больными физической нагрузки в условиях низких температур окружающего воздуха. Это дает основание рекомендовать Сингуляр в качестве одного из базисных препаратов для лечения больных БА, работающих в контакте с вредными и неблагоприятными профес-сионально-производственными факторами.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.