количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Медицинский форум
Лечение воспалительных заболеваний кишечника в эру ингибиторов ФНО: секреты успеха. XXXX юбилейная сессия Центрального научно-исследовательского института гастроэнтерологии
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Гастроэнтерология" №1 (13)
- Аннотация
- Статья
- Ссылки
Лечение, которое отвечало бы всем современным требованиям таких гастроэнтерологических заболеваний, как язвенный колит и болезнь Крона, объединенных в группу воспалительных заболеваний кишечника (ВЗК), является сложной и комплексной задачей. Современные цели лечения ВЗК включают достижение глубокой ремиссии, или remission beyond symptoms (устранение, помимо симптомов, воспалительной активности, определяемой по объективным параметрам, таким как заживление изъязвлений слизистой оболочки и нормализация маркеров воспаления). Достижение глубокой ремиссии позволяет улучшить качество жизни пациентов, уменьшить частоту госпитализаций и хирургических вмешательств1.
Это стало возможно благодаря внедрению в клиническую практику биологических препаратов, в частности ингибиторов фактора некроза опухоли альфа. Участники симпозиума, состоявшегося в рамках ХХХХ юбилейной сессии Центрального научно-исследовательского института гастроэнтерологии (Москва, 5 марта 2014 г.), рассмотрели вопросы улучшения оказания помощи пациентам с ВЗК.
Лечение, которое отвечало бы всем современным требованиям таких гастроэнтерологических заболеваний, как язвенный колит и болезнь Крона, объединенных в группу воспалительных заболеваний кишечника (ВЗК), является сложной и комплексной задачей. Современные цели лечения ВЗК включают достижение глубокой ремиссии, или remission beyond symptoms (устранение, помимо симптомов, воспалительной активности, определяемой по объективным параметрам, таким как заживление изъязвлений слизистой оболочки и нормализация маркеров воспаления). Достижение глубокой ремиссии позволяет улучшить качество жизни пациентов, уменьшить частоту госпитализаций и хирургических вмешательств1.
Это стало возможно благодаря внедрению в клиническую практику биологических препаратов, в частности ингибиторов фактора некроза опухоли альфа. Участники симпозиума, состоявшегося в рамках ХХХХ юбилейной сессии Центрального научно-исследовательского института гастроэнтерологии (Москва, 5 марта 2014 г.), рассмотрели вопросы улучшения оказания помощи пациентам с ВЗК.

Д.м.н. О.В. Князев
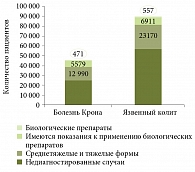
Рис. 1. Показания к терапии биологическими препаратами

А.О. Атрощенко
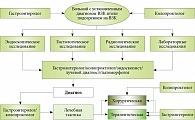
Рис. 2. Алгоритм ведения пациента с болезнью Крона

Рис. 3. Эффективность адалимумаба в заживлении свищей

Д.м.н. И.Н. Ручкина
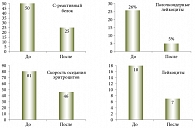
Рис. 4. Изменение показателей крови у пациента с болезнью Крона до и после трех введений адалимумаба
Современные тренды в лечении больных с воспалительными заболеваниями кишечника
Воспалительные заболевания кишечника (ВЗК) – тяжелые, прогрессирующие, приводящие к инвалидизации заболевания желудочно-кишечного тракта (ЖКТ). Результаты общеевропейского исследования IMPACT продемонстрировали масштаб влияния ВЗК на уровень и качество жизни пациентов. В ходе исследования рассматривали вопросы, связанные с диагностикой и лечением ВЗК, качеством жизни пациентов, их занятостью, отношением с окружающими. Были проанализированы анкеты 4990 респондентов (возраст 19–44 года) из 24 европейских стран. Установлено, что около 18% пациентов ожидают диагноза более пяти лет. Этот период отличается высоким уровнем заболеваемости и клиническим риском, поскольку 64% пациентов экстренная помощь нужна задолго до постановки диагноза. Установить необходимый контакт с лечащим врачом и обсудить проблемы здоровья не удалось 53% респондентов. Более 20% пациентов с ВЗК сталкивались с дискриминацией на работе2.
По словам д.м.н., заведующего отделением лечения воспалительных заболеваний кишечника Центрального научно-исследовательского института гастроэнтерологии Олега Владимировича КНЯЗЕВА, правильная и своевременная диагностика ВЗК очень важна для успешного лечения. Однако трудность заключается в том, что единого «золотого стандарта» диагностики не существует. Диагноз ВЗК устанавливают на основании оценки клинической картины болезни, данных комплекса эндоскопических, радиологических, гистологических и биохимических исследований (согласно положениям Европейской организации по изучению болезни Крона и язвенного колита (European Crohn’s and Colitis Organisation – ECCO))3. Таким образом, своевременная постановка диагноза у пациента, страдающего язвенным колитом (ЯК) или болезнью Крона (БК), зачастую зависит от конкретного специалиста-гастроэнтеролога, который правильно составит план обследования и проанализирует всю полученную информацию. В этой связи актуален вопрос о создании в России так называемых центров ВЗК – объединений специалистов и ресурсов здравоохранения на базе крупных клиник и больниц, включающих гастроэнтерологов, колопроктологов, эндоскопистов, морфологов, специалистов УЗИ и лучевой диагностики, знакомых с проблематикой ВЗК.
Лечение ЯК и БК должно основываться на принципах доказательной медицины. Кроме того, принимая решение о дальнейшей лечебной тактике, нельзя пренебрегать индивидуальным подходом. Адекватная и правильная информированность пациента о планах и видах терапии улучшает его приверженность лечению, а активное взаимодействие с врачом по поводу выбора тактики терапии позволяет достигать более высоких результатов.
Так, в Голландии был проведен опрос по оценке вовлечения в процесс принятия решений о лечении среди 1067 взрослых пациентов с ВЗК. Активное вовлечение в такой процесс оценили «как очень важное» 81% больных. Пациенты считают, что лечащий врач должен предоставлять им максимально полную информацию о заболевании и методах терапии, основываясь на современных научных данных4.
В неспециализированных отделениях пациентам с ВЗК часто назначают длительные курсы стероидной терапии, ассоциирующейся с риском тяжелых инфекций и другими нежелательными явлениями. Длительные наблюдения (один год) показывают, что лечение активной БК глюкокортикостероидами (ГКС) почти у половины пациентов сопровождается формированием резистентности либо гормональной зависимости5. Кроме того, ни системные, ни топические ГКС не превосходят плацебо по эффективности в поддержании ремиссии при БК6. Для противорецидивного лечения пациентов с БК целесообразно активнее использовать иммуносупрессоры и/или ингибиторы фактора некроза опухоли альфа (ФНО-альфа), особенно у больных с факторами риска неблагоприятного течения заболевания. Эти препараты позволяют избежать назначения повторных курсов ГКС.
Важно своевременно оценивать ответ на базисную терапию (ГКС на второй неделе, азатиоприном на 10–12-й неделе) и помнить, что основная цель лечения ВЗК – достижение безстероидной ремиссии. В терапии ВЗК помимо клинической оценки необходимо использовать дополнительные критерии эффективности, такие как биомаркеры и эндоскопический контроль заживления слизистой оболочки7.
Эра биологических препаратов ознаменовалась качественно новыми подходами к лечению ВЗК. По мнению О.В. Князева, ингибиторы ФНО-альфа показаны в случае:
- среднетяжелого и тяжелого течения БК;
- молодого возраста начала болезни;
- стероидозависимости и стероидорезистентности;
- протяженного поражения тонкой кишки более 100 см при БК;
- поражения верхних отделов ЖКТ при БК;
- пенетрирующего типа БК;
- наличия перианальных поражений при БК;
- наличия внекишечных проявлений;
- высокого риска послеоперационного рецидива после резекции кишечника при БК (рис. 1).
Селективное действие ингибиторов ФНО-альфа делает препараты этой группы более безопасными по сравнению с ГКС и более эффективными по сравнению с иммуносупрессорами.
В нашей стране наблюдаются низкие показатели (< 10%) назначения биологической терапии ВЗК по сравнению с другими странами (30%). Во многом это связано с отсутствием адекватных государственных программ возмещения стоимости лекарственных препаратов для лечения ВЗК. Ситуация в Москве более благоприятная, чем в других регионах России. Так, в отделении патологии кишечника ЦНИИГ МКНЦ из 524 пациентов с ВЗК (268 – ЯК, 256 – БК) 87 пациентов получают лечение инфликсимабом или адалимумабом. Таким образом, 17% больных ВЗК применяют современные биологические препараты.
О.В. Князев подчеркнул, что для улучшения качества оказания помощи пациентам с ВЗК необходимо создать базу данных или реестр, учитывающий реальное количество больных ВЗК в Москве, для эффективной оценки эпидемиологической ситуации и улучшения контроля эффективности проводимого лечения.
Согласно приказу Департамента здравоохранения г. Москвы от 10 сентября 2012 г. № 983 «Об утверждении методических рекомендаций по организации оказания взрослому населению города Москвы первичной медико-санитарной помощи» организована трехуровневая система медицинской помощи. Больные ВЗК сначала приходят на прием к терапевту, затем к гастроэнтерологу. Чтобы попасть на третий уровень оказания медицинской помощи в консультативно-диагностическое отделение к узким специалистам, пациенту нужно потратить много времени и сил. Тем самым между первыми симптомами ВЗК и постановкой диагноза может пройти более пяти лет. Необходимо упростить переход пациента с первого на третий уровень, чтобы обеспечить своевременные диагностику и лечение заболевания. Задачей врачей должно стать обеспечение мультидисциплинарной медицинской помощи с учетом индивидуальной потребности пациентов для достижения максимального улучшения отдаленных исходов течения данных заболеваний, уменьшения инвалидизации. Стратегическими целями врачей отделений ВЗК является также обучение ординаторов, аспирантов и гастроэнтерологов принципам диагностики и лечения ВЗК. На сегодняшний день необходимо выделять группы пациентов с неблагоприятным течением заболевания и рассматривать вопрос раннего назначения иммуносупрессивной и/или биологической терапии.
В заключение О.В. Князев добавил, что надо совершенствовать существующие стандарты ведения пациентов с ВЗК. Важно обеспечить более раннюю и качественную медицинскую помощь каждому пациенту, разрешить ему участвовать в построении лечебного плана, повышая тем самым приверженность лечению. Также необходимо увеличить количество центров ВЗК в нашей стране с самыми высокими стандартами оказания специализированной медицинской помощи, которые будут объединять мультидисциплинарный подход к лечению данных заболеваний.
Роль хирурга в лечении пациентов с болезнью Крона
В своем выступлении Андрей Олегович АТРОЩЕНКО (хирург отдела гнойной хирургии Центрального научно-исследовательского института гастроэнтерологии) отметил роль хирурга в лечении БК. Как известно, БК – хроническое рецидивирующее, прогрессирующее заболевание ЖКТ неясной этиологии, характеризующееся трансмуральным сегментарным распространением воспалительного процесса с развитием местных и системных осложнений.
При естественном течении БК количество хирургических вмешательств у больных достигает 60% при десятилетнем наблюдении8. Помощь хирурга гастроэнтерологу необходима в случае тяжелых, рефрактерных форм БК, развития стриктурирующих и пенетрирующих осложнений заболевания. Однако резекция пораженных участков ЖКТ не является излечением от БК. Частота рецидивов после хирургических вмешательств без лекарственной терапии достаточно высока: эндоскопический рецидив – до 90% в течение года, клинический – до 75% в течение 15 лет, хирургический – до 40% в течение 10 лет9.
Длительная послеоперационная медикаментозная терапия проводится во избежание повторных операций и тяжелых рецидивов.
Несомненно, разработка индивидуализированной тактики лечения больных БК должна происходить в кругу мультидисциплинарной команды, состоящей из колопроктолога, гастроэнтеролога, врача-эндоскописта, специалиста лучевой диагностики, патоморфолога. Кроме того, необходимо учитывать мнение самого пациента. «Коллегиальное обсуждение каждого больного в ходе круглого стола помогает оптимизировать лечебную тактику для каждого индивидуального пациента и предложить ему наиболее эффективный алгоритм лечения», – подчеркнул А.О. Атрощенко (рис. 2).
Показанием к хирургической операции служит плохая переносимость или неэффективность медикаментозной терапии, когда нарастает интоксикация, развиваются метаболические нарушения, септические осложнения. Другими показаниями являются формирование свищей, абсцессов брюшной полости, наличие кишечного кровотечения, злокачественной трансформации тканей, кишечной непроходимости. При перфорации или подозрении на нее показано экстренное оперативное вмешательство.
Докладчик неоднократно подчеркивал, что хирургическое вмешательство не является лечением БК. Цели хирургического лечения при БК – борьба с осложнениями и улучшение качества жизни пациентов, когда медикаментозные средства неэффективны либо назначение адекватного лечения, способного предотвратить формирование осложнений, было задержано из-за поздней диагностики или других причин.
Операции у пациентов с БК сложны и требуют от врача хорошей хирургической техники. Хирургическая стратегия при БК заключается в максимальном сохранении длины тонкой кишки. Целесообразно выполнять разрез по средней линии с сохранением места для формирования стомы10.
Наиболее распространенными вариантами хирургического лечения при БК считается резекция пораженного отдела с формированием либо без формирования анастомоза или стриктуропластика. Выбор вида операции определяется протяженностью поражения кишки. При хирургическом лечении больных БК применяют также наложение обходного анастомоза и формирование стом (при терминальном состоянии, каловом перитоните, коагулопатии, не полностью санированном сепсисе, тяжелой кровопотере, длительной операции, выраженной гипоальбуминемии).
При БК необходимо избегать любых необоснованных избыточных резекций кишечника, поскольку в случае новых рецидивов заболевания пациенту может понадобиться повторная операция. Так, при резекции участка кишки со стриктурой или свищом проводят «экономную» резекцию – в пределах тканей с минимальными изменениями тонкой кишки, причем небольшие афтозные язвы могут быть оставлены для заживления на фоне адекватной медикаментозной терапии. По данным исследований, рецидив после резекции илеоцекального отдела кишечника без проведения медикаментозной терапии в 87% случаев локализуется проксимальнее анастомоза11.
В ходе одного исследования сравнивали технику формирования анастомоза – ручную и аппаратную. Выяснилось, что техника формирования анастомоза не влияет на последующие рецидивы заболевания (эндоскопические и хирургические), но влияет на количество послеоперационных осложнений. Несмотря на то что рецидив заболевания часто наступает в месте наложения предыдущего анастомоза, нет оснований утверждать, что техника наложения анастомоза («бок в бок», «конец в бок», «конец в конец», ручной метод наложения анастомоза или аппаратный) влияет на вероятность развития рецидива БК12.
Все чаще в лечении БК используется лапароскопическая методика. Данный метод резекции пораженного кишечника считается достаточно распространенным, редко вызывает серьезные осложнения. Однако существуют предикторы конверсии и возникновения осложнений после применения лапароскопического метода: обширное поражение тонкой и толстой кишки, пенетрирующая форма заболевания и повреждение верхних отделов ЖКТ13.
Эффективной техникой хирургического лечения больных БК является применение стриктуропластики. Показания к стриктуропластике при поражении тонкой кишки:
- диффузные поражения с множественными стриктурами тонкой кишки;
- стриктуры после предшествующих резекций;
- быстрый рецидив БК с непроходимостью;
- стриктуры при синдроме короткой кишки;
- фиброзные невоспалительные стриктуры.
Частота развития послеоперационных септических осложнений достигает 3,7%, кровотечение из места пластики развивается в 3,3% случаев. Общее количество осложнений при выполнении стриктуропластики составляет 13%. После выполнения стриктуропластики и ограниченной резекции кишечника потребность в повторных вмешательствах приблизительно одинакова. Факторами риска развития осложнений при выполнении стриктуропластики тонкой кишки являются тяжелое состояние пациента, обусловленное анемией, экстренные операции, гипоальбуминемия, абсцесс брюшной полости, выраженная потеря массы тела, пожилой возраст. Противопоказаниями к проведению стриктуропластики являются перфорация тонкой кишки в брюшную полость, флегмонозные изменения, внутренний или наружный свищ в зоне стриктуропластики, гипоальбуминемия (2,9 г/дл), множественные стриктуры на коротком участке, а также расположенные близко к участку резекции. При наличии стриктуры толстой кишки онкологический риск повышается до 50%. Клинически выраженное поражение двенадцатиперстной кишки при БК отмечается всего в 1–2% случаев, но считается сложным в клинической практике врачей-хирургов. В случаях, когда провести стриктуропластику невозможно, формируют обходной анастомоз.
Поражение толстой кишки встречается у 20–30% пациентов, страдающих БК.
При неэффективности консервативной терапии при панколите целесообразно проводить тотальную колпроктэктомию с илеостомией. Выполняется также сегментарная резекция при локализованном поражении либо субтотальная колэктомия при умеренном воспалении в прямой кишке (с формированием и без формирования анастомоза). Тотальная колпроктэктомия подразумевает интерсфинктерную резекцию с удалением внутреннего сфинктера и сохранением наружного. При субтотальной колэктомии с илеостомией удаляют большую часть ободочной кишки с сохранением какого-либо отдела. Этот вид хирургического лечения показан пациентам с выраженной интоксикацией, тяжелыми перианальными поражениями. Удаление прямой кишки выполняют через 6 месяцев, когда стихает воспалительный процесс. Сегментарная резекция толстой кишки проводится у пожилых пациентов или больных, перенесших обширные резекции тонкой кишки. Этот хирургический метод позволяет сохранить часть толстой кишки, но его отличает высокий процент возникновения рецидивов14.
Пациенты с БК, у которых развиваются свищи, требуют индивидуального и многопланового подхода. Перианальные свищи у больных БК возникают в 54% случаев, это наиболее часто встречающиеся формы свищей при БК, внутренние межкишечные – в 21%. Обследование больных с перианальными свищами должно включать фистулографию, компьютерную томографию и магнитно-резонансную томографию малого таза, трансректальную эндосонографию, обследование под анестезией. Правильное и своевременное обследование позволяет точно определить локализацию патологического процесса, разработать тактику лечения пациента.
Основными целями лечения свищевой формы БК являются дренирование гнойного очага, эрадикация свищевого хода, сохранение запирательной функции ануса.
А.О. Атрощенко отметил, что основным методом лечения свищевой формы БК остается медикаментозная терапия. Хирургические методы используются для предупреждения гнойно-септических осложнений или в качестве вспомогательного средства лечения15.
Лечение сложных свищей при БК заключается в дренировании абсцесса, назначении антибактериальной терапии, установке специального резинового дренажа, предотвращающего развитие абсцесса и флегмоны. При необходимости выполняют отключающую стому. Часть больных (10–15%) нуждается в выполнении проктэктомии и колэктомии. Пациентам назначают современные эффективные препараты – иммуносупрессоры, ингибиторы ФНО-альфа. Применение ГКС для лечения БК неоправданно при изолированной перианальной форме заболевания, они назначаются в стандартных дозах только при наличии активного воспаления в сегментах кишечника.
В терапии свищей при БК эффективны препараты инфликсимаб и адалимумаб. Субанализ рандомизированного плацебоконтролируемого исследования CHARM (Crohn’s Trial of the Fully Human Antibody Adalimumab for Remission Maintenance)16 продемонстрировал, что адалимумаб эффективен в таком компоненте, как полное закрытие исходно дренирующихся свищей. При этом эффективность была устойчивой в течение не менее года (рис. 3). Опубликованы также данные трехлетнего наблюдения за этими пациентами, в ходе которого эффект был достаточно стабилен17.
Наличие перианальных поражений является предиктором неблагоприятного течения БК18. На основании рекомендаций ECCO (2010) пациентам с БК, имеющим неблагоприятные прогностические факторы, показано раннее назначение тиопуринов, метотрексата и/или ингибиторов ФНО-альфа. В новой редакции рекомендаций ECCO (2014) ингибиторам ФНО-альфа в данной ситуации отводится уже бóльшая роль и отмечается целесообразность назначения в первую очередь этих препаратов в комбинации с иммуносупрессорами или без них.
Факторы, влияющие на частоту развития рецидива заболевания после резекции, – активное курение, пенетрирующая форма болезни, обширное поражение кишечника (более 50 см), перианальные поражения, предшествующая резекция. Из сказанного можно сделать следующие выводы:
- лечение БК зависит от локализации, распространения и тяжести поражения организма;
- лапароскопическая «экономная» резекция приемлема с учетом адекватной терапии;
- формирование анастомозов может увеличивать риск осложнений, но не влияет на рецидив заболевания;
- пациентам с высоким риском развития послеоперационного рецидива должно быть назначено профилактическое лечение.
Мультидисциплинарный подход и роль пациента в лечении болезни Крона (клиническая демонстрация и дискуссия)
В России, как и в большинстве стран мира, для лечения БК зарегистрированы и активно применяются два биологических препарата – инфликсимаб и адалимумаб.
Адалимумаб – моноклональные антитела, полностью идентичные человеческому IgG1, специфически блокирующие провоспалительный цитокин ФНО-альфа19. Блокирование ФНО-альфа приводит к подавлению иммуноопосредованного воспаления. В отличие от адалимумаба 25% аминокислотной последовательности в структуре инфликсимаба являются мышиной. Адалимумаб вводят под кожу, инфликсимаб – внутривенно. Фармакокинетические особенности данных препаратов имеют клиническое значение. Так, случаи тяжелых аллергических реакций после введения адалимумаба крайне редки, тогда как инфузионные реакции различной тяжести при лечении инфликсимабом регистрируются в 18% случаев20, 21.
Ирина Николаевна РУЧКИНА, д.м.н, ведущий специалист отделения лечения воспалительных заболеваний кишечника Центрального научно-исследовательского института гастроэнтерологии, продемонстрировала клинический случай течения БК.
Больной У., 1981 года рождения, 15 декабря 2012 г. поступил в ЦНИИГ с жалобами на диарею до 4–6 раз в сутки (стул кашицеобразный, без примесей), боли в эпигастральной области без четкой связи с приемом пищи, метеоризм. У пациента были зафиксированы слабость, лихорадка до 38,5 °С по вечерам, потеря массы тела – 4 кг за год, боли в тазобедренных суставах и затруднение передвижения при ходьбе, боли в плечевых и коленных суставах. Больной был направлен на обследование в ЦНИИГ врачами-ревматологами для исключения ВЗК в связи с предстоящей операцией эндопротезирования суставов. Из анамнеза известно, что боли в суставах у больного появились в 2010 г. Он самостоятельно принимал нестероидные противовоспалительные препараты (НПВП). Спустя 4–5 месяцев на фоне их приема у пациента развилась рвота с кровью. В хирургическом отделении диагностировали язву желудка (до 3 см) с признаками кровотечения. После безуспешной консервативной терапии больному проведена резекция желудка. В последующий период у пациента сохранились суставные боли, он наблюдался у терапевта и принимал НПВП. Постепенно состояние ухудшилось, появились неоформленный стул, лихорадка, сильные боли в суставах. Врачи-ревматологи предположили наличие аутоиммунного заболевания. Больному назначили системные стероиды (метипред, преднизолон), НПВП, Сорбифер Дурулес. На фоне терапии усилились боли в крупных суставах, повысилась температура тела. В ЦНИИГ пациенту проведено полное обследование. Клинический анализ крови показал наличие воспаления: снижение уровня гемоглобина (10,6 г/л), лейкоцитоз (18,2 × 109/л), повышение скорости оседания эритроцитов (СОЭ) до 81 мм/ч. В биохимическом анализе крови отмечено снижение уровня белка (52,5 г/л), альбумина (30,8 г/л), сывороточного железа (8,4 мкмоль/л), повышение уровня С-реактивного белка (50,4 мг/л).
Ультразвуковое исследование (УЗИ) брюшной полости, УЗИ кишечника, ректороманоскопия (осмотрено 25 см), фиброколоноскопия (осмотрено 15 см подвздошной кишки) без патологии. Эзофагогастродуоденоскопия показала наличие хронического гастрита культи желудка. Рентгенологическое исследование тонкой кишки – оперированный желудок по Бильрот II с удовлетворительной функцией гастроэнтероанастомоза, гипермоторная дискинезия тонкой кишки. По данным интестиноскопии, в тощей кишке множественные мелкоточечные геморрагии, продольные язвенные дефекты, псевдополипы.
Диагноз: БК тонкой кишки, впервые выявленная, в форме эрозивно-язвенного еюнита, активная фаза тяжелого течения. Синдром нарушенного всасывания II степени тяжести с нарушением всех видов обмена веществ. Гипопротеинемия, хроническая анемия смешанной этиологии. Внекишечные проявления – артропатия, двусторонний коксартроз.
Пациенту назначено лечение: метипред 1мг/кг, азатиоприн 2 мг/кг/сут, ингибиторы протонной помпы (лансопразол 30 мг/сут), антибактериальная терапия (Метрогил 1000 мг/сут), полиэлектролитные смеси, аминокислоты, альбумин, препараты железа внутривенно. Пациенту 11 января 2013 г. назначили адалимумаб (Хумира®): в 1-й, 2-й и на 15-й день – по 80 мг, на 29-й день 40 мг. Положительный эффект был достигнут после трех введений препарата: нормализовались стул и температура, показатели уровня С-реактивного белка в крови снизились до 25 мг/л, СОЭ – до 45 мм/ч (рис. 4).
Через два месяца от начала терапии больному отменили прием метипреда. Он продолжал получать хондропротекторы, азатиоприн. Пациенту 27 июля 2013 г. провели эндопротезирование правого тазобедренного сустава. В течение года наблюдения больного обострения БК не отмечалось, достигнута стойкая ремиссия. В данном случае выбор ингибитора ФНО-альфа был продиктован очевидным физическим ограничением больного и невозможностью приходить в клинику для осуществления внутривенных инфузий. Пациент был обучен технике самостоятельных инъекций адалимумаба. В данном случае выбор пациента обеспечил хорошую приверженность лечению.
В Японии проводилось анкетирование среди больных, получавших лечение препаратом Хумира® в виде самостоятельных подкожных инъекций. Если до начала терапии 38% пациентов отказывались от самостоятельных инъекций, то после начала терапии 75% были полностью удовлетворены лечением, а 93% хотели продолжать самостоятельно вводить препарат, считая это удобным22.
И.Н. Ручкина подчеркнула важность мультидисциплинарного подхода к лечению больных ВЗК. Взаимодействие врачей при постановке диагноза и выборе терапевтической тактики – обязательное условие для эффективного лечения заболеваний. При подозрении на ВЗК пациентов необходимо без промедления направлять в специализированные медицинские центры для уточнения диагноза и подбора терапии. Ранняя диагностика ВЗК и использование современных биологических препаратов позволяют достичь устойчивой безстероидной ремиссии заболевания.
Заключение
Для улучшения отдаленных исходов лечения ВЗК требуется взаимодействие разных специалистов (гастроэнтерологов, колопроктологов, патоморфологов, врачей эндоскопистов и специалистов УЗИ и лучевой диагностики), а также создание в структуре здравоохранения специализированных подразделений – центров ВЗК. Для улучшения приверженности лечению немаловажно обучение пациентов и учет их мнения при планировании лечебной тактики.
1. Colombel J., Rutgeerts P., Sandborn W.J. et al. Deep remission predicts long-term outcomes for adalimumab-treated patients with Crohn’s disease: data from EXTEND. Gut. 2010:59:A80.
2. Marco Greco; ECCO 2012 (data from IMPACT: online survey of IBD patients; charts, tables and graphs available at http://www.efcca-solutions.net/impact/european.php).
3. Van Assche G., Dignass A., Panes J. et al. The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: Definitions and diagnosis // J. Crohns Colitis. 2010. Vol. 4. № 1. P. 7–27.
4. Baars J.E., Markus T., Kuipers E.J. et al. Patients’ preferences regarding shared decision-making in the treatment of inflammatory bowel disease: results from a patient-empowerment study // Digestion. 2010. Vol. 81. № 2. P. 113–119.
5. Munkholm P., Langholz E., Davidsen M. et al. Frequency of glucocorticoid resistance and dependency in Crohn’s disease // Gut. 1994. Vol. 35. № 3 P. 360–362.
6. Yang Y.X., Lichtenstein G.R. Corticosteroids in Crohn’s disease // Am. J. Gastroenterol. 2002. Vol. 97. № 4. P. 803–823.
7. Ferrante M., Karmiris K., Newnham E. Physician perspectives on unresolved issues in the use of conventional therapy in Crohn’s disease: results from an international survey and discussion programme // Crohns Colitis. 2012. Vol. 6. № 1. P. 116–131.
8. Veloso F.T., Ferreira J.T., Barros L. et al. Clinical outcome of Crohn’s disease: analysis according to the vienna classification and clinical activity // Inflamm. Bowel. Dis. 2001. № 4. P. 306–313.
9. Bernell O., Lapidus A., Hellers G. Risk Factors for Surgery and Postoperative Recurrence in Crohn’s Disease // Ann Surg. 2000. Vol. 231. № 1. P. 38.
10. Fazio V.W., Marchetti F., Church M. et al. Effect of resection margins on the recurrence of Crohn’s disease in the small bowel. A randomized controlled trial // Ann. Surg. 1996. Vol. 224. № 4. P. 563–571.
11. Yamamoto T., Reese G., Purkayastha S. et al. Strictureplasty vs resection in small bowel Crohn’s disease: an evaluation of short-term outcomes and recurrence // Colorectal. Dis. 2007. Vol. 9. № 8. P. 686–694.
12. Lichtenstein G.R., Hanauer S.B., Sandborn W.J. et al. Management of Crohn’s disease in adults // Am. J. Gastroenterol. 2009. Vol. 104. № 2. P. 465–483.
13. Okabayashi K., Hasegawa H., Watanabe M. et al. Indications for laparoscopic surgery for Crohn’s disease using the Vienna Classification // Colorectal. Dis. 2007. Vol. 9. № 9. P. 825–829.
14. Polle S.W., Slors J.F., Weverling G.J. et al. Recurrence after segmental resection for colonic Crohn’s disease // Br. J. Surg. 2005. Vol. 92. № 9. P. 1143–1149.
15. Steele S.R., Kumar R., Feingold D.L.et al. Practice parameters for the management of perianal abscess and fistula-in-ano // Dis Colon Rectum. 2011. Vol. 54. № 12. P. 1465–1474.
16. Colombel J.F., Sandborn W.J., Rutgeerts P. et al. Adalimumab for maintenance of clinical response and remission in patients with Crohn’s disease: The CHARM Trial // Gastroenterology. 2007. Vol. 132. № 1. P. 52–65.
17. Colombel J.F., Schwartz D.A., Sandborn W.J. et al. Adalimumab for the treatment of fistulas in patients with Crohn’s disease // Gut. 2009. Vol. 58. № 7. P. 940–948.
18. Beaugerie L., Seksik P., Nion-Larmurier I. et al. Predictors of Crohn’s disease // Gastroenterology. 2006. Vol. 130. № 3. P. 650–656.
19. Инструкция к применению препарата Хумира®.
20. Humira®. Summary of Product Characteristics. Дата обращения: февраль 2014.
21. Remicade®. Summary of Product Characteristics. Дата обращения: февраль 2014.
22. Kubokura N., Hirai F., Watanabeet K. et al. Investigation on patient assessment of adalimumab self-injection treatment – a multicenter patient questionnaire Pearl survey. Abstract P463 presented at ECCO 2013.
Новости на тему
04.10.2019
Отправить статью по электронной почте
Ваш адрес электронной почты:
1.
Это стало возможно благодаря внедрению в клиническую практику биологических препаратов, в частности ингибиторов фактора некроза опухоли альфа. Участники симпозиума, состоявшегося в рамках ХХХХ юбилейной сессии Центрального научно-исследовательского института гастроэнтерологии (Москва, 5 марта 2014 г.), рассмотрели вопросы улучшения оказания помощи пациентам с ВЗК.
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
