Лекарственное повреждение печени, индуцированное приемом витаминов А и E
- Аннотация
- Статья
- Ссылки
- English
Введение
Лекарственные поражения печени (ЛПП) – одна из распространенных причин ее дисфункции [1, 2]. Гепатотоксические свойства и клинические проявления в виде печеночного цитолиза, которыми характеризуются современные препараты, а таковых насчитывается более тысячи, приводят к печеночной недостаточности [1–4].
В международной базе данных по мониторингу побочных действий лекарственных средств (Vigi Base) Всемирной организации здравоохранения (World Health Organization) за 2016 г. содержалось 13 208 000 отчетов об индивидуальных неблагоприятных реакциях на препараты (ICSR – Individual Case Safety Report) [5–7].
В европейских странах и США ЛПП наблюдаются в среднем у 15 из 100 тыс. пациентов, использующих лекарственные средства (ЛС) [2, 8]. Острый гепатит и печеночная недостаточность развиваются в 10% случаев ЛПП [1, 8]. Согласно результатам проспективных исследований, хроническое течение отмечается в 7–14% ЛПП, показатели летальности или трансплантации органа варьируются от 3,7 до 11% [9–11].
ЛПП могут быть вызваны применением не только ЛС, но также растительных и поливитаминных биологически активных добавок (БАД) [12–14]. Эффективность БАД весьма сомнительна. Тем не менее они популярны среди населения. Количество зарегистрированных повреждений печени в результате их употребления ежегодно возрастает [14–16]. По данным ряда реестров ЛПП, доля подобных ЛПП колеблется от 2 до 20% всех выявленных случаев [17–19].
Согласительный консенсус по использованию ряда витаминов отсутствует. Между тем их употребление лицами обоего пола, ведущими здоровый образ жизни, возрастает [14, 16]. Врачи и пациенты недооценивают возможность развития гепатотоксического эффекта вследствие бесконтрольного приема витаминов [14, 16].
Во многих исследованиях продемонстрированы индивидуальные особенности гепатотоксичности аюрведических и китайских трав, зеленого чая, гербалайфа, в том числе витаминов А и E [20–23]. Жирорастворимые витамины А и E чаще рассматриваются как антиоксиданты, которые тормозят реакции, предупреждающие образование свободных радикалов, повреждающих клеточные мембраны [24–26]. Однако на фоне нарушения режима приема или сбоя в гепатобилиарной системе они оказывают токсическое воздействие на печень [25–27]. Более опасной считается передозировка этих витаминов при наличии острых и хронических заболеваний желудочно-кишечного тракта, в частности печени [27, 28]. Из побочных эффектов передозировки витамина E следует отметить угнетающее воздействие на процесс свертывания крови и, как следствие, возможные кровотечения [26].
В ряде исследований у пациентов вследствие передозировки витамина А развивались ЛПП в виде гепатита, нецирротической портальной гипертензии (НПГ), цирроза печени [26–28].
G. Bucciol и соавт. в 2018 г. и Т. Mounajjed и соавт. в 2014 г. объяснили развитие НПГ при гипервитаминозе А облитерацией пространства Диссе в результате гиперплазии и гипертрофии звездчатых клеток, стимулированных липидными вакуолями их цитоплазмы, аккумулирующими ретинол [29, 30]. Дальнейшая активация клеток Ито может приводить к их трансформации в миофибробласты с выработкой большого количества коллагена и развитию перисинусоидального фиброза печени с формированием цирроза [30, 31]. Внутриклеточное удержание витамина А способствует не только прогрессированию фиброза, но и развитию канцерогенеза [30, 31].
При гипервитаминозе E зарегистрирована повышенная смертность по разным причинам [32, 33]. Тяжесть поражения печени в результате сочетанного гипервитаминоза А и E варьируется от легкого гепатита до острой печеночной недостаточности, требующей трансплантации [34, 35].
Витамин А (ретинол и другие ретиноиды) является основным компонентом для функционирования сетчатой оболочки глаза, поскольку образует зрительный пурпур родопсин, необходимый для зрительной адаптации в темноте [20, 28]. Витамин А в различных биохимических процессах играет роль кофактора, повышает митотическую активность эпителиальных клеток, а также предотвращает гиперкератоз через синтез РНК и сульфатированные мукополисахариды [20, 21, 28]. Ретинол всасывается в тонкой кишке при участии желчных кислот. Из кишечника он поступает в печень, где около 90% депонируется в звездчатых клетках. Суточная потребность в витамине А взрослого человека около 3000–3500 МЕ [26, 28].
Функция витамина E (альфа-токоферола) до конца не изучена. Структура витамина E делает его высокоэффективным антиоксидантом, он тормозит свободнорадикальные реакции, предупреждает образование перекисей, оказывающих повреждающее воздействие на клеточные мембраны, что обеспечивает функционирование нервной и мышечной систем [22–34]. Альфа-токоферол, находясь внутри фосфолипидного слоя клеточных мембран, защищает клеточные мембраны от окисления свободными радикалами [24]. Совместно с селеном он тормозит гемолиз эритроцитов, является кофактором некоторых ферментных систем – восстанавливает капиллярное кровообращение и повышает устойчивость тканей к гипоксии [23].
Гепатотоксичность витамина А
В 1937 г. швейцарскому химику Р. Karrer была присуждена Нобелевская премия по химии за работу «Исследование каротиноидов и флавинов», а также за изучение витаминов А и В2 [36]. В клинической практике витамин А применяют в целях лечения и профилактики его дефицита. Высокие дозы жирорастворимых витаминов содержат многие БАД, как правило бесконтрольно используемые населением. Как следствие – увеличение частоты случаев хронической интоксикации жирорастворимыми витаминами [22, 34]. Только в США ежегодно регистрируется 10–15 случаев подобной хронической интоксикации [8–10].
Тяжелое повреждение печени в результате хронической интоксикации развивается при использовании высоких доз витамина А (> 40 000 МЕ/сут в течение нескольких лет) или сверхвысоких доз в течение непродолжительного периода (> 100 000–200 000 МЕ/сут в течение дней/недель) [26, 28]. Около 90% общего витамина А находится в печени, в основном в звездчатых клетках, которые склонны активироваться, приобретая миофибробластоподобный фенотип и производя большое количество внеклеточного матрикса [31].
Гистопатологическая картина при заболеваниях печени, обусловленных применением витамина А, характеризуется гиперплазией звездчатых клеток печени с наличием крупных, заполненных липидами вакуолей в цитоплазме клеток при электронной микроскопии, и облитерацией пространства Диссе с отложениями коллагена, что вызывает портальную гипертензию [29, 30].
Ряд авторов обнаружили гистологическое сходство между заболеваниями печени, вызванными витамином А, и первичным билиарным холангитом. Это позволило рекомендовать урсодезоксихолевую кислоту в качестве терапии холестатических типов поражения печени [37].
В литературе описано несколько клинических случаев ЛПП в результате гипервитаминоза А [31, 34, 36, 38–40].
N.L. Jeoffrey и соавт. в 2015 г. диагностировали НПГ вследствие воздействия лекарственных средств и поливитаминных добавок. При однозначных признаках портальной гипертензии отсутствовали цирроз и тромбоз в системе воротной вены [38].
Тесную корреляционную связь между тяжестью перисинусоидального фиброза и суточной дозой ретинола в виде зависимости «доза – эффект» установили M.C. Nollevaux и соавт. в 2006 г. Ученые пришли к выводу, что витамин А в высоких дозах токсичен для печени и может приводить к циррозу [31].
A.P. Geubel и соавт. в 1991 г. опубликовали результаты исследования клинической симптоматики и морфологических характеристик печени 41 пациента с ЛПП, обусловленных применением витамина А. Гистологические характеристики свидетельствовали о гиперплазии жировых клеток с флуоресцентными вакуолями. Цирроз печени зарегистрирован у 17 больных, легкий хронический гепатит – у десяти, НПГ – у пяти, «повышенное содержание вакуолей витамина А» – у девяти пациентов. За 4,6 года наблюдения зарегистрировано шесть летальных исходов вследствие заболевания печени. Точный факт употребления витамина А доказан в 29 случаях. Среди них суммарный кумулятивный прием был самым высоким у больных циррозом печени (423 ± 103 × 106 МЕ) и значительно ниже у больных нецирротической болезнью печени (88,5 ± 41 МЕ; р < 0,02). Минимальное непрерывное ежедневное потребление 25 000 МЕ в течение шести лет приводило к циррозу, более высокие суточные дозы (≥ 100 000 МЕ) в течение двух с половиной лет – к аналогичным гистологическим изменениям. Авторы заключили, что хроническое потребление витамина А приводит к заболеваниям печени, причем длительное и непрерывное потребление витамина А в низких терапевтических дозах также может вызывать угрожающее жизни повреждение печени [39].
G.C. Farrell и соавт. в 1977 г. описали случай хронического гипервитаминоза А у 57-летней женщины, которая принимала витаминные препараты по поводу алопеции. Морфологическое исследование печени пациентки показало увеличение количества и размера клеток, накапливающих жир, при световой микроскопии, быстро исчезающую зеленую аутофлуоресценцию витамина А. Электронная микроскопия подтвердила присутствие насыщенных витамином А клеток, накапливающих жир, в пространстве Диссе и незначительные токсические изменения в гепатоцитах. Авторы констатировали наличие ранних морфологических изменений в ткани печени при хроническом гипервитаминозе А [34].
G. Hensley и соавт. в 2010 г. описали необычный случай внутрипеченочного холестаза, вызванного интоксикацией витамином А. Пациент ежедневно в течение 12 лет принимал коктейль HerbalifeTM с двумя мультивитаминными таблетками (суточная норма потребления витамина А). Нарушенные функциональные пробы печени соответствовали холестатическому синдрому. Биопсия печени выявила патогномоничные признаки гепатотоксичности витамина А без обычного фиброза. После прекращения приема БАД и мультивитаминов проявления холестаза были полностью купированы. Этот случай доказывает, что длительное употребление витамина А в низких дозах может вызывать холестатические повреждения печени [37].
H.J. Kistler и соавт. в 1977 г. наблюдали обратимость портальной гипертензии у пациента с псориазом, длительно использовавшего ретинол в чрезмерных количествах. Авторы представили клинический случай манифестации гипервитаминоза А с портальной гипертензией без гистологических признаков цирроза печени. Все характерные признаки хронической интоксикации были обратимы после отмены препарата, нарушенная функция печени нормализовалась, а признаки портальной гипертензии полностью исчезли [40].
В настоящее время не существует надежного метода подсчета оптимальной дозы витамина А. Уровни ретинола в крови не отражают его накопления в печени. Поэтому уровень витамина А может оставаться в пределах нормы, несмотря на доказанную гиперплазию звездчатых клеток печени и повреждение печени [31]. Наиболее чувствительным методом оценки состояния витамина А по отношению к его запасам в печени является тест на разбавление изотопов [41, 42].
Гепатотоксичность витамина E
Витамин E (альфа-токоферол, токотриенол) – жирорастворимый антиоксидант, известный как ингибитор перекисного окисления липидов [24, 25]. С учетом данного свойства токоферол рассматривается как протектор при сердечно-сосудистых заболеваниях и используется при ишемической болезни сердца [26]. Однако эксперименты на животных показали, что большие дозы этого витамина нарушают абсорбцию других жирорастворимых витаминов [26]. Длительный прием высоких доз витамина E может вызвать дефицит витаминов D, А и K [25, 26, 43]. Суточная потребность витамина E для мужчин составляет 13 мг/сут, для женщин – 10 мг/сут. Исходя из результатов проведенных исследований, при длительном применении в дозах до 300 МЕ серьезные побочные эффекты регистрировались редко [23, 28]. При длительном приеме токоферола в количестве, превышающем 800 МЕ/сут, возрастал риск развития кровотечений, особенно при дефиците витамина К. Тяжелая форма передозировки влечет за собой развитие тромбофлебита, закупорку кровеносных сосудов [23, 28, 43]. Так, данные метаанализа показывают повышение риска развития геморрагического инсульта на 20% при использовании витамина E. Применение высокодозной добавки витамина E приводит к статистически значимому увеличению общей смертности [33, 44]. Учитывая указанные риски, эксперты Американской ассоциации по изучению заболеваний печени рекомендуют использовать витамин E только у взрослых пациентов с неалкогольным стеатогепатитом, но не у больных сахарным диабетом и детей [45].
В одном из крупных обзоров литературы по гепатопротективным свойствам витамина E у человека и животных сказано, что витамин E характеризуется высоким гепатопротективным эффектом у животных, но не у человека. Гепатопротективное действие токоферола связано с уменьшением окислительного стресса в печени. При этом снижаются микросомальное перекисное окисление липидов, уровни фактора некроза опухоли, печеночного порфирина, воспаление и фиброз печени, нормализуются уровни аланинаминотрансферазы и аспартатаминотрансферазы, щелочной фосфатазы, билирубина, глутатиона и улучшаются гистопатологические изменения в печени [22, 35]. В связи с этим исследователи изучали роль витамина E при заболеваниях печени. Однако анализ гистологического эффекта добавок альфа-токоферола при неалкогольном стеатогепатите не показал гистологического улучшения по сравнению с плацебо [45]. У пациентов с хроническим гепатитом С высокие дозы альфа-токоферола значительно снижали окислительный стресс, но не влияли на ферменты печени или гистологические особенности повреждения [32].
В рандомизированном плацебоконтролируемом исследовании алкогольного гепатита не зафиксировано положительного эффекта на фоне применения витамина E в дозе 1000 МЕ/сут [33].
Гепатотоксичность сочетанного применения витаминов А и Е
В литературе описаны единичные случаи ЛПП, спровоцированные одновременным приемом высоких доз жирорастворимых витаминов. Как правило, это отдельные наблюдения, связанные с гипервитаминозом А и E [35]. Самые опасные осложнения гипервитаминоза А и E – инфаркт миокарда, сепсис, расстройство центральной нервной системы. При назначении высоких доз появляются сонливость, головная боль и тошнота [25, 35]. Избыток витаминов А и E блокирует всасывание витамина K, возможно в результате конкурентного действия при диффузии в проксимальном отделе тонкой кишки [26]. В результате такого ферментативного процесса остатки глутаминовой кислоты превращаются в остатки гамма-карбоксилглутаминовой кислоты (Gla-радикалы). Gla-радикалы благодаря двум свободным карбоксильным группам участвуют в связывании кальция и играют важную роль в биологической активности всех известных Gla-белков [28]. Gla-белки участвуют в регулировании свертывания крови (протромбин (фактор II), факторы VII, IX, X, белки C, S и Z), метаболизме костной ткани (остеокальцин – Gla-белок кости или матрица Gla-белка) [35, 43].
G. Bjelakovic и соавт. в 2007 г. провели метаанализ 68 рандомизированных исследований с участием 232 606 пациентов (385 публикаций), посвященный влиянию антиоксидантных добавок на смертность от всех причин. Доказано, что и витамин А (относительный риск (ОР) 1,16; 95%-ный доверительный интервал (ДИ) 1,10–1,24), и витамин E (ОР 1,04; 95% ДИ 1,01–1,07) отдельно или в совокупности значительно повышают смертность. Одновременное лечение бета-каротином, витамином А и витамином E также повышает летальность [44].
Клиническое наблюдение
Больная Л. 23 лет, домохозяйка, поступила в Центр диагностики заболеваний печени Московского клинического научно-практического центра им. А.С. Логинова в сентябре 2018 г. с жалобами на тяжесть в правом подреберье и эпигастральной области, общую слабость, сухость кожи, выпадение волос, увеличение живота, отеки нижних конечностей. Пациентка в течение двух лет самостоятельно для «общего оздоровления» принимала препарат Аевит (комплекс жирорастворимых витаминов А и Е) в повышенных дозах (15 капсул в сутки), что соответствовало 1500 МЕ/сут альфа-токоферола ацетата и 1 500 000 МЕ/сут ретинола. Использование травяных добавок, чаев, наркотических и любых других ЛС отрицала, алкоголь употребляла крайне редко. Семейный анамнез без особенностей. При физическом осмотре – субиктеричность склер, увеличение печени на 1,5 см из-под края реберной дуги, селезенки на 3 см. Признаков печеночной энцефалопатии нет. Начальные лабораторные исследования выявили умеренное повышение уровней аспартатаминотрансферазы – 62,4 МЕ/л, щелочной фосфатазы – 251 МЕ/л, гипоальбуминемию (альбумин – 30 г/л). Гемоглобин – 114,0 г/л, эритроциты – 3,58 × 106/мкл, лейкоциты – 3,8 × 109/л, тромбоциты – 97,0 × 103/мкл. Остальные лабораторные показатели, включая уровни глюкозы и креатинина, в пределах нормы. Больной начато внутривенное введение адеметионина. Проведена полная оценка причин повреждения печени: исключен вирусный гепатит (гепатит A, B, C и E), вирус иммунодефицита человека, аутоиммунный гепатит (исследован полный спектр аутоантител, уровень иммуноглобулина G), исключены системные воспалительные заболевания (системная склеродермия, синдром Шегрена), болезни накопления, в частности болезнь Вильсона. Этиологию повреждения печени предварительно определили как связанную с ЛС. При ультразвуковом исследовании (УЗИ) брюшной полости выявлены диффузные изменения печени, гепатоспленомегалия, портальная гипертензия, небольшой асцит. По данным фиброэластометрии печени, эластичность – 13,3 кПА, что соответствовало стадии F4 по шкале METAVIR, то есть циррозу печени. Была проведена стандартизированная оценка причинной связи и степени тяжести повреждения печени по шкале Русселя Юклафа (RUCAM), согласно которой этиологическая связь с ЛС (Аевит) была определена с высокой вероятностью (≥ 7 баллов).
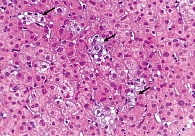
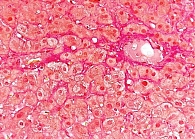
На основании результатов лабораторных и инструментальных исследований (цитолитический и холестатический синдромы, синдром гиперспленизма, выраженный фиброз печени при фиброэластометрии, УЗИ-признаки портальной гипертензии) установлен предварительный клинический диагноз: цирроз печени лекарственной этиологии, минимальной биохимической активности с синдромом холестаза, класс В по шкале Чайлда – Пью (6 баллов), портальная гипертензия – расширение воротной и селезеночной вен, спленомегалия, синдром гиперспленизма – латентная тромбоцитопения, лейкопения легкой степени, печеночная энцефалопатия 0–1-й степени. Для верификации диагноза выполнена биопсия печени. Гистологических признаков цирроза печени не выявлено. При окраске биоптата на медь болезнь Вильсона исключена. При окрашивании на железо изменений, характерных для гемохроматоза, не обнаружено. Патоморфологическое заключение свидетельствовало о фокальном лобулярном гепатите лекарственной этиологии (гипервитаминоз А) (рис. 1 и 2). Морфологическое заключение: хронический фокальный лобулярный гепатит низкой степени активности, вероятнее всего лекарственной этиологии (гипервитаминоз А). Активность по METAVIR A1, стадия фиброза F1.
По данным биопсии печени, диагностирован лекарственный гепатит вследствие гипервитаминоза А. Дополнительно выполнено дуплексное сканирование сосудов брюшной полости и сосудов печени для уточнения наличия портальной гипертензии. Выявлено увеличение диаметра вен портальной системы (воротная вена – 14,5 мм, селезеночная – 8,8 мм), свидетельствовавшее об умеренно выраженных признаках внепеченочной формы портальной гипертензии с повышением скоростных показателей по висцеральным артериям.
Заключение
У больной Л. 23 лет, принимавшей длительно препарат Аевит в повышенных дозах, развился гипервитаминоз А и Е, клинически проявившийся астеническим, отечно-асцитическим, цитолитическим и холестатическим синдромами. На основании клинических данных и результата фиброэластометрии печени предварительно диагностирован цирроз печени. Однако результаты морфологического исследования не подтвердили цирроз печени и показали характерную гистологическую картину лекарственного гепатита. Развитие НПГ скорее всего было вызвано облитерацией пространства Диссе в результате гиперплазии и гипертрофии звездчатых клеток, стимулированных липидными вакуолями, аккумулирующими в их цитоплазме ретинол. Результаты фиброэластометрии, показавшие выраженный фиброз печени, можно объяснить завышением показателей на фоне значительного количества жировых вакуолей в структуре печени.
Заключительный диагноз был сформулирован как лекарственный гепатит, индуцированный гипервитаминозом А и E, низкой биохимической активности с синдромом холестаза, A1, F1 по шкале METAVIR, НПГ.
Пациентке при выписке из стационара было рекомендовано продолжить гепатопротективную терапию препаратом урсодезоксихолевой кислоты в дозе 750 мг/сут, исключить прием любых лекарственных препаратов (в том числе поливитаминных биодобавок). После трехмесячного амбулаторного наблюдения у пациентки не зарегистрировано прогрессирования симптомов заболевания, она сообщила о хорошем самочувствии. Повторные функциональные тесты печени не выявили отклонений от нормальных величин. Признаки портальной гипертензии не определялись, что еще раз свидетельствовало в пользу диагноза НПГ, которая регрессирует при устранении этиологического фактора.
L.N. Gendrikson, PhD, Ye.V. Vinnitskaya, MD, PhD, S.G. Khomeriki, MD, PhD, T.Yu. Кhaymenova, PhD, Ye.S. Sbikina, Yu.G. Sandler, PhD
A.S. Loginov Moscow Clinical Scientific and Practical Center
Contact person: Larisa N. Gendrikson, gendrikson@bk.ru
According to DILIN (Drug Induced Liver Injury Network), drug-induced liver injury (DILI) has increased significantly as a result of the use of vitamin drugs by men and women leading a healthy lifestyle. The greatest danger is the uncontrolled use of drugs in high doses, leading to toxic damage to the liver. DILI can be caused by taking high doses of vitamins A and E. А literature review on DILI is presented as a result of taking drugs and dietary supplements containing vitamins А and E. A number of studies demonstrate an increase in hepatic transaminases, the development of non-cirrhotic portal hypertension, hepatitis and cirrhosis of the liver in hypervitaminosis A, severe liver lesions leading to transplantation. A high risk of hemorrhagic stroke and even an increase in mortality from various causes were noted in hypervitaminosis E, and especially in the combined use of high doses of both vitamins. The article presents a rare case of DILI associated with uncontrolled intake of high doses of the combined vitamin preparation Aevit. There was a 23-year-old woman without an alcoholic history with ascitic syndrome, hepatodepression syndrome without jaundice, who independently took the drug Aevit daily for 15 capsules for two years. The disease made its debut with the appearance of edematous-ascitic syndrome. A thorough study ruled out viral hepatitis (A, B, C, and E), autoimmune, toxic, ischemic, and metabolic etiology, including Wilson’s disease. Aevit was identified with a high degree of probability as an etiological factor of DILI. According to the results of liver biopsy, chronic focal lobular hepatitis of medicinal etiology was diagnosed. Non-cirrhotic portal hypertension caused by vitamin А, hypervitaminosis was diagnosed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.