Поражение печени при COVID-19: эпидемиология, патогенез, лечение
- Аннотация
- Статья
- Ссылки
- English
Введение
В декабре 2019 г. в г. Ухане (Китай) был обнаружен новый коронавирус, названный коронавирусом тяжелого острого респираторного синдрома 2 (severe acute respiratory syndrome-related coronavirus 2 – SARS-CoV-2), впоследствии ставший причиной пандемии COVID-19 (от англ. COronaVIrus Disease 2019). К маю 2022 г. во всем мире от новой коронавирусной инфекции (НКИ) умерло 6,26 млн человек. В России данный показатель составил около 370 тыс. [1]. Помимо поражения респираторной системы SARS-CoV-2 обусловливает развитие патологических изменений и в других органах. Как показали результаты исследований, у пациентов с COVID-19 могут возникать отклонения в работе печени различной степени выраженности.
Эпидемиология поражения печени при COVID-19
Дисфункция печени при COVID-19 чаще развивается у мужчин, пожилых людей и лиц с более высоким индексом массы тела. Нарушения функции печени, по данным лабораторных исследований, затрагивают более одной трети стационарных пациентов, ухудшая их прогноз, увеличивая риск тяжелой инфекции SARS-CoV-2 и удлиняя продолжительность госпитализации [2].
Согласно обзорным данным Y. Cai и соавт., для оценки функции печени у пациентов с НКИ чаще используют уровни печеночных трансаминаз, билирубина и альбумина. Аномальные уровни аланинаминотрансферазы (АЛТ) выявляются у 11,0–56,3% пациентов с COVID-19, аспартатаминотрансферазы (АСТ) – у 15,0–86,8%, общего билирубина – у 2,7–30,6%. При этом предшествующее заболевание печени имеют всего 2–11% таких пациентов [3].
В исследовании N. Chen и соавт. с участием 99 пациентов с пневмонией SARS-CoV-2 повышение уровней АЛТ, АСТ и билирубина наблюдалось в 28, 35 и 18% случаев соответственно. В то же время гипоальбуминемия зарегистрирована у 98% больных [4].
В работе J. Wang и соавт. среди 228 пациентов с COVID-19 без предшествующего хронического заболевания печени (ХЗП) нарушения функции органа отмечались у 129 (56,3%) пациентов, в том числе повышение уровней АЛТ – у 36,8% больных, АСТ – у 25,4%, общего билирубина – 25,9%, гамма-глутамилтранспептидазы (ГГТП) – у 29,5% пациентов [5]. При этом степень отклонения печеночных показателей от нормальных значений, согласно ряду исследований, коррелирует с тяжестью заболевания НКИ. Например, в публикации С. Huang и соавт. сообщается, что среди пациентов, получавших лечение в отделении реанимации и интенсивной терапии (ОРИТ), высокие уровни аминотрансфераз имели место у 62% больных, а среди пациентов, находившихся не в ОРИТ, – у 25% [6].
В большом многоцентровом исследовании аномально повышенные уровни АЛТ выявлены у 28,1% пациентов в критическом состоянии и 19,8% – в некритическом, АСТ – у 39,4 и 18,2% больных соответственно [7].
По данным A. Gupta и соавт., картина гепатоцеллюлярного повреждения может наблюдаться у 14–53% госпитализированных пациентов в критическом состоянии. При этом уровень аминотрансфераз повышается, как правило, не более чем в пять раз относительно верхней границы нормы [8].
В японском когортном исследовании, посвященном COVID-19, пациентов разделили на группы легкой, средней и тяжелой степени на основании тяжести пневмонии и желудочно-кишечных симптомов. По итогам подсчетов пиковые уровни аминотрансфераз были стратифицированы в соответствии с тяжестью состояния. Так, у пациентов с легким течением COVID-19 медиана АСТ составила 28 МЕ/л, медиана АЛТ – 33 МЕ/л, у пациентов со средней степенью тяжести – 48 и 47,5 МЕ/л соответственно, у пациентов с тяжелым течением НКИ – 109 и 106 МЕ/л соответственно [9].
В метаанализ K. Wijarnpreecha и соавт. было включено 64 исследования с участием 11 245 пациентов с COVID-19. Глобальная распространенность повышенного уровня АСТ составила 23,2%, АЛТ – 21,2%, общего билирубина – 9,7%, ГГТП – 15,0%, щелочной фосфатазы (ЩФ) – 4,0%. Среди пациентов с тяжелым течением НКИ повышение уровня АСТ наблюдалось значительно чаще – около 45,5% случаев, при нетяжелом течении – 15,0%. Сопутствующее ХЗП при этом регистрировалось у 37,6% пациентов с COVID-19 [10].
Другой систематический обзор и метаанализ 24 исследований, включавший суммарно 12 882 пациентов с COVID-19, выявил повышение уровней АСТ в 41,1% и АЛТ в 29,1% случаев. Средняя распространенность сопутствующих ХЗП составила 2,6%. Острое поражение печени (acute liver injury), связанное с COVID-19, было диагностировано у 26,5% больных (в разных исследованиях, вошедших в данный метаанализ, критерии острого поражения печени варьировали: оценивалось наличие желтухи и повышение печеночных ферментов (АЛТ, АСТ, ЩФ, ГГТП, билирубин) определенной кратности). При этом наличие исходной коморбидной патологии печени, по результатам данного метаанализа, существенно не влияло на прогноз. В то же время прочие состояния были значимо связаны с более высокими шансами неблагоприятных исходов. В частности, острое поражение печени увеличивало риски таких исходов на 68%, повышение уровня АЛТ – на 85%, а повышение уровня АСТ – практически в три раза [11].
В исследовании с участием 2073 пациентов также установлено, что повышенные уровни АСТ и прямого билирубина служат независимыми предикторами смертности, связанной с COVID-19 [12].
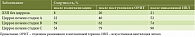
В крупной международной когорте из 745 пациентов с ХЗП и циррозом печени из 29 стран с использованием регистров SECURE-Cirrosis и COVID-Hep показано, что исходное алкогольное поражение печени – единственная этиология, достоверно повышающая риск смерти на 79% у пациентов с COVID-19. Наличие цирроза печени, а также его тяжесть значимо влияли на прогноз таких больных (таблица) [13]. A.M. Moon и соавт. определили исходный класс цирроза печени по шкале Чайлда – Пью как значимый предиктор смертности у пациентов, инфицированных SARS-CoV-2 [14].
Механизмы повреждения печени при COVID-19
Как известно, SARS-CoV-2 характеризуется тропностью к клеткам, экспрессирующим рецепторы ангиотензинпревращающего фермента 2 (ACE2). Для проникновения в клетку вирусом используется клеточная трансмембранная сериновая протеаза 2 (TMPRSS2), которая расщепляет S-протеин (Spike-белок) SARS-CoV-2 [15]. В печени такие рецепторы выявляются на холангиоцитах и в меньшей степени на гепатоцитах [16].
По данным M. Du, экспрессия АСЕ2 в клетках желчных протоков в 20 раз превышает таковую в клетках печени [17]. Х. Chai и соавт. установили, что уровни экспрессии ACE2 в холангиоцитах сопоставимы с таковыми в альвеолярных клетках легких [18]. В исследовании Y. Wang электронная микроскопия печени двух умерших пациентов с COVID-19 позволила определить вирусные структуры в гепатоцитах, отчетливо напоминающие вирионы SARS-CoV-2. Однако для подтверждения прямого цитопатического действия вируса на гепатоциты требуются дальнейшие исследования [19].
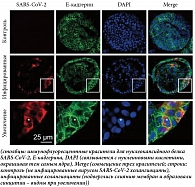
Для оценки влияния SARS-CoV-2 на гепатоциты проводилось их заражение in vitro. Через 24 часа после инфицирования количество геномной РНК SARS-CoV-2, по результатам полимеразной цепной реакции (ПЦР), резко увеличивалось, что подтверждалось иммуногистохимическим исследованием. Аналогичные результаты репликации вируса получены при заражении in vitro холангиоцитов взрослого человека, причем сами холангиоциты формировали синцитии (ткань с неполным разграничением клеток, при котором обособленные участки цитоплазмы с ядрами связаны между собой цитоплазматическими мостиками) (рис. 1) [20, 21]. Эти наблюдения показывают, что клетки печени человека могут быть восприимчивы к инфекции SARS-CoV-2 in vitro, и предполагают, что репликация вируса также может происходить in vivo. Несмотря на значительно более высокую экспрессию ACE2 в холангиоцитах по сравнению с гепатоцитами, до сих пор нет прямых доказательств холангиоцеллюлярной инфекции SARS-CoV-2 у пациентов с COVID-19 [15]. Повышенные уровни ЩФ и ГГТП косвенно свидетельствуют о повреждении холангиоцитов коронавирусом, но большинство наблюдений показали, что аномальные уровни АСТ и АЛТ при НКИ встречаются чаще. Исследователи предполагают, что повреждение клеток желчных протоков, вызванное SARS-COV-2, приводит к их компенсаторной гиперплазии, что в свою очередь активирует экспрессию рецептора ACE2 в гепатоцитах, обусловливая возможность их инфицирования и возникновения гепатоцеллюлярного поражения [17].
Вместе с тем холангиопатия рассматривается как одно из поздних осложнений тяжелой формы COVID-19 с потенциалом прогрессирующего поражения желчевыводящих путей и печеночной недостаточности. Появление клинико-лабораторных симптомов холестаза наблюдалось у пациентов разного возраста (25–75 лет) после тяжелой НКИ (обычно c госпитализацией в ОРИТ) в течение нескольких месяцев после выздоровления (1–6 месяцев, в среднем через три-четыре месяца). Заболеваний печени в анамнезе до COVID-19 не было, другие возможные причины поражения исключались, в связи с чем в настоящее время подобные изменения рассматриваются как вторичный склерозирующий холангит. При обследовании 12 таких пациентов с холангиопатией при магнитно-резонансной холангиопакреатографии были выявлены: углубление внутрипеченочных протоков (11 (92%) пациентов), утолщение стенки желчных протоков с усилением (7 (58%)) и высокий сигнал перибилиарной диффузии (10 (83%) пациентов). Биопсия печени у четырех пациентов показала острую и/или хроническую обструкцию крупных желчевыводящих протоков без явного их сужения. Прогрессирующий характер течения патологии зафиксирован рентгенологически [22].
Необходимо отметить, что в исследованиях как у мышей, так и у человека выявлена повышенная экспрессия ACE2 в гепатоцитах при наличии фиброза и цирроза печени, а гипоксия, характерная для тяжелых случаев COVID-19, стала основным регулятором гепатоцеллюлярной экспрессии ACE2 [23, 24]. На экспрессию АСЕ2 в печени могут влиять и воспалительные процессы. Так, в отношении других органов показано, что воспаление увеличивает экспрессию АСЕ2 и TMPRSS2, поэтому можно предположить, что исходный воспалительный процесс в печени также способствует ее инфицированию коронавирусом [25, 26]. В то же время провоспалительная среда, вызванная прямым или косвенным повреждением гепатоцитов и холангиоцитов на фоне COVID-19, может проложить путь для активации звездчатых клеток печени с последующей индукцией фиброза, что особенно важно для пациентов с исходными ХЗП. Хотя имеющиеся данные свидетельствуют о том, что повреждение печени, связанное с SARS-CoV-2, обычно является легким и преходящим, требуются длительные наблюдения, чтобы исключить фиброз печени как потенциальное долгосрочное последствие COVID-19, особенно при наличии предшествующего заболевания печени [15].
Кроме гепатоцитов и холангиоцитов рассматривались другие варианты мишеней для SARS-CoV-2 в печени, а именно эндотелиальные АСЕ2-негативные клетки синусоидов печени [27]. При этом рецептор АСЕ2 обнаружен в крупных венозных сосудах (включая портальную вену), что также обусловливает возможность их инфицирования [28]. Более того, уже описаны случаи эндотелиита крупных внутрипеченочных сосудов, вызванного SARS-CoV-2 [29, 30].
Ряд исследователей считают, что повреждение печени при COVID-19 вторично по отношению к иммунной дисрегуляции, цитокиновому шторму, развитию эндотелиопатии с ишемическим повреждением, лекарственному поражению печени или их комбинации. Ишемические, гиперкоагуляционные и гипервоспалительные состояния, но не повреждение печени как таковое служат независимыми предикторами смерти у пациентов с COVID-19 [31].
В проспективном клинико-патологическом исследовании участвовали 11 больных COVID-19 из Австрии. Согласно данным гепатобиопсии, у всех пациентов наблюдалась пролиферация клеток Купфера, у восьми – хронический венозный застой в печени. Другие гистопатологические изменения включали стеатоз печени, портальный фиброз, лимфоцитарные инфильтраты и пролиферацию протоков, лобулярный холестаз и острый некроз клеток печени вместе с тромбозом центральных вен [8].
По данным T. Marjot и соавт., в посмертных образцах клиновидной гепатобиопсии 48 пациентов, умерших от тяжелой коронавирусной пневмонии, SARS-CoV-2 был обнаружен путем гибридизации in situ в 68% образцов печени. Гистологическая оценка также выявила сосудистые аномалии, характеризующиеся портальными венозными и синусоидальными микротромбозами (100%), микровезикулярным и макровезикулярным стеатозом (50%), легким портальным воспалением (66%) и портальным фиброзом (60%). Возможно, подобные изменения связаны с основным ХЗП – неалкогольной жировой болезнью печени, поскольку в данной когорте больных были широко распространены метаболические факторы риска, включая артериальную гипертензию и сердечно-сосудистые заболевания. Выявление микровезикулярного стеатоза указывает на возможность лекарственного поражения печени. Обращало на себя внимание отсутствие гистологических признаков повреждения желчевыводящих путей. При электронной микроскопии ткани печени были визуализированы возможные коронавирусоподобные частицы в цитоплазме гепатоцитов в сочетании с набуханием митохондрий и апоптозом [13].
Несколько иные результаты, основанные на гистологическом исследовании печени 40 пациентов, умерших от осложнений COVID-19, получены S.M. Lagana и соавт. Наиболее частой находкой стал макровезикулярный стеатоз – 30 (75%) случаев. Умеренное дольковое некровоспаление (острый гепатит) и портальное воспаление обнаружены у 20 (50%) больных. Сосудистая патология, в том числе синусоидальные микротромбы, встречалась редко – 6 (15%) случаев. ПЦР ткани печени была положительной у 11 (55%) из 20 протестированных пациентов. При этом не отмечалось существенной корреляции между положительным результатом ПЦР и любыми гистологическими изменениями в печени, включая воспаление. Кроме того, стеатоз печени не коррелировал с индексом массы тела и диабетом и, вероятно, развился в период НКИ. Не прослеживалось связи между острым гепатитом, по данным гистологического исследования, и уровнем аминотрансфераз крови, но наблюдалась тенденция к обнаружению острого гепатита при положительном результате ПЦР. Морфологически повреждение холангиоцитов не определялось при окраске гематоксилином и эозином, однако лабораторно холестаз выявлялся у 38% [32].
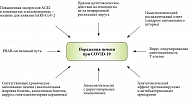
Общая схема патогенеза поражения печени при COVID-19 представлена на рис. 2.
Возможности профилактики и терапии ассоциированных с COVID-19 поражений печени
Поражение печени при COVID-19 имеет комплексный, многофакторный характер. В рамках повреждающего воздействия непосредственно со стороны SARS-CoV-2 необходимо учитывать такие факторы, как цитокиновый шторм, эндотелиопатия, гиперкоагуляция, а также прямое поражение вирусом гепатоцитов и/или холангиоцитов, в совокупности способствующие развитию воспаления и гипоксии в печени с последующей индукцией фиброгенеза. Общими патогномоничными механизмами поражения печени при COVID-19 являются стеатоз, воспаление, холестаз и фиброз печени. Компенсация состояния предсуществующего ХЗП и тщательный подбор медикаментозной терапии с учетом патогномоничных механизмов потенциальной гепатотоксичности лекарственных препаратов позволяют уменьшить риски неблагоприятных исходов при НКИ.
С 2020 г. урсодезоксихолевая кислота (УДХК) рассматривается медицинским сообществом в качестве первого средства для снижения и профилактики цитокинового шторма, вызванного COVID-19 [33]. Кроме того, мексиканские ученые в своем эксперименте доказали, что УДХК способна препятствовать внедрению SARS-CoV2 в клетку человека за счет взаимодействия с S-протеином и мембранной моделью SARS-CoV-2, дестабилизируя взаимодействие вируса с его клетками-мишенями и препятствуя их инфицированию [34]. Введение УДХК в дозе 500 мг/сут защищает печень от повреждения, особенно если инфекция SARS-CoV-2 коррелирует с повышением уровней трансаминаз и общего билирубина в сыворотке [35].
Способность УДХК достоверно снижать уровень АЛТ описана в систематическом обзоре и метаанализе 2020 г. [36]. Кроме того, УДХК оказывает цитопротективный, антиапоптотический, антиоксидантный и антифибротический эффект на клетки печени [37, 38], что служит обоснованием ее назначения пациентам с COVID-19.
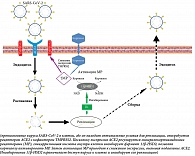
Для лечения пациентов с НКИ также рассматривается глицирризиновая кислота (ГК), которая влияет на SARS-CoV-2 несколькими путями. Один из них связан со снижением экспрессии TMPRSS2 за счет прямого ингибирования 11β-HSD2 (фермента 11β-гидроксистероиддегидрогеназы 2-го типа) и последующим снижением экспрессии ACE2. Другой путь связан с противовирусной активностью ГК, индуцируемой ею в клетках печени синтазы закиси азота, что вызывает ингибирование репликации вируса (рис. 3) [39]. Показано, что ГК может связываться с S-протеином, блокируя взаимодействие вируса с клетками хозяина [40]. Кроме того, доказана дозозависимая эффективность ГК против SARS-CoV-2, реализуемая через ингибирование основной протеазы вируса, необходимой для его репликации [41].
Общие гепатопротективные возможности ГК обусловлены ее способностью связывать активные формы кислорода, восстанавливать работу митохондрий, уменьшать продукцию провоспалительных цитокинов и хемокинов, снижать воспаление через молекулы межклеточной адгезии, ферментные системы и факторы транскрипции, такие как NF-kB [39, 42]. ГК может подавлять COVID-19 благодаря своим антиоксидантным, противовирусным, противовоспалительным эффектам, особенно благодаря способности активировать иммунную систему, что реализуется преимущественно через интерлейкины 6 и 17, фактор некроза опухоли альфа, систему комплемента, интерфероны и ряд активных молекул (например, ICAM-1 – молекула клеточной адгезии 1, ММР9 – матриксная металлопротеиназа 9, TLR2 – толл-подобный рецептор 2) [43]. Кроме того, огромное значение имеет уникальное антифибротическое действие ГК на печень [44].
В России доступна фиксированная комбинация УДХК и ГК (препарат Фосфоглив® УРСО), доказавшая биоэквивалентность референтному препарату по УДХК с сопоставимым профилем безопасности [45]. Сочетание двух компонентов в составе препарата позволяет потенцировать положительные эффекты УДХК и ГК как в рамках противовирусного действия на SARS-CoV-2, так и в отношении фонового состояния печени, воздействуя на основные патогенетические механизмы поражения печени – стеатоз, воспаление, холестаз и фиброз.
Заключение
Поражение печени при COVID-19 достаточно частая проблема, которая связана с тяжестью НКИ и сопутствующим ХЗП, при этом она значимо влияет на общий прогноз пациента. Механизмы, лежащие в основе печеночной дисфункции при COVID-19, изучены не до конца. Предполагают как прямое повреждение печени вирусом, так и вторичное влияние системных реакций (цитокинового шторма, эндотелиопатии, гиперкоагуляции) и применения гепатотоксических лекарственных препаратов.
Наиболее перспективным средством лечения пациентов с поражением печени на фоне COVID-19 представляется комбинация УДХК и ГК (препарат Фосфоглив® УРСО), характеризующаяся как противовирусным действием в отношении SARS-CoV-2, так и гепатопротекторным, противовоспалительным, антифибротическим.
S.N. Mekhtiev, PhD, Prof., O.A. Mekhtieva, PhD, O.M. Berko
Pavlov First Saint Petersburg State Medical University
Gastroenterological Center ʽExpertʼ, St. Peterburg
Contact person: Sabir N. Mekhtiev, sabirm@mail.ru
The article discusses the epidemiology and pathogenesis of liver damage in a new coronavirus infection, as well as the possibility of drug therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.