количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Медицинский форум
Мастер-класс по клиническому разбору больных сахарным диабетом 2 типа
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №1 (9)
- Аннотация
- Статья
- Ссылки
Наличие тесной связи между сердечно-сосудистыми заболеваниями и сахарным диабетом не вызывает сомнений. Еще 15 лет назад Американская ассоциация кардиологов (American Heart Association – AHA) назвала сахарный диабет сердечно-сосудистым заболеванием. Появилось новое направление медицины – кардиодиабетология. Поиску оптимальных путей взаимодействия врачей разных специальностей и обсуждению терапевтических подходов с использованием современных сахароснижающих и антигипертензивных препаратов в разных клинических ситуациях у пациентов с сахарным диабетом и сердечно-сосудистыми заболеваниями был посвящен мастер-класс, организованный компанией «Новартис» и прошедший в форме интерактивной дискуссии эндокринолога, заслуженного врача России, д.м.н., профессора кафедры эндокринологии и диабетологии МГМСУ им. А.И. Евдокимова Ашота Мусаеловича МКРТУМЯНА, кардиолога, д.м.н., профессора кафедры пропедевтики внутренних болезней РУДН Жанны Давидовны КОБАЛАВЫ и клинического фармаколога, д.м.н., заведующего кафедрой клинической фармакологии, фармакотерапии и скорой медицинской помощи МГМСУ им. А.И. Евдокимова Аркадия Львовича ВЁРТКИНА.

Профессор А.М. Мкртумян

Профессор Ж.Д. Кобалава

Профессор А.Л. Вёрткин
![Таблица 1. Выбор антигипертензивной терапии в зависимости от клинической ситуации (ESH/ESC 2013) [адаптировано по 9]](/upload/resize_cache/iblock/e1b/195_350_1/e1bc9d85df83f6d099ef030306411010.jpg)
Таблица 1. Выбор антигипертензивной терапии в зависимости от клинической ситуации (ESH/ESC 2013) [адаптировано по 9]
![Рис. 1. Влияние ПССП на патогенетические звенья СД 2 типа [адаптировано по 16]](/upload/resize_cache/iblock/096/195_350_1/0961f54953da50e103fea33d283ab2bc.jpg)
Рис. 1. Влияние ПССП на патогенетические звенья СД 2 типа [адаптировано по 16]
![Рис. 2. Влияние терапии вилдаглиптином на функцию бета-клеток и чувствительность к инсулину [адаптировано по 18]](/upload/resize_cache/iblock/bfe/195_350_1/bfea6da821187106b7b4c7a5a5c933fa.jpg)
Рис. 2. Влияние терапии вилдаглиптином на функцию бета-клеток и чувствительность к инсулину [адаптировано по 18]
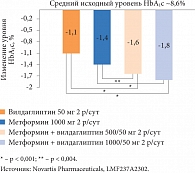
Рис. 3. Эффективность комбинированной терапии видаглиптином и метформином в сравнении с монотерапией вилдаглиптином или метформином у пациентов с исходным уровнем HbA1c > 7,5%
Интерактивная дискуссия кардиолога и эндокринолога «По правилам врачебного искусства»
СД и ССЗ: две стороны одной медали
Сегодня повсеместно прослеживаются тенденции сближения кардиологии, эндокринологии и диабетологии. Представители этих специальностей все чаще работают рука об руку, поскольку, как отметил профессор А.М. Мкртумян, нет ни одного эндокринного заболевания, которое бы не затрагивало сердечно-сосудистую систему. Не стал исключением в этом отношении и сахарный диабет (СД) 2 типа, чрезвычайно распространенное заболевание, роль которого в повседневной врачебной работе трудно переоценить. По данным профессора А.М. Мкртумяна, 70% пациентов с диагностированной ишемической болезнью сердца (ИБС) имеют нарушение углеводного обмена, включая СД, а 70% пациентов с СД умирают от сердечно-сосудистых заболеваний (ССЗ).
Сочетание СД 2 типа и ССЗ у одного пациента нередко вызывает у врачей ряд вопросов. Какие группы гипотензивных препаратов показаны, а какие противопоказаны такому больному? Можно ли назначать ему статины, учитывая дозозависимый диабетогенный эффект препаратов данной группы? «Возможно, эндокринологи и кардиологи дадут разные ответы на эти вопросы, – предположил профессор А.М. Мкртумян. – Но, в конце концов, мы, несомненно, придем к консенсусу».
Профессор Ж.Д. Кобалава напомнила, что новая междисциплинарная область медицины, получившая название «кардиодиабетология», зародилась в начале XXI века благодаря целому ряду значимых открытий. Так, опубликованные в 2000 г. данные исследования ARIC (Atherosclerosis risk in communities) показали, что артериальная гипертензия (АГ) сама по себе является продиабетогенным состоянием, увеличивая риск развития СД 2 типа в 2,5 раза. К концу первого десятилетия XXI века изменился господствовавший многие годы подход к первичной профилактике сердечно-сосудистых событий: препараты ацетилсалициловой кислоты сдали свои позиции, а статины, напротив, укрепили. Однако буквально недавно стало очевидно, что статины обладают класс-специфическим дозозависимым диабетогенным эффектом. Например, в исследовании HPS-2 THRIVE (Heart protection study 2 – Treatment of HDL to reduce the incidence of vascular events) было выявлено диабетогенное действие комбинации симвастатина и ниацина.
Ряд исследований, проведенных в последние годы, заставил пересмотреть многие аксиомы, касающиеся ведения пациентов с СД 2 типа, ранее казавшиеся незыблемыми. Так, было установлено, что снижение микроальбуминурии (исследование ROADMAP – Randomized olmesartan and diabetes microalbuminuria prevention), равно как и преднамеренное уменьшение массы тела (исследование Look AHEAD – Action for health in diabetes), не влияют ни на частоту сердечно-сосудистых событий, ни на жизненный прогноз пациентов с СД 2 типа.
В кардиодиабетологии последних лет наметилась тенденция к смягчению принятых еще недавно жестких целей терапии: эндокринологи снизили свои требования к целевым показателям уровня гликированного гемоглобина (HbA1c) у определенных категорий больных, а кардиологи – к целевым значениям артериального давления (АД) у лиц, страдающих СД. В настоящее время, с позиции кардиолога, оптимальной целью антигипертензивной терапии у больных СД считается АД 140/85 мм рт. ст.
И наконец, в 2013 г. принципиально новое значение обрела проблема сердечной недостаточности, особенно у пациентов с сочетанием АГ и СД. Клиницисты задались вопросами: является ли сердечная недостаточность частым сердечно-сосудистым осложнением СД, характеризующимся высокой смертностью, и является ли сердечная недостаточность продиабетогенным состоянием?
В целом можно сказать, что в последнее время прослеживается тенденция к отказу от глюкозоцентрического подхода к лечению СД 2 типа в пользу междисциплинарного подхода. С одной стороны, только достижение нормогликемии не способно ни предотвратить, ни даже замедлить развитие сердечно-сосудистых осложнений СД. С другой стороны, потребность в профилактике таких осложнений у пациентов с СД огромна – сочетание СД и АГ в 4 раза повышает риск развития инсульта, в 3 раза – риск развития ИБС и в 3 раза – смертность. Согласно современным представлениям о ведении больных, страдающих СД и ССЗ, эндокринолог, лечащий такого пациента, должен располагать данными электрокардиографического исследования (ЭКГ) и ЭКГ с нагрузкой, а кардиолог должен иметь информацию об уровне HbA1c и гликемии натощак. Иными словами, успешное лечение, как подчеркнула профессор
Ж.Д. Кобалава, возможно только при условии соблюдения принципов междисциплинарного подхода.
На смену устаревшей концепции «чем ниже, тем лучше» пришла новая – «чем раньше, тем лучше», предполагающая своевременное и как можно более раннее назначение лечения с акцентом на стартовую комбинированную терапию – как гипотензивную, так и сахароснижающую. Такой подход оправдан с позиции теории так называемой гипертонической и гипергликемической памяти, говорящей о развитии в период длительной декомпенсации АГ и СД морфологических изменений, затрудняющих в дальнейшем достижение целевых уровней АД и гликемии и запускающих необратимые процессы развития осложнений этих хронических заболеваний.
Разбор клинического случая
Ведущие отечественные эксперты в области кардиологии и эндокринологии разобрали типичный клинический случай пациента с АГ и СД и выработали совместный междисциплинарный план лечения такого пациента.
Ж.Д. Кобалава:
– На сегодняшний день нашему пациенту 63 года, он инвалид 2-й группы, в прошлом – курильщик, работал водителем. Больной более 20 лет страдает АГ. АД колеблется в пределах 150–180/80–90 мм рт. ст. На момент наблюдения «стаж» заболевания СД 2 типа у пациента составил 13 лет, уровень HbA1c 8%. Отмечу, что вариабельность АД, характерная для пациентов с СД, считается неблагоприятным фактором течения заболевания. В возрасте 60 лет пациент перенес инфаркт миокарда, на момент наблюдения больной страдал сердечной недостаточностью с фракцией выброса 40–50% и стенокардией I функционального класса (ФК). У больного была диагностирована хроническая болезнь почек (ХБП) со скоростью клубочковой фильтрации (СКФ) 54 мл/мин, существенно ограничивающая возможности терапии и заставляющая подбирать минимальные эффективные дозировки гипотензивных препаратов.
Историю болезни данного пациента можно рассмотреть в ретроспективе. Так, 10 лет назад, когда больному было 50 лет, клинически манифестированных патологических состояний у него еще не было, но уже было так называемое бессимптомное поражение органов-мишеней. Субклинический атеросклероз, увеличение толщины комплекса интима-медиа до 13 мм, пароксизмы фибрилляции предсердий – все это должно было насторожить лечащего врача еще 10 лет назад, до развития инфаркта.
Более того, тщательный анализ анамнестических данных показывает, что еще 20 лет назад у больного наблюдался метаболический синдром, предиабет и АГ I степени. При этом в возрасте от 40 до 50 лет (то есть 10–20 лет назад) больной не получал ни гипотензивной, ни сахароснижающей терапии, и лишь 10 лет назад, когда АГ достигла II степени, пациент начал получать метопролол и эналаприл. Причем данная комбинация двух препаратов из группы бета-адреноблокаторов и ингибиторов ангиотензинпревращающего фермента (АПФ) признана нерациональной, так как оба препарата угнетают ренин-ангиотензин-альдостероновую систему (РААС).
На момент наблюдения пациент получал комплексную терапию, в которую входили аспирин (125 мг/сут), симвастатин (20 мг/сут), бисопролол (5 мг/сут), фозиноприл (10 мг/сут), гидрохлоротиазид (25 мг/сут) и метформин (1000 мг/сут).
Симвастатин в дозе 20 мг в сутки не является адекватным назначением для пациента, перенесшего инфаркт миокарда. Согласно современным американским рекомендациям по коррекции дислипидемии, пациенты с высокими показателями холестерина липопротеидов низкой плотности (ХЛНП) и пациенты с атеросклеротическими заболеваниями должны получать высокоинтенсивные статины, снижающие показатели ХЛНП на 50% и более. Очевидно, что достичь этой цели применением симвастатина в суточной дозе 20 мг невозможно. Данному больному показан либо аторвастатин в дозе 40–80 мг/сут, либо розувастатин в дозе 20–40 мг/сут. Назначение бисопролола в течение как минимум трех лет у пациента с инфарктом миокарда в анамнезе и высоким сердечно-сосудистым риском вполне оправданно, так как в этой клинической ситуации бета-адреноблокаторы работают лучше, чем другие препараты.
Назначение гидрохлоротиазида (вопреки распространенным опасениям со стороны эндокринологов) в данном случае обоснованно. В дозе до 25 мг/сут и под прикрытием ингибиторов АПФ и сартанов гидрохлоротиазид может применяться в том числе у пациентов с СД и метаболическим синдромом. Данное назначение оправданно еще и потому, что диуретики являются наиболее эффективной фармацевтической группой в отношении предупреждения сердечной недостаточности.
После обследования и сбора анамнеза пациент получил клинический диагноз:
- гипертоническая болезнь, III стадия, риск 4 (очень высокий). Гипертрофия левого желудочка;
- ИБС. Стенокардия напряжения II ФК. Постинфарктный кардиосклероз. Хроническая сердечная недостаточность, стадия I, II ФК. Пароксизмальная форма фибрилляции предсердий;
- СД 2 типа. Абдоминальное ожирение. Дислипидемия;
- ХБП, 3а стадия смешанного генеза, стадия умеренной альбуминурии (А2).
Были определены целевые значения HbA1c (< 7,5%), АД (< 140/85 мм рт. ст.), уровня ХЛНП (< 1,8 ммоль/л).
А.М. Мкртумян:
– Целевой уровень HbA1c в пределах 7,5% для данного пациента был выбран с учетом наличия инфаркта в анамнезе – гипогликемия смертельно опасна для пациентов, перенесших инфаркт миокарда, поэтому снижение уровня глюкозы должно быть постепенным и плавным.
Целевой показатель терапии дислипидемии, снижение уровня ХЛНП до уровня < 1,8 ммоль/л, был выбран с учетом того, что пациент находится в группе очень высокого риска развития инфаркта и инсульта. И такой пациент в обязательном порядке должен получать статины.
Необходимо помнить, что СД сам по себе не является эквивалентом коронарной болезни сердца. Но если у пациента с СД нет атеросклеротических поражений, мы относим его к группе высокого риска. Если же у него присутствуют признаки реваскуляризации или синдрома Лериша, а также при наличии инфаркта миокарда в анамнезе, мы говорим об очень высоком риске и подбираем соответствующую терапию.
Кардиоэндокринология в вопросах и ответах
После характеристики клинического примера эксперты приступили к обсуждению наиболее актуальных вопросов лечения типичного пациента с АГ и нарушениями углеводного и липидного обмена.
– Можно ли предотвратить трансформацию метаболического синдрома и предиабета в сахарный диабет?
А.М. Мкртумян:
– У нашего пациента в возрасте 40 лет наряду с АГ уже есть метаболический синдром и предиабет, развившийся в СД в течение 10 лет. Метаболический синдром является реальной предпосылкой к развитию СД 2 типа, поскольку в его основе лежит инсулинорезистентность. А вот что касается трансформации предиабета в СД, то она возможна, но не неизбежна. По данным Американской диабетологической ассоциации (American Diabetes Association – ADA), естественное течение нарушений углеводного обмена (нарушенная толерантность к глюкозе и нарушенная гликемия натощак) в течение 3–5 лет в 25% случаев приводит к развитию СД 2 типа, в 25% случаев – к спонтанной нормализации значений гликемии, а в 50% случаев статус углеводного обмена сохраняется без изменений[1]. Систематический обзор 16 когортных исследований, объединивший в общей сложности 44 203 пациента, со средним периодом наблюдения 5,6 года (2,8–12 лет) показал, что пятилетний риск развития СД 2 типа при уровне HbA1c 5,5–6% составляет 9–25%, а при уровне HbA1c 6–6,5% – 25–50%, то есть в 20 раз выше по сравнению с лицами, у которых HbA1c равен 5%[2].
Стратегии предупреждения перехода предиабета в СД существуют, но они не пользуются популярностью. Наиболее эффективным подходом считается назначение метформина и изменение образа жизни, приводящие к 31%-ному и 58%-ному снижению риска развития СД 2 типа соответственно[3].
Ж.Д. Кобалава:
– Кардиологи часто обсуждают метаболические эффекты гипотензивных препаратов. В действительности же задачей кардиолога является определение риска развития СД и использование стратегий, применяемых в эндокринологии.
Одних кардиологических препаратов недостаточно для предупреждения развития СД 2 типа у пациента с АГ, однако следует помнить, что отдельные группы гипотензивных средств способны снижать риск возникновения СД. В первую очередь к таким препаратам относятся антагонисты рецепторов ангиотензина II (АРА), или сартаны. Так, по данным метаанализа 22 клинических исследований с участием 143 153 пациентов, отношение шансов возникновения СД на фоне терапии диуретиками по сравнению с плацебо-контролем составило 1,3; бета-адреноблокаторами по сравнению с диуретиками – 0,9 и по сравнению с плацебо-контролем – 1,17; антагонистами кальция – 0,75 и 0,97; ингибиторами АПФ – 0,67 и 0,87; АРА – 0,57 и 0,75 соответственно[4].
Предположительно, антидиабетогенное действие АРА связано с их способностью предупреждать развитие гипокалиемии (соответственно, диабетогенные механизмы диуретиков обусловлены способностью вымывать калий). Кроме того, сартаны могут подавлять неадекватный гликогенез и сохранять секрецию инсулина, что также профилактирует развитие СД 2 типа. Например, в исследовании VALUE (Valsartan antihypertensive long-term use evaluation) селективный АРА валсартан (препарат Диован®) сравнивали с метаболически нейтральным амлодипином: в группе лечения валсартаном количество новых случаев СД было на 23% меньше, чем в группе приема амлодипина[5]. Как показал анализ результатов исследования NAVIGATOR (Nateglinide and valsartan in impaired glucose tolerance outcomes research), у пациентов, принимавших валсартан, развитие СД 2 типа отмечалось достоверно реже, чем в группе плацебо, – на 14%[6].
– Какие стратегии предупреждения диабетогенного влияния статинов наиболее эффективны?
Ж.Д. Кобалава:
– При использовании статинов для первичной профилактики сердечно-сосудистых заболеваний у пациентов с факторами риска развития СД 2 типа (нарушенная толерантность к глюкозе, нарушенная гликемия натощак, семейный анамнез СД), как правило, целесообразно назначение низких или оптимальных доз статинов в комбинации с блокаторами РААС, агонистами рецепторов активации пероксисом (peroxisome proliferator-activated receptors – PPAR), эзетимибом или метформином. Такая стратегия, наряду с уменьшением массы тела и повышением физической активности, позволит снизить диабетогенный эффект статинов и предотвратить развитие СД. Для вторичной профилактики 1) при остром коронарном синдроме показаны мощные препараты статинов в высоких дозах, поскольку польза от их применения превышает диабетогенные и иные риски; 2) при стабильной ИБС рекомендованы оптимальные дозы статинов в комбинации с блокаторами РААС, PPAR-агонистами или эзетимибом[7, 8].
– Все ли пациенты с СД должны получать блокаторы РААС? Можно ли назначать гидрохлоротиазид при метаболическом синдроме и СД?
Ж.Д. Кобалава:
– Согласно новейшим рекомендациям Европейского общества по артериальной гипертонии (European Society of Hypertension – ESH) и Европейского кардиологического общества (European Society of Cardiology – ESC) (ESH/ESC 2013) по лечению АГ[9], при СД могут быть использованы все классы гипотензивных препаратов, однако блокаторы РААС, в том числе сартаны, могут быть предпочтительными при протеинурии или микроальбуминурии. При этом профилактическое назначение блокаторов РААС не рекомендовано, так как не приводит к уменьшению частоты развития альбуминурии у пациентов с нормальным АД и отсутствием альбуминурии.
Рассматривая возможность назначения гидрохлоротиазида пациентам с АГ, следует помнить, что повышенное АД само по себе обладает диабетогенным свойством, а комбинация бета-адреноблокатора с тиазидным диуретиком повышает риск возникновения СД только у пациентов, уже имеющих предрасположенность к развитию этого заболевания. Отдавать предпочтение необходимо селективным бета-адреноблокаторам и препаратам с вазодилатирующим действием: бисопрололу, метопрололу и карведилолу. В целом страхи, касающиеся применения гидрохлоротиазида, в нашей стране неадекватно преувеличены. В России препарат Ко-Эксфорж®, содержащий 25 мг гидрохлоротиазида, не хотели регистрировать из опасения, что его не будут назначать. В отличие от нас, американские коллеги успешно применяют комбинированную терапию, в состав которой входят тиазидные диуретики в дозе 12,5–25 мг, которая считается низкой. Отмечу, что в новейшей версии рекомендаций ESH/ESC 2013 г. тиазидные диуретики были полность «реабилитированы», поскольку их эффективность при сердечной недостаточности имеет неоспоримое преимущество.
А.М. Мкртумян:
– Эндокринологическое сообщество сегодня опасается не диабетогенности бета-адреноблокаторов, а их способности «смазывать» характерные симптомы гипогликемии (тремор, потливость, тахикардия), из-за чего пациент может просто не заметить опасное для жизни состояние.
– Следует ли начинать лечение АГ с фиксированных комбинаций?
Ж.Д. Кобалава:
– Согласно современным рекомендациям (ESH/ESC 2013) пациентам с АГ I степени высокого риска показано назначение одного гипотензивного препарата и добавление второго при неэффективности монотерапии. Стартовая же комбинированная терапия показана только больным с АГ II степени. При этом результаты американских исследований свидетельствуют: достижение контроля АД при терапии фиксированными комбинациями происходит существенно (на 10%) чаще, чем на фоне лечения свободной комбинацией препаратов, а целевых значений АД при таком подходе достигают до 70% больных[10].
Наблюдательное исследование, в котором комбинированный препарат Эксфорж® сравнивался со свободной комбинацией амлодипина и валсартана, показало, что использование фиксированной комбинации в реальной практике на 32% снижает риск развития инфаркта миокарда, на 43% – инсульта, на 34% – сердечной недостаточности и на 53% – нефропатии[11]. Эти разительные отличия обусловлены повышением приверженности пациентов лечению при использовании фиксированных комбинаций. Поскольку пациенты с СД и ХБП автоматически попадают в группу риска по развитию неконтролируемой и рефрактерной АГ, применение у них трехкомпонентной комбинированной терапии является абсолютно оправданным и желательным (табл. 1). А трехкомпонентный препарат Ко-Эксфорж®, в состав которого входят диуретик, антагонист кальция и сартан, к слову, единственная на данный момент фиксированная комбинация трех препаратов, одновременно решает все проблемы пациента, рассматриваемого в качестве клинического случая.
– Сердечная недостаточность и сахарный диабет. Различаются ли гипотензивные препараты по способности предупреждать сердечную недостаточность?
Ж.Д. Кобалава:
– Существуют три основных фактора риска развития сердечной недостаточности: гипертрофия левого желудочка, СД и фибрилляция предсердий. В 2013 г. в новой версии рекомендаций ESH/ESC были опубликованы данные, согласно которым вероятность развития сердечной недостаточности у больного СД превышает риск развития инфаркта миокарда, всегда выше риска инсульта и даже смерти от сердечно-сосудистых причин. Более того, сердечная недостаточность – одно из наиболее смертельных, если не самое смертельное осложнение СД. Наличие у больного СД нефропатии в 3 раза увеличивает вероятность сердечной недостаточности по сравнению с пациентами с СД, но без ХБП. По данным американского регистра, 46% пациентов с сердечной недостаточностью имеют СД[12]. По данным российских исследователей, частота СД возрастает по мере роста тяжести хронической сердечной недостаточности[13, 14]. Таким образом, сердечная недостаточность, так же как и АГ, – продиабетогенное состояние. Кроме того, наличие у больного СД сердечной недостаточности радикально ухудшает жизненный прогноз. Так, анализ данных исследования ACCORD (Action to control cardiovascular risk in diabetes) показал, что в течение среднего периода наблюдения 3,5 года среди пациентов с сочетанием СД и сердечной недостаточности погибли 14,1% пациентов в группе интенсивного гликемического контроля и 10,2% в группе стандартной терапии (для сравнения: смертность во всей популяции исследования составила 4,5% и 3,5% соответственно)[15].
В этой связи очень важно помнить, что сердечная недостаточность – это не только самое опасное, но и наиболее легко предотвращаемое сердечно-сосудистое осложнение. И, как уже упоминалось выше, самыми эффективными препаратами в профилактике сердечной недостаточности являются тиазидные диуретики, которые необходимо применять под прикрытием гипотензивных препаратов других классов.
– Безопасно ли применение у пациентов, перенесших инфаркт миокарда и страдающих сердечной недостаточностью, препаратов Галвус® или Галвус Мет®?
А.М. Мкртумян:
– Применение ингибиторов дипептидилпептидазы 4 (ДПП-4), инкретинов, у больных СД с сердечно-сосудистым риском патогенетически обосновано: в экспериментальных исследованиях показано, что они могут предупреждать сердечную недостаточность и даже уменьшать площадь инфаркта миокарда. Это обусловлено механизмом действия препаратов данной группы: они подавляют фермент ДПП-4, который в свою очередь ингибирует дифференцировку стволовых клеток в кардиомиоциты. В ряде исследований была показана способность метформина увеличивать количество и активность открытых миокардиальных КАТФ-каналов, что усиливает ишемическое прекондиционирование. Канадская диабетологическая ассоциация полностью пересмотрела свои позиции относительно применения метформина у пациентов с хронической сердечной недостаточностью после того, как было показано, что он способен повышать выживаемость пациентов данной группы. Именно поэтому сейчас Галвус Мет® является препаратом первого выбора для лечения больных СД с хронической сердечной недостаточностью. Этот опыт необходимо перенять и нашим врачам.
Интерактивная дискуссия терапевта и эндокринолога «Может ли сахароснижающий препарат быть одновременно эффективным и безопасным?»
Почему умирают наши пациенты? Практические проблемы диагностики и лечения СД 2 типа
А.М. Мкртумян:
– Согласно статистике Всемирной организации здравоохранения, 8 из 10 пациентов, страдающих СД 2 типа, умирают от ССЗ, причем наиболее частой причиной смерти оказывается инфаркт миокарда, инсульт или сердечная недостаточность. В 2007 г. в России, по данным Государственного регистра больных сахарным диабетом, эти состояния стали причиной смерти пациентов с СД 2 типа в 5,9%, 20,7% и 32,2% случаев соответственно, в то время как кетоацидозная и гипогликемическая кома в совокупности стали причиной 0,4% смертей больных СД 2 типа.
Связь ССЗ и СД является чрезвычайно тесной: наличие СД увеличивает риск развития ССЗ в 2–4 раза, а 80% пациентов с СД имеют макроваскулярные осложнения. В Европе каждый 5-й пациент, которому делается операция стентирования коронарных артерий, страдает СД 2 типа. Среди лиц с диагнозом СД высока частота гнойных осложнений заболевания, также нередко приводящих к летальному исходу. Сахарный диабет в принципе увеличивает потребность пациента в проведении различных инструментальных манипуляций. Источником опасной для пациента инфекции могут стать медицинские инструменты и медперсонал, однако в 50% случаев на момент возникновения осложнения инфекционный агент уже находится в организме пациента. Развитию же смертельно опасного гнойного процесса во всех этих случаях способствует характерная для СД иммуносупрессия, наблюдающаяся у 50% пациентов.
Еще одной распространенной, опасной для жизни и при этом недооцененной проблемой пациентов с СД является гипогликемия, нередко оказывающаяся причиной смерти больных, принимающих пероральные сахароснижающие препараты (ПССП). Сколько случаев гипогликемии ежегодно проходит мимо медицинских работников, сложно установить, поскольку пациенты с СД 2 типа – это в основном пожилые люди, которые относят симптомы гипогликемии к «возрастным проблемам» или считают их «сердечным приступом». Как правило, они предпочитают вообще не обращаться за медицинской помощью или обращаются за ней в последний момент, когда состояние стало субъективно и объективно тяжелым. Именно поэтому 20% госпитализаций у пожилых больных с СД 2 типа происходят из-за эпизодов тяжелой гипогликемии.
Гипогликемические состояния чрезвычайно опасны своими последствиями: комой, увеличением массы тела, ухудшением когнитивных функций и летальными исходами. Смерть пациентов, перенесших гипогликемию, ассоциирована с аритмиями, увеличением тромбообразования и специфическими эффектами катехоламинов (увеличением частоты сердечных сокращений, безболевой ишемией, стенокардией и инфарктом миокарда).
Плохая выявляемость нарушений углеводного обмена приводит к тому, что многие пациенты получают диагноз «сахарный диабет» при госпитализации либо посмертно.
А.Л. Вёрткин:
– Анализ данных скорой медицинской помощи (СМП), выезжавшей к больным с диагнозом СД, за три года в 6 российских городах (Казань, Екатеринбург, Кувандык, Старый Оскол, Великий Устюг, Комсомольск-на-Амуре) показал, что около 20% всех вызовов связаны с гипогликемией, остальные 80% – с гипергликемией и другими осложнениями СД. Однако сведения, касающиеся помощи врачей СМП пациентам с гипогликемией, как правило, не попадают к их лечащим врачам – терапевтам и эндокринологам. Вероятнее всего, в скором времени эта проблема станет еще острее, поскольку с 1 января 2014 г. в России кардиологические бригады СМП заменены анестезиолого-реаниматологическими. А последние в силу своей специализации мало информированы о проблемах пациентов с гипогликемией и с большей вероятностью пропустят это угрожающее жизни состояние.
Уже сегодня, по статистике одной московской больницы, 13% умерших в стационаре пациентов с СД 2 типа погибли вследствие гипогликемии, развившейся на фоне приема ПССП, а у 26% пациентов, поступивших в стационар с гипергликемией, данное патологическое состояние было впервые выявлено уже после госпитализации.
Сахарный диабет является не только опасным, но и широко распространенным заболеванием: только по данным Государственного регистра, на территории Российской Федерации 1 января 2012 г. проживало 3 млн 549 тысяч больных СД. Однако данные, полученные в ходе контрольно-эпидемиологических исследований ФГБУ «Эндокринологический научный центр», показали, что реальные цифры распространенности СД в стране в 3–4 раза выше. Предположительно, в России СД страдают 5–7% населения, а общая численность пациентов с данным диагнозом составляет около 9 млн человек. Эта цифра сопоставима с расчетами Всемирной организации здравоохранения, эксперты которой считают, что в России проживает 9 млн 600 тысяч человек, больных СД.
Имеющихся на сегодняшний день в России эндокринологов (как амбулаторных, так и стационарных) недостаточно для того, чтобы обеспечить 9 млн больных СД адекватной медицинской помощью. При этом существенно сократить время консультации невозможно, ведь врач должен побеседовать с пациентом об особенностях питания, научить его самоконтролю и при необходимости скорректировать назначенное лечение.
Итак, с одной стороны, существующий в России штат эндокринологов физически не может обеспечить пациентов специализированной врачебной помощью. Но, с другой стороны, пациенты с подозрением на эндокринное заболевание сначала попадают (в соответствии с имеющимися стандартами) на прием к терапевту, кабинет которого (также по стандартам) должен быть оснащен глюкометром. Измерение гликемии при помощи глюкометра занимает всего несколько секунд, и при этом его результаты позволяют однозначно определить дальнейшую тактику ведения данного пациента. Но в реальной практике терапевта скрининг гликемии скорее исключение, чем правило. Так, анализ амбулаторных карт 6678 пациентов, в течение месяца принятых 10 терапевтами типичной московской поликлиники, показал, что уровень гликемии на приеме определялся лишь в 3,5% случаев, и в половине из них (52%) он был повышен.
А.М. Мкртумян:
– Включение определения уровня глюкозы крови в рутинную практику работы врачей-терапевтов позволило бы выявить большую часть случаев СД 2 типа на ранней стадии, а также проконтролировать эффективность лечения больных, уже имеющих данный диагноз. К сожалению, этого не происходит, и зачастую мы имеем дело с пациентами в стадии длительной декомпенсации СД 2 типа.
СД и образ жизни. Актуальные вопросы безопасности сахароснижающей терапии
А.Л. Вёрткин:
– Сахарный диабет и ожирение являются настолько тесно связанными метаболическими нарушениями, что западные специалисты даже изобрели термин diabesity (на русский язык это можно перевести как «диажирение»). Дискуссии о том, что в этом дуэте первично – ожирение или диабет, идут до сих пор, однако высокая распространенность обоих заболеваний однозначно указывает на необходимость скорейшего принятия мер, направленных на борьбу с пандемией избыточной массы тела, ожирения и СД, уже затронувшей 1,7 млрд человек по всему миру. Считается, что сегодня на Земле живут около 400 млн человек, страдающих ожирением, и 366 млн человек, страдающих СД (90% из них болеют СД 2 типа).
Ожирение является важным фактором риска развития СД, поскольку адипоциты способны вырабатывать прогипергликемические факторы (резистин, фактор некроза опухоли альфа, интерлейкин 6 и другие цитокины), при этом подавляется выработка антигипергликемических факторов (лептина, адипонектина, висфатина и др.).
А.М. Мкртумян:
– Увеличение массы тела, с одной стороны, способствует развитию и прогрессированию СД 2 типа, а с другой – является наиболее распространенным побочным эффектом терапии многими традиционными ПССП. Это обусловлено механизмом действия препаратов сульфонилмочевины: они обладают секретогенной активностью и увеличивают выработку инсулина, что приводит к повышению аппетита, увеличению массы тела, прогрессированию заболевания. Следствием стимуляции исключительно бета-клеток поджелудочной железы становится ускоренное истощение инсуляторного аппарата, что также приводит к прогрессированию СД и неизбежной декомпенсации заболевания, требующей интенсификации терапии. Так формируется порочный круг.
Использование препаратов сульфонилмочевины связано с еще одной серьезной проблемой – увеличением риска развития гипогликемии, о печальных последствиях этого состояния мы говорили выше.
Относительно недавно, после 2000 г., в распоряжении эндокринологов появились сахароснижающие препараты группы ингибиторов ДПП-4, характеризующиеся более высоким профилем безопасности, чем большинство традиционных ПССП. Чем это обусловлено?
Как известно, для СД 2 типа характерна дисфункция бета-клеток, неадекватная супрессия синтеза глюкагона (дисфункция альфа-клеток), прогрессивное снижение функции бета-клеток и невосприимчивость тканей к инсулину (инсулинорезистентность). Некоторые «классические» ПССП действуют на стимуляцию секреции инсулина (к препаратам с данным механизмом действия относятся средства на основе сульфонилмочевины и глиниды), в то время как другие ПССП влияют на повышение чувствительности к инсулину (тиазолидиндионы, метформин), либо на снижение секреции эндогенной глюкозы (метформин), либо на замедление всасывания углеводов из желудочно-кишечного тракта (метформин, ингибиторы альфа-глюкозидазы). Препараты группы ингибиторов ДПП-4 воздействуют сразу на несколько патогенетических механизмов СД 2 типа (рис. 1)[16]. Таким образом, применение ингибиторов ДПП-4 позволяет уменьшить полипрагмазию, типичную для лечения пациентов с общесоматической патологией и СД 2 типа.
Существуют данные, указывающие на способность ингибитора ДПП-4 вилдаглиптина улучшать секрецию инсулина, замедлять апоптоз островковых клеток и даже формировать инсулинпозитивные клетки, которые начинают вырабатывать инсулин (рис. 2)[17, 18]. Чрезвычайно важной представляется способность ингибиторов ДПП-4 восстанавливать чувствительность альфа-клеток к уровню глюкозы – данный эффект у препаратов этой фармакологической группы выражен настолько явно, что в настоящее время обсуждается возможность назначения ингибиторов ДПП-4 пациентам с СД 1 типа для повышения чувствительности альфа-клеток к уровню глюкозы и предотвращения развития гипогликемии.
С целью оценки эффективности и безопасности нового класса препаратов в реальной клинической практике была запущена масштабная наблюдательная программа EDGE (Effectiveness of diabetes control with vildagliptin and vildagliptin/metformin), в которой приняли участие более 45 тысяч пациентов из 27 стран, включая Россию. Численность когорты пациентов, принимавших вилдаглиптин, составила 29 759 человек, когорты сравнения – 16 078 человек. В ходе исследования было показано, что в когорте приема вилдаглиптина доля пациентов, ответивших на терапию снижением уровня HbA1c > 0,3% и с хорошей переносимостью терапии, оказалась выше, чем в когорте сравнения, независимо от исходного уровня HbA1c или препарата, добавленного к монотерапии.
Препараты группы ингибиторов ДПП-4 характеризуются не только хорошей переносимостью и высокой эффективностью, но и благоприятным профилем безопасности. Риск развития гипогликемии или увеличения массы тела на фоне приема ингибиторов ДПП-4 минимален, причем высокий уровень безопасности препаратов данной группы сохраняется даже при их использовании у пациентов из групп высокого риска, например, у больных в возрасте старше 75 лет[19]. В комбинации с метформином вилдаглиптин показывает лучшие клинические результаты по сравнению с производными сульфонилмочевины[20]. Частота развития нежелательных явлений на фоне приема вилдаглиптина сопоставима с таковой на фоне приема плацебо[21].
Наиболее перспективной комбинацией ингибиторов ДПП-4 является сочетание препаратов данной группы с метформином. Они взаимно усиливают эффекты друг друга, причем данное сочетание может применяться на протяжении длительного периода времени без «ускользания» эффекта. Сочетание вилдаглиптина с метформином особенно эффективно у пациентов с высоким исходным уровнем HbA1c, поэтому оно считается оптимальным для стартовой терапии больных, у которых данный показатель превышает 7,5% (рис. 3).
Фиксированная комбинация вилдаглиптина с метформином, выпускаемая под торговым названием Галвус Мет®, ассоциируется с повышением степени соблюдения пациентами режима терапии, улучшением метаболических и клинических исходов (микроваскулярные осложнения, частота госпитализаций и обращений за экстренной медицинской помощью), а также помогает упростить лечение[22]. Раннее начало лечения и использование комбинированной терапии для старта в большинстве случаев позволяют добиться быстрой компенсации заболевания. Добавление ингибитора ДПП-4 к базальному инсулину способствует стабилизации показателей гликемии натощак без набора веса и повышения частоты гипогликемии[23].
А.Л. Вёрткин:
– У пациентов с СД 2 типа, как правило, присутствует эндотелиальная дисфункция. Поскольку вилдаглиптин обладает доказанной способностью улучшать функцию эндотелия, препарат может с успехом применяться в том числе и с целью коррекции эндотелиальных нарушений, в частности, для подавления атеросклеротических процессов. Кроме того, вилдаглиптин характеризуется противовоспалительной активностью и может ингибировать активность макрофагов и моноцитов[24]. Последнее чрезвычайно важно в контексте современных представлений об атеросклерозе как о заболевании с воспалительным патогенезом. В целом с общетерапевтических позиций вилдаглиптин может рассматриваться как кардиопротективный препарат с комплексным механизмом действия.
Подытоживая реальные и потенциальные клинические преимущества терапии СД 2 типа, основанной на инкретинах, можно сказать, что такие особенности «инкретинового эффекта», как воздействие на основные патогенетические механизмы развития СД 2 типа и физиологический характер этого воздействия, позволяют при хорошей переносимости терапии влиять на естественное течение заболевания, добиваться стойкой нормализации углеводного обмена, что вкупе с низким риском гипогликемии и плейотропными эффектами (уменьшение выраженности эндотелиальной дисфункции, противовоспалительное действие, подавление процессов атеросклероза и др.) способствует снижению риска сердечно-сосудистых осложнений СД.
1. Nathan D.M., Davidson M.B., DeFronzo R.A. et al. Impaired fasting glucose and impaired glucose tolerance: implications for care // Diabetes Care. 2007. Vol. 30. № 3. P. 753–759.
2. Zhang X., Gregg E.W., Williamson D.F. et al. A1C level and future risk of diabetes: a systematic review // Diabetes Care. 2010. Vol. 33. № 7. P. 1665–1673.
3. Knowler W.C., Barrett-Connor E., Fowler S.E. et al. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin // N. Engl. J. Med. 2002. Vol. 346. № 6. P. 393–403.
4. Elliott W.J., Meyer P.M. Incident diabetes in clinical trials of antihypertensive drugs: a network meta-analysis // Lancet. 2007. Vol. 369. № 9557. P. 201–207.
5. Julius S., Kjeldsen S.E., Weber M. et al. Outcomes in hypertensive patients at high cardiovascular risk treated with regimens based on valsartan or amlodipine: the VALUE randomised trial // Lancet. 2004. Vol. 363. № 9426. P. 2022–2031.
6. McMurray J.J., Holman R.R., Haffner S.M. et al. NAVIGATOR Study Group. Effect of valsartan on the incidence of diabetes and cardiovascular events // N. Engl. J. Med. 2010. Vol. 362. № 16. P. 1477–1490.
7. Koh K.K., Sakuma I., Quon M.J. Differential metabolic effects of distinct statins // Atherosclerosis. 2011. Vol. 215. № 1. P. 1–8.
8. Koh K.K., Lim S., Sakuma I., Quon M.J. Caveats to aggressive lowering of lipids by specific statins // Int. J. Cardiol. 2012. Vol. 154. № 2. P. 97–101.
9. Mancia G., Fagard R., Narkiewicz K. et al. 2013 ESH/ESC guidelines for the management of arterial hypertension: the Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // Eur. Heart J. 2013. Vol. 34. № 28. P. 2159–2219.
10. Gu Q., Burt V.L., Dillon C.F., Yoon S. Trends in antihypertensive medication use and blood pressure control among United States adults with hypertension: the National Health And Nutrition Examination Survey, 2001 to 2010 // Circulation. 2012. Vol. 126. № 17. P. 2105–2114.
11. Kaiser E., Klebs S., Lied T. et al. A database analysis to evaluate the risk of cardiovascular events in hypertensive patients being treated with either the single pill combination of valsartan and amlodipine or the respective free combination // J. Hypertens. 2011. Vol. 29. e_Supplement A. P. e282: 15.434.
12. Yancy C.W., Jessup M., Bozkurt B. et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines // Circulation. 2013. Vol. 128. № 16. P. e240–e319.
13. Мареев В.Ю., Даниелян М.О., Беленков Ю.Н. От имени рабочей группы исследования ЭПОХА-О-ХСН. Сравнительная характеристика больных с ХСН в зависимости от величины ФВ по результатам Российского многоцентрового исследования ЭПОХА-О-ХСН // Сердечная недостаточность. 2006. Т. 7. № 4. С. 164–171.
14. Лапина Ю.В., Нарусов О.Ю., Мареев В.Ю. и др. Рациональная Эффективная Многокомпонентная терапия в БОрьбе с Сахарным Диабетом у больных ХСН (РЭМБО – СД ХСН). Хроническая сердечная недостаточность как фактор риска развития инсулинорезистентности и нарушений углеводного обмена // Сердечная недостаточность. 2007. Т. 8. № 4. С. 164–170.
15. Calles-Escandón J., Lovato L.C., Simons-Morton D.G. et al. Effect of intensive compared with standard glycemia treatment strategies on mortality by baseline subgroup characteristics: the Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial // Diabetes Care. 2010. Vol. 33. № 4. P. 721–727.
16. DeFronzo R.A. Impaired glucose tolerance: do pharmacological therapies correct the underlying metabolic disturbance? // Br. J. Diabetes Vasc. Dis. 2003. Vol. 3. № 1. P. S24–S40.
17. D’Alessio D.A., Denney A.M., Hermiller L.M. et al. Treatment with the dipeptidyl peptidase-4 inhibitor vildagliptin improves fasting islet-cell function in subjects with type 2 diabetes // J. Clin. Endocrinol. Metab. 2009. Vol. 94. № 1. P. 81–88.
18. Ahrén B., Pacini G., Foley J.E., Schweizer A. Improved meal-related beta-cell function and insulin sensitivity by the dipeptidyl peptidase-IV inhibitor vildagliptin in metformin-treated patients with type 2 diabetes over 1 year // Diabetes Care. 2005. Vol. 28. № 8. P. 1936–1940.
19. Schweizer A., Dejager S., Foley J.E. et al. Clinical experience with vildagliptin in the management of type 2 diabetes in a patient population ≥75 years: a pooled analysis from a database of clinical trials // Diabetes Obes. Metab. 2011. Vol. 13. № 1. P. 55–64.
20. Bader G., Geransar P., Schweizer A. Vildagliptin more effectively achieves a composite endpoint of HbA₁c < 7.0% without hypoglycaemia and weight gain compared with glimepiride after 2 years of treatment // Diabetes Res. Clin. Pract. 2013. Vol. 100. № 3. P. e78–e81.
21. Kothny W., Shao Q., Groop P.H., Lukashevich V. One-year safety, tolerability and efficacy of vildagliptin in patients with type 2 diabetes and moderate or severe renal impairment // Diabetes Obes. Metab. 2012. Vol. 14. № 11. P. 1032–1039.
22. Schernthaner G. Fixed-dose combination therapies in the management of hyperglycaemia in Type 2 diabetes: an opportunity to improve adherence and patient care // Diabet. Med. 2010. Vol. 27. № 7. P. 739–743.
23. Kothny W., Kozlovsky P., Foley J. et al. Vildagliptin added to once or twice daily insulin regimens improves glycaemic control without increasing risk of hypoglycaemia and weight gain in patients with type 2 diabetes // A 48th Annual Meeting of the European Association for the study of diabetes. PS 067. Poster 857.
24. Anagnostis P., Athyros V.G., Adamidou F. et al. Glucagon-like peptide-1-based therapies and cardiovascular disease: looking beyond glycaemic control // Diabetes Obes. Metab. 2011. Vol. 13. № 4. P. 302–312.
Новости на тему
13.02.2025
14.05.2024
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.