количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Клинические случаи
Медикаментозная терапия и операция имплантации экстракардиального сетчатого каркаса при дилатационной кардиомиопатии беременных
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Кардиология и Ангиология" № 1 (11)
- Аннотация
- Статья
- Ссылки
В статье рассматривается клинический случай успешного лечения дилатационной кардиомиопатии беременных при сочетании лекарственной терапии и операции имплантации экстракардиального сетчатого каркаса.
Такой подход препятствует прогрессированию дилатации полостей сердца, способствует обратному ремоделированию левого желудочка и увеличению его насосной функции и позволяет достичь компенсации хронической сердечной недостаточности.
В статье рассматривается клинический случай успешного лечения дилатационной кардиомиопатии беременных при сочетании лекарственной терапии и операции имплантации экстракардиального сетчатого каркаса.
Такой подход препятствует прогрессированию дилатации полостей сердца, способствует обратному ремоделированию левого желудочка и увеличению его насосной функции и позволяет достичь компенсации хронической сердечной недостаточности.

Рис. 1. Экстракардиальный сетчатый каркас из дакрона для лечения дилатационной кардиомиопатии
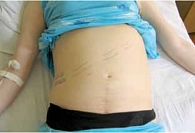
Рис. 2. Объективный клинический статус больной Б. при поступлении в стационар: асцит, гепатомегалия (отмечена динамика размеров печени на фо
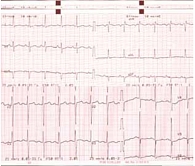
Рис. 3. Электрокардиограмма больной Б. при поступлении в стационар: синусовая тахикардия, перегрузка предсердий и левого желудочка
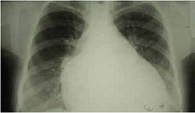
Рис. 4. Рентгенография грудной клетки больной Б. при поступлении в стационар
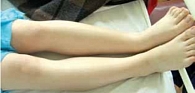
Рис. 5. Объективный клинический статус больной Б. на фоне медикаментозного лечения (в динамике исчезли отеки голеней)
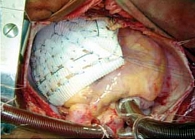
Рис. 6. Операция имплантации экстракардиального сетчатого каркаса больной Б.
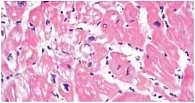
Рис. 7. Гистологическое исследование миокарда больной Б.
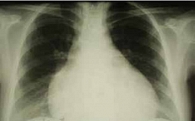
Рис. 8. Рентгенография грудной клетки больной Б. после операции
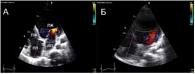
Рис. 9. Эхокардиография больной Б. до (А) и после (Б) операции (апикальная четырехкамерная позиция). Отмечается в динамике уменьшение выраженн
Введение
Дилатационная кардиомиопатия (ДКМП) беременных (ДКМП, ассоциированная с беременностью, послеродовая кардиомиопатия) является редкой причиной хронической сердечной недостаточности (ХСН) (0,5% всех случаев ХСН). ДКМП беременных развивается у женщин в последние месяцы беременности или в первые месяцы после родов. Впервые ДКМП беременных была описана еще в 1849 г. [1], а современный этап изучения этого заболевания датируется началом 1970-х гг. [2].
ДКМП беременных встречается достаточно редко, и ее распространенность варьирует в зависимости от страны. В европейских странах распространенность ДКМП у беременных составляет 1 случай на 1,5–4 тыс. живых новорожденных, в США – 1:4000 живых новорожденных, в Японии – 1:6000 [3]. Более часто ДКМП беременных встречается в Южной Африке (1:1000) и на Гаити (1:350–1:400) [4]. Причины вариабельности частоты развития ДКМП у беременных в разных странах неизвестны.
Имеются данные о существовании повышенного риска развития ДКМП у беременных женщин старшего возраста, при повторных и/или многоплодных беременностях, у представительниц негроидной расы, при развитии осложнений беременности (гестозы, артериальная гипертония), использовании токолитиков, низком социально-экономическом статусе женщины [5, 6]. Этиология и патогенез ДКМП беременных неизвестны. Рассматривают несколько возможных причин, включая миокардит, патологическую иммунную реакцию на беременность, неадекватный ответ на гемодинамические изменения в связи с беременностью, пролонгирование беременности с помощью длительных курсов лечения токолитиками [7].
Многое в механизме развития ДКМП при беременности и в послеродовом периоде остается неясным. Можно предположить наличие сразу нескольких факторов в развитии данного заболевания (их значение и роль пока не определены). Вероятнее всего, у пациенток с предрасположенностью к ДКМП беременность и/или роды являются своеобразным триггером для запуска патологического процесса в сердечной мышце. Обсуждается роль инфекционных (персистирование вирусной инфекции), иммунологических (активация цитокинов, аутоиммунные процессы), нутритивных (дефицит селена, избыточное потребление соли) факторов, также не исключают роль усиления апоптоза миоцитов, а также эффекты пролактина и пр.
Несмотря на многообразие гипотез, ведущая роль патологического ответа иммунной системы в патогенезе ДКМП у беременных признается большинством исследователей [8]. В популяции пациенток с ДКМП беременных обнаружено увеличение плазменной концентрации таких воспалительных цитокинов, как фактор некроза опухолей альфа (ФНО-альфа), интерлейкины 1 и 6 (ИЛ-1, ИЛ-6), С-реактивный белок, а также маркеров апоптоза Fas/Apo-1. Достоверно более высокая концентрация Fas/Apo-1 в плазме определяется у больных в сравнении с группой здоровых добровольцев и указывает на повышенный риск смертельного исхода [9, 10]. Выявляется активация гуморального иммунитета и повышение уровня иммуноглобулинов (класс G, подклассы G1, G2, G3) – антител к миозину сердечной мышцы [11]. Иммунологическая теория также основана на выявлении высокого титра аутоантител к белкам сердечной мышцы в плазме младенцев, рожденных от матерей с ДКМП беременных.
Клинические признаки ДКМП беременных не специфичны и обусловлены развитием застойной сердечной недостаточности. Беременность может «маскировать» типичные симптомы ХСН, что затрудняет своевременную диагностику заболевания. Ранние признаки ХСН могут быть не идентифицированы при нормальном течении беременности (отеки, одышку можно объяснить непосредственно беременностью или гестозом).
Симптомы ДКМП беременных характерны для ХСН любой другой этиологии (пароксизмальная ночная одышка, набухшие яремные вены, влажные хрипы в легких, кардиомегалия, ритм галопа, отеки, одышка при физической нагрузке, гепатомегалия, гидроторакс, тахикардия). Функциональный класс ХСН, как правило, высокий (III и IV по классификации Нью-Йоркской ассоциации кардиологов (New York Heart Association – NYHA)). При снижении фракции выброса (ФВ) менее 35% высок риск тромбоэмболических осложнений с развитием типичной симптоматики в зависимости от эмболии тех или иных сосудистых бассейнов (например, кровохарканье при тромбоэмболии легочной артерии (ТЭЛА); гемиплегия, нарушение речи при мозговой эмболии; клиника острого инфаркта миокарда при эмболии коронарных артерий и т.д.). При ДКМП беременных специфические клинические признаки отсутствуют. Это диагноз исключения, поэтому необходимо отвергнуть другие возможные причины развития ХСН. Клиницистам же следует подозревать развитие ДКМП беременных у любой беременной или недавно родившей женщины с симптомами ХСН [12, 13, 14]. Диагностические критерии [15] ДКМП беременных включают:
Лечение больных с ДКМП беременных аналогично терапии ХСН другого генеза [17]. Эффективное лечение снижает смертность и увеличивает вероятность нормализации систолической функции ЛЖ. Сложности в выборе тактики ведения больных связаны с тем, что многие стандартные препараты для лечения ХСН противопоказаны при беременности и могут нанести вред плоду (например, ингибиторы ангиотензинпревращающего фермента (иАПФ) обладают токсическим действием на плод). В этой связи для уменьшения постнагрузки вместо иАПФ при беременности применяют гидралазин (в том числе в сочетании с нитратами). Бета-блокаторы используют при появлении тахикардии и аритмиях для предотвращения внезапной сердечной смерти, часто встречающейся при ДКМП беременных. Дигоксин относительно безопасен при беременности, применяется для улучшения сократимости миокарда и контроля сердечного ритма. Диуретики также используют у беременных для снижения преднагрузки и уменьшения клинических симптомов. При снижении ФВ менее 35%, в связи с высоким риском развития тромбоэмболических осложнений, показано назначение гепарина с последующим переходом на варфарин [18].
Предметом дальнейших исследований в области ДКМП беременных представляется изучение иммунных нарушений; уточнение роли вирусов; внедрение нетрадиционных методов лечения (применение иммуносупрессоров, противовирусных средств; препаратов, подавляющих продукцию провоспалительных цитокинов, иммуноплазмаферез); а также разработка стратегии контроля и профилактики ДКМП во время беременности и после родов [19, 20]. Перспективным у этой группы больных может оказаться такой хирургический метод лечения ХСН, как имплантация экстракардиального сетчатого каркаса (ЭКСК), который может служить альтернативой пересадке сердца.
Как известно, ремоделирование сердца является основным механизмом прогрессирования ХСН, при этом изменения кардиомиоцитов и преобладание коллагена III типа приводят к нарушению геометрии сердца. В связи с этим предотвращение ремоделирования сердца может предотвратить прогрессирование ХСН. Возникла гипотеза, согласно которой средством, способным предупредить прогрессирование ремоделирования ЛЖ, может служить наружный каркас сердца [21].
В Российском научном центре хирургии (РНЦХ) им. акад. Б.В. Петровского РАМН А.В. Коротеев и соавт. разработали и внедрили методику изготовления сетчатого каркаса из дакрона для лечения ДКМП. Каркас обладает достаточно высокой биосовместимостью и эластичностью, хорошо облегает сердце и имеет изотропное направление эластики (рис. 1). Было продемонстрировано, что имплантация ЭКСК, разработанного в РНЦХ РАМН, при ДКМП препятствует прогрессированию дилатации полостей сердца и способствует улучшению функционального состояния миокарда [22]. Показаниями к изолированной имплантации каркаса при ДКМП являются: конечный диастолический размер (КДР) ЛЖ > 6,0 см; митральная регургитация ≤ 2-й степени; степень смыкания створок митрального клапана ≤ 12 мм; фиброзное кольцо митрального клапана < 40 мм.
Методика лечения больного с ДКМП заключается в предоперационной подготовке медикаментозными средствами с целью максимальной оптимизации гемодинамики (снижение пред- и постнагрузки, улучшение систолической функции ЛЖ). При улучшении клинического состояния на фоне лекарственной терапии проводится изготовление каркаса (размеры сердца и расчетные ориентиры определяются по данным спиральной компьютерной томографии). Затем проводится операция имплантации ЭКСК, после чего продолжается медикаментозная терапия ХСН. В качестве примера успешного лечения ДКМП беременных при помощи лекарственной терапии в комбинации с операцией имплантации ЭКСК приводится следующее клиническое наблюдение [23].
Клиническое наблюдение
Больная Б., 29 лет, поступила в Клинику пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко Первого МГМУ им. И.М. Сеченова с жалобами на выраженную слабость, одышку в покое, усиливающуюся при малейших физических нагрузках, отеки голеней и стоп, увеличение в размере живота, учащенное сердцебиение, приступы ночного удушья. Пациентка считает себя больной около 1 года, с момента, когда на 6-м месяце второй беременности у нее появились отеки голеней, одышка. К врачам не обращалась, так как полагала, что эти проявления являются признаками беременности, вела привычный активный образ жизни. На последнем месяце беременности состояние ухудшилось, наросла слабость, одышка стала возникать в состоянии покоя. На 10-м месяце беременности (15 сентября 2005 г.) проведено оперативное родоразрешение (здоровая девочка). После родов появилась отрицательная динамика в клиническом состоянии: приступы ночного удушья, выраженные отеки нижних конечностей. Связи с инфекционными заболеваниями не отмечала. С октября 2005 г. по май 2006 г. пациентка практически постоянно находилась на стационарном лечении по месту жительства по поводу ХСН. Эффект от проводимой терапии был недолгим, симптомы ХСН сохранялись. В мае 2006 г. участились приступы ночного удушья, усилилась одышка. По поводу нарастания признаков декомпенсации кровообращения больная была госпитализирована в клинику пропедевтики.
Сопутствующих заболеваний не отмечалось. Пациентка – домохозяйка. В анамнезе – 2 беременности (первая беременность протекала без особенностей), 2 родов. В 1997 г. – нормальные срочные роды, здоровый мальчик (4,5 кг), 2005 г. (данная беременность) – кесарево сечение на 10-м месяце беременности, здоровая девочка (5 кг). Пациентка не курила, алкоголем не злоупотребляла. Наследственный анамнез по сердечно-сосудистым заболеваниям не отягощен. Объективное обследование больной при поступлении в клинику. Состояние тяжелое. t = 36,6 °С. Сознание ясное. Ортопноэ. Цианоз губ. Отеки голеней и стоп. Признаки правостороннего гидроторакса. В легких влажные хрипы в нижних отделах, тахипноэ, частота дыхательных движений (ЧДД) 28 в минуту. Расширение границ сердца вправо и влево. Тоны сердца приглушены, протодиастолический ритм галопа, акцент и расщепление 2 тона над легочной артерией. Частота сердечных сокращений (ЧСС) 120 ударов в минуту, артериальное давление (АД) 95/60 мм рт. ст. Живот увеличен в объеме за счет асцита, печень + 13 см от края реберной дуги по правой срединно-ключичной линии, край острый, плотной консистенции с ровной поверхностью, болезненная при пальпации. Селезенка не увеличена (рис. 2). Тест 6-минутной ходьбы – 25 м.
Анамнестические данные и клинический статус больной указывали на наличие ДКМП и ХСН, генез которой требовал уточнения. Было начато обследование. На электрокардиограмме (ЭКГ) при поступлении пациентки в стационар были выявлены: синусовая тахикардия, ЧСС 90 ударов в мин, перегрузка предсердий и ЛЖ (рис. 3). При лабораторном обследовании отмечались: гипохромная железодефицитная анемия (гемоглобин 108 г/л, цветовой показатель 0,7, сывороточное железо 10 мкг/дл); гипоальбуминемия до 3,1 г/дл, что часто присутствует у больных с ХСН.
Результаты обследования маркеров воспаления, иммуноглобулинов, комплемента, С-реактивного белка, ревматоидного фактора отклонений от нормы не показали. Нормальные уровни маркеров воспаления позволили усомниться в диагнозе «миокардит». Диагноз «тиреотоксикоз» был отвергнут на основании отсутствия патологических изменений тиреоидного статуса (свободный тироксин (Т4) 20,8 пмоль/л, тиреотропный гормон (ТТГ) 1,03 Ме/л, антитела к тиреопероксидазе (ТПО) 18,3 Ме/мл). Повышение уровня мозгового натрийуретического пептида (brain natriuretic peptide, BNP) до 1035 пкг/мл еще раз подтверждало диагноз ХСН. Выявленные при рентгенологическом исследовании признаки кардиомегалии указывали на ДКМП: сердце значительно увеличено в размерах за счет всех камер; кардиоторакальный индекс (КТИ) равен 65%; объем сердца составляет 226% от нормы; венозный застой в легких (рис. 4). При ультразвуковом исследовании (УЗИ) органов брюшной полости определялись признаки застоя по большому кругу кровообращения: в брюшной полости, правой плевральной полости, в малом тазу – жидкость; гепатомегалия (размер левой доли печени составляет 64 × 92 мм, правой доли – 123 × 166 мм), расширение нижней полой, воротной и печеночных вен.
Эхокардиография, проведенная при поступлении пациентки в стационар, показала следующие изменения: дилатация всех камер сердца (КДР ЛЖ 6,8 см, конечный систолический размер (КСР) ЛЖ 6,4 см, конечный диастолический объем (КДО) 227 мл, конечный систолический объем (КСО) 190 мл, левое предсердие (ЛП) 4,5 × 5,0 × 6,2 см, правое предсердие (ПП) 4,9 × 6,0 см, правый желудочек (ПЖ) 3,0 см), диффузное нарушение сократительной функции со снижением ФВ до 18%, митральная регургитация 2–3-й степени, повышение систолического давления в легочной артерии (СДЛА) до 58 мм рт. ст. С учетом связи между беременностью, родами и развитием ХСН у больной, имеющихся признаков ДКМП был сформулирован клинический диагноз. Основное заболевание: дилатационная кардиомиопатия. Осложнения: нарушение ритма сердца: хроническая сердечная недостаточность II Б ст. IV ФК NYHA (New York Heart Assosiation). Сопутствующие заболевания: хроническая железодефицитная анемия.
В течение 1,5 месяцев пациентка находилась на лечении в клинике. Назначалась диуретическая терапия (Верошпирон, Лазикс), Престариум, Конкор, альбумин, поляризующая смесь с дигоксином, Ферроплекс. На фоне терапии состояние пациентки несколько улучшилось, стал менее выраженным отечный синдром (уменьшились гепатомегалия, гидроторакс, отеки нижних конечностей) (рис. 5), ЧСС снизилась до 92 ударов в минуту. Однако сохранялись выраженная слабость, одышка и приступы удушья. Результаты ЭхоКГ не показали существенной положительной динамики: размеры камер и выраженность легочной гипертензии оставались прежними, ФВ – 29%. Возможности медикаментозной терапии были исчерпаны, и требовалось оперативное вмешательство. В РНЦХ РАМН 13 сентября 2006 г. больной была проведена операция имплантации ЭКСК (рис. 6). При гистологическом исследовании миокарда были выявлены изменения, характерные для ДКМП: встречаются гипертрофированные кардиомиоциты, строма миокарда фиброзно изменена с участками склероза (рис. 7). Уже через 3 недели после операции у больной Б. отмечались следующие признаки улучшения состояния: одышка, приступы ночного удушья, слабость не беспокоят; отсутствует отечный синдром; повысилась толерантность к физическим нагрузкам (тест 6-минутной ходьбы – 360 м). Снизился уровень BNP до 254 пкг/мл.
По данным рентгенографии грудной клетки кардиомегалия уменьшилась: кардиоторакальный индекс (КТИ) снизился до 57%, объем сердца – до 183% от нормы (рис. 8). ЭхоКГ после операции показала следующие результаты: уменьшился объем ЛЖ и улучшилась его насосная функция: КДО 196 мл, КСО 134 мл, ФВ 31%; снизилась митральная регургитация до 0–1-й степени, СДЛА – до 34 мм рт. ст. (рис. 9). Через 1 год после операции состояние пациентки удовлетворительное, жалоб не предъявляет, ведет активный образ жизни.
Выводы
Таким образом, представленный клинический случай демонстрирует, что совместное применение медикаментозной терапии и имплантации ЭКСК при ДКМП беременных препятствует прогрессированию дилатации полостей сердца, способствует обратному ремоделированию ЛЖ и увеличению его насосной функции и позволяет достигнуть компенсации ХСН.
Дилатационная кардиомиопатия (ДКМП) беременных (ДКМП, ассоциированная с беременностью, послеродовая кардиомиопатия) является редкой причиной хронической сердечной недостаточности (ХСН) (0,5% всех случаев ХСН). ДКМП беременных развивается у женщин в последние месяцы беременности или в первые месяцы после родов. Впервые ДКМП беременных была описана еще в 1849 г. [1], а современный этап изучения этого заболевания датируется началом 1970-х гг. [2].
ДКМП беременных встречается достаточно редко, и ее распространенность варьирует в зависимости от страны. В европейских странах распространенность ДКМП у беременных составляет 1 случай на 1,5–4 тыс. живых новорожденных, в США – 1:4000 живых новорожденных, в Японии – 1:6000 [3]. Более часто ДКМП беременных встречается в Южной Африке (1:1000) и на Гаити (1:350–1:400) [4]. Причины вариабельности частоты развития ДКМП у беременных в разных странах неизвестны.
Имеются данные о существовании повышенного риска развития ДКМП у беременных женщин старшего возраста, при повторных и/или многоплодных беременностях, у представительниц негроидной расы, при развитии осложнений беременности (гестозы, артериальная гипертония), использовании токолитиков, низком социально-экономическом статусе женщины [5, 6]. Этиология и патогенез ДКМП беременных неизвестны. Рассматривают несколько возможных причин, включая миокардит, патологическую иммунную реакцию на беременность, неадекватный ответ на гемодинамические изменения в связи с беременностью, пролонгирование беременности с помощью длительных курсов лечения токолитиками [7].
Многое в механизме развития ДКМП при беременности и в послеродовом периоде остается неясным. Можно предположить наличие сразу нескольких факторов в развитии данного заболевания (их значение и роль пока не определены). Вероятнее всего, у пациенток с предрасположенностью к ДКМП беременность и/или роды являются своеобразным триггером для запуска патологического процесса в сердечной мышце. Обсуждается роль инфекционных (персистирование вирусной инфекции), иммунологических (активация цитокинов, аутоиммунные процессы), нутритивных (дефицит селена, избыточное потребление соли) факторов, также не исключают роль усиления апоптоза миоцитов, а также эффекты пролактина и пр.
Несмотря на многообразие гипотез, ведущая роль патологического ответа иммунной системы в патогенезе ДКМП у беременных признается большинством исследователей [8]. В популяции пациенток с ДКМП беременных обнаружено увеличение плазменной концентрации таких воспалительных цитокинов, как фактор некроза опухолей альфа (ФНО-альфа), интерлейкины 1 и 6 (ИЛ-1, ИЛ-6), С-реактивный белок, а также маркеров апоптоза Fas/Apo-1. Достоверно более высокая концентрация Fas/Apo-1 в плазме определяется у больных в сравнении с группой здоровых добровольцев и указывает на повышенный риск смертельного исхода [9, 10]. Выявляется активация гуморального иммунитета и повышение уровня иммуноглобулинов (класс G, подклассы G1, G2, G3) – антител к миозину сердечной мышцы [11]. Иммунологическая теория также основана на выявлении высокого титра аутоантител к белкам сердечной мышцы в плазме младенцев, рожденных от матерей с ДКМП беременных.
Клинические признаки ДКМП беременных не специфичны и обусловлены развитием застойной сердечной недостаточности. Беременность может «маскировать» типичные симптомы ХСН, что затрудняет своевременную диагностику заболевания. Ранние признаки ХСН могут быть не идентифицированы при нормальном течении беременности (отеки, одышку можно объяснить непосредственно беременностью или гестозом).
Симптомы ДКМП беременных характерны для ХСН любой другой этиологии (пароксизмальная ночная одышка, набухшие яремные вены, влажные хрипы в легких, кардиомегалия, ритм галопа, отеки, одышка при физической нагрузке, гепатомегалия, гидроторакс, тахикардия). Функциональный класс ХСН, как правило, высокий (III и IV по классификации Нью-Йоркской ассоциации кардиологов (New York Heart Association – NYHA)). При снижении фракции выброса (ФВ) менее 35% высок риск тромбоэмболических осложнений с развитием типичной симптоматики в зависимости от эмболии тех или иных сосудистых бассейнов (например, кровохарканье при тромбоэмболии легочной артерии (ТЭЛА); гемиплегия, нарушение речи при мозговой эмболии; клиника острого инфаркта миокарда при эмболии коронарных артерий и т.д.). При ДКМП беременных специфические клинические признаки отсутствуют. Это диагноз исключения, поэтому необходимо отвергнуть другие возможные причины развития ХСН. Клиницистам же следует подозревать развитие ДКМП беременных у любой беременной или недавно родившей женщины с симптомами ХСН [12, 13, 14]. Диагностические критерии [15] ДКМП беременных включают:
- развитие ХСН в течение последнего месяца беременности или первых пяти месяцев после родов;
- отсутствие ранее диагностируемого заболевания сердца, но не позже последнего месяца беременности;
- отсутствие каких-либо других объективных причин для развития ХСН;
- наличие при эхокардиографии (ЭхоКГ) признаков систолической дисфункции левого желудочка (ЛЖ) (снижение ФВ менее 45%, или выявленное в М-режиме снижение фракции укорочения менее 30%, или оба признака, и увеличение конечного диастолического размера ЛЖ более 2,7 см/м2 (в пересчете на площадь поверхности тела пациентки)).
Лечение больных с ДКМП беременных аналогично терапии ХСН другого генеза [17]. Эффективное лечение снижает смертность и увеличивает вероятность нормализации систолической функции ЛЖ. Сложности в выборе тактики ведения больных связаны с тем, что многие стандартные препараты для лечения ХСН противопоказаны при беременности и могут нанести вред плоду (например, ингибиторы ангиотензинпревращающего фермента (иАПФ) обладают токсическим действием на плод). В этой связи для уменьшения постнагрузки вместо иАПФ при беременности применяют гидралазин (в том числе в сочетании с нитратами). Бета-блокаторы используют при появлении тахикардии и аритмиях для предотвращения внезапной сердечной смерти, часто встречающейся при ДКМП беременных. Дигоксин относительно безопасен при беременности, применяется для улучшения сократимости миокарда и контроля сердечного ритма. Диуретики также используют у беременных для снижения преднагрузки и уменьшения клинических симптомов. При снижении ФВ менее 35%, в связи с высоким риском развития тромбоэмболических осложнений, показано назначение гепарина с последующим переходом на варфарин [18].
Предметом дальнейших исследований в области ДКМП беременных представляется изучение иммунных нарушений; уточнение роли вирусов; внедрение нетрадиционных методов лечения (применение иммуносупрессоров, противовирусных средств; препаратов, подавляющих продукцию провоспалительных цитокинов, иммуноплазмаферез); а также разработка стратегии контроля и профилактики ДКМП во время беременности и после родов [19, 20]. Перспективным у этой группы больных может оказаться такой хирургический метод лечения ХСН, как имплантация экстракардиального сетчатого каркаса (ЭКСК), который может служить альтернативой пересадке сердца.
Как известно, ремоделирование сердца является основным механизмом прогрессирования ХСН, при этом изменения кардиомиоцитов и преобладание коллагена III типа приводят к нарушению геометрии сердца. В связи с этим предотвращение ремоделирования сердца может предотвратить прогрессирование ХСН. Возникла гипотеза, согласно которой средством, способным предупредить прогрессирование ремоделирования ЛЖ, может служить наружный каркас сердца [21].
В Российском научном центре хирургии (РНЦХ) им. акад. Б.В. Петровского РАМН А.В. Коротеев и соавт. разработали и внедрили методику изготовления сетчатого каркаса из дакрона для лечения ДКМП. Каркас обладает достаточно высокой биосовместимостью и эластичностью, хорошо облегает сердце и имеет изотропное направление эластики (рис. 1). Было продемонстрировано, что имплантация ЭКСК, разработанного в РНЦХ РАМН, при ДКМП препятствует прогрессированию дилатации полостей сердца и способствует улучшению функционального состояния миокарда [22]. Показаниями к изолированной имплантации каркаса при ДКМП являются: конечный диастолический размер (КДР) ЛЖ > 6,0 см; митральная регургитация ≤ 2-й степени; степень смыкания створок митрального клапана ≤ 12 мм; фиброзное кольцо митрального клапана < 40 мм.
Методика лечения больного с ДКМП заключается в предоперационной подготовке медикаментозными средствами с целью максимальной оптимизации гемодинамики (снижение пред- и постнагрузки, улучшение систолической функции ЛЖ). При улучшении клинического состояния на фоне лекарственной терапии проводится изготовление каркаса (размеры сердца и расчетные ориентиры определяются по данным спиральной компьютерной томографии). Затем проводится операция имплантации ЭКСК, после чего продолжается медикаментозная терапия ХСН. В качестве примера успешного лечения ДКМП беременных при помощи лекарственной терапии в комбинации с операцией имплантации ЭКСК приводится следующее клиническое наблюдение [23].
Клиническое наблюдение
Больная Б., 29 лет, поступила в Клинику пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко Первого МГМУ им. И.М. Сеченова с жалобами на выраженную слабость, одышку в покое, усиливающуюся при малейших физических нагрузках, отеки голеней и стоп, увеличение в размере живота, учащенное сердцебиение, приступы ночного удушья. Пациентка считает себя больной около 1 года, с момента, когда на 6-м месяце второй беременности у нее появились отеки голеней, одышка. К врачам не обращалась, так как полагала, что эти проявления являются признаками беременности, вела привычный активный образ жизни. На последнем месяце беременности состояние ухудшилось, наросла слабость, одышка стала возникать в состоянии покоя. На 10-м месяце беременности (15 сентября 2005 г.) проведено оперативное родоразрешение (здоровая девочка). После родов появилась отрицательная динамика в клиническом состоянии: приступы ночного удушья, выраженные отеки нижних конечностей. Связи с инфекционными заболеваниями не отмечала. С октября 2005 г. по май 2006 г. пациентка практически постоянно находилась на стационарном лечении по месту жительства по поводу ХСН. Эффект от проводимой терапии был недолгим, симптомы ХСН сохранялись. В мае 2006 г. участились приступы ночного удушья, усилилась одышка. По поводу нарастания признаков декомпенсации кровообращения больная была госпитализирована в клинику пропедевтики.
Сопутствующих заболеваний не отмечалось. Пациентка – домохозяйка. В анамнезе – 2 беременности (первая беременность протекала без особенностей), 2 родов. В 1997 г. – нормальные срочные роды, здоровый мальчик (4,5 кг), 2005 г. (данная беременность) – кесарево сечение на 10-м месяце беременности, здоровая девочка (5 кг). Пациентка не курила, алкоголем не злоупотребляла. Наследственный анамнез по сердечно-сосудистым заболеваниям не отягощен. Объективное обследование больной при поступлении в клинику. Состояние тяжелое. t = 36,6 °С. Сознание ясное. Ортопноэ. Цианоз губ. Отеки голеней и стоп. Признаки правостороннего гидроторакса. В легких влажные хрипы в нижних отделах, тахипноэ, частота дыхательных движений (ЧДД) 28 в минуту. Расширение границ сердца вправо и влево. Тоны сердца приглушены, протодиастолический ритм галопа, акцент и расщепление 2 тона над легочной артерией. Частота сердечных сокращений (ЧСС) 120 ударов в минуту, артериальное давление (АД) 95/60 мм рт. ст. Живот увеличен в объеме за счет асцита, печень + 13 см от края реберной дуги по правой срединно-ключичной линии, край острый, плотной консистенции с ровной поверхностью, болезненная при пальпации. Селезенка не увеличена (рис. 2). Тест 6-минутной ходьбы – 25 м.
Анамнестические данные и клинический статус больной указывали на наличие ДКМП и ХСН, генез которой требовал уточнения. Было начато обследование. На электрокардиограмме (ЭКГ) при поступлении пациентки в стационар были выявлены: синусовая тахикардия, ЧСС 90 ударов в мин, перегрузка предсердий и ЛЖ (рис. 3). При лабораторном обследовании отмечались: гипохромная железодефицитная анемия (гемоглобин 108 г/л, цветовой показатель 0,7, сывороточное железо 10 мкг/дл); гипоальбуминемия до 3,1 г/дл, что часто присутствует у больных с ХСН.
Результаты обследования маркеров воспаления, иммуноглобулинов, комплемента, С-реактивного белка, ревматоидного фактора отклонений от нормы не показали. Нормальные уровни маркеров воспаления позволили усомниться в диагнозе «миокардит». Диагноз «тиреотоксикоз» был отвергнут на основании отсутствия патологических изменений тиреоидного статуса (свободный тироксин (Т4) 20,8 пмоль/л, тиреотропный гормон (ТТГ) 1,03 Ме/л, антитела к тиреопероксидазе (ТПО) 18,3 Ме/мл). Повышение уровня мозгового натрийуретического пептида (brain natriuretic peptide, BNP) до 1035 пкг/мл еще раз подтверждало диагноз ХСН. Выявленные при рентгенологическом исследовании признаки кардиомегалии указывали на ДКМП: сердце значительно увеличено в размерах за счет всех камер; кардиоторакальный индекс (КТИ) равен 65%; объем сердца составляет 226% от нормы; венозный застой в легких (рис. 4). При ультразвуковом исследовании (УЗИ) органов брюшной полости определялись признаки застоя по большому кругу кровообращения: в брюшной полости, правой плевральной полости, в малом тазу – жидкость; гепатомегалия (размер левой доли печени составляет 64 × 92 мм, правой доли – 123 × 166 мм), расширение нижней полой, воротной и печеночных вен.
Эхокардиография, проведенная при поступлении пациентки в стационар, показала следующие изменения: дилатация всех камер сердца (КДР ЛЖ 6,8 см, конечный систолический размер (КСР) ЛЖ 6,4 см, конечный диастолический объем (КДО) 227 мл, конечный систолический объем (КСО) 190 мл, левое предсердие (ЛП) 4,5 × 5,0 × 6,2 см, правое предсердие (ПП) 4,9 × 6,0 см, правый желудочек (ПЖ) 3,0 см), диффузное нарушение сократительной функции со снижением ФВ до 18%, митральная регургитация 2–3-й степени, повышение систолического давления в легочной артерии (СДЛА) до 58 мм рт. ст. С учетом связи между беременностью, родами и развитием ХСН у больной, имеющихся признаков ДКМП был сформулирован клинический диагноз. Основное заболевание: дилатационная кардиомиопатия. Осложнения: нарушение ритма сердца: хроническая сердечная недостаточность II Б ст. IV ФК NYHA (New York Heart Assosiation). Сопутствующие заболевания: хроническая железодефицитная анемия.
В течение 1,5 месяцев пациентка находилась на лечении в клинике. Назначалась диуретическая терапия (Верошпирон, Лазикс), Престариум, Конкор, альбумин, поляризующая смесь с дигоксином, Ферроплекс. На фоне терапии состояние пациентки несколько улучшилось, стал менее выраженным отечный синдром (уменьшились гепатомегалия, гидроторакс, отеки нижних конечностей) (рис. 5), ЧСС снизилась до 92 ударов в минуту. Однако сохранялись выраженная слабость, одышка и приступы удушья. Результаты ЭхоКГ не показали существенной положительной динамики: размеры камер и выраженность легочной гипертензии оставались прежними, ФВ – 29%. Возможности медикаментозной терапии были исчерпаны, и требовалось оперативное вмешательство. В РНЦХ РАМН 13 сентября 2006 г. больной была проведена операция имплантации ЭКСК (рис. 6). При гистологическом исследовании миокарда были выявлены изменения, характерные для ДКМП: встречаются гипертрофированные кардиомиоциты, строма миокарда фиброзно изменена с участками склероза (рис. 7). Уже через 3 недели после операции у больной Б. отмечались следующие признаки улучшения состояния: одышка, приступы ночного удушья, слабость не беспокоят; отсутствует отечный синдром; повысилась толерантность к физическим нагрузкам (тест 6-минутной ходьбы – 360 м). Снизился уровень BNP до 254 пкг/мл.
По данным рентгенографии грудной клетки кардиомегалия уменьшилась: кардиоторакальный индекс (КТИ) снизился до 57%, объем сердца – до 183% от нормы (рис. 8). ЭхоКГ после операции показала следующие результаты: уменьшился объем ЛЖ и улучшилась его насосная функция: КДО 196 мл, КСО 134 мл, ФВ 31%; снизилась митральная регургитация до 0–1-й степени, СДЛА – до 34 мм рт. ст. (рис. 9). Через 1 год после операции состояние пациентки удовлетворительное, жалоб не предъявляет, ведет активный образ жизни.
Выводы
Таким образом, представленный клинический случай демонстрирует, что совместное применение медикаментозной терапии и имплантации ЭКСК при ДКМП беременных препятствует прогрессированию дилатации полостей сердца, способствует обратному ремоделированию ЛЖ и увеличению его насосной функции и позволяет достигнуть компенсации ХСН.
1. Richie C. Clinical contribution to the pathology, diagnosis and treatment of certain chronic diseases of the heart // Edinb. Med. Surg. J. 1849. № 2. P. 333–342.
2. Demakis J.G., Rahimtoola S.H. Peripartum cardiomyopathy // Circulation. 1971. Vol. 44. № 5. P. 964–968.
3. Moioli M., Valenzano Menada M., Bentivoglio G., Ferrero S. Peripartum cardiomyopathy // Arch. Gynecol. Obstet. 2010. Vol. 281. № 2. P. 183–188.
4. Colombo B., Ferrero S. Peripartum cardiomyopathy // Orphanet encyclopedia. 2004. P. 1–6.
5. Elkayam U., Akhter M.W., Singh H., Khan S., Bitar F., Hameed A., Shotan A. Pregnancy-associated cardiomyopathy: clinical characteristics and a comparison between early and late presentation // Circulation. 2005. Vol. 111. № 16. P. 2050–2055.
6. Fett J.D., Christie L.G., Carraway R.D., Murphy J.G. Five-year prospective study of the incidence and prognosis of peripartum cardiomyopathy at a single institution // Mayo Clin. Proc. 2005. Vol. 80. № 12. P. 1602–1606.
7. Ferrero S., Colombo B.M., Fenini F., Abbamonte L.H., Arena E. Peripartum cardiomyopathy. A review // Minerva Ginecol. 2003. Vol. 55. № 2. P. 139–151, 151–158.
8. Ansari A.A., Fett J.D., Carraway R.E., Mayne A.E., Onlamoon N., Sundstrom J.B. Autoimmune mechanisms as the basis for human peripartum cardiomyopathy // Clin. Rev. Allergy. Immunol. 2002. Vol. 23. № 3. P. 301–324.
9. Sliwa K., Skudicky D., Bergemann A., Candy G., Puren A., Sareli P. Peripartum cardiomyopathy: analysis of clinical outcome, left ventricular function, plasma levels of cytokines and Fas/Apo-1 // J. Am. Coll. Cardiol. 2000. Vol. 35. № 3. P. 701–705.
10. Sliwa K., Forster O., Libhaber E., Fett J.D., Sundstrom J.B., Hilfiker-Kleiner D., Ansari A.A. Peripartum cardiomyopathy: inflammatory markers as predictors of outcome in 100 prospectively studied patients // Eur. Heart. J. 2006. Vol. 27. № 4. P. 441–446.
11. Warraich R.S., Sliwa K., Damasceno A., Carraway R., Sundrom B., Arif G., Essop R., Ansari A., Fett J., Yacoub M. Impact of pregnancy-related heart failure on humoral immunity: clinical relevance of G3-subclass immunoglobulinss in peripartum cardiomyopathy // Am. Heart. J. 2005. Vol. 150. № 2. P. 263–269.
12. Fett J.D., Carraway R.D., Dowell D.L., King M.E., Pierre R. Peripartum cardiomyopathy in the Hospital Albert Schweitzer District of Haiti // Am. J. Obstet. Gynecol. 2002. Vol. 186. № 5. P. 1005–1010.
13. Helms A.K., Kittner S.J. Pregnancy and stroke // CNS Spectr. 2005. Vol. 10. № 7. P. 580–587.
14. Dickfield T., Gagliardi J.P., Marcos J., Russell S.D. Peripartum cardiomyopathy presenting as an acute myocardial infarction // Mayo Clin. Proc. 2002. Vol. 77. № 5. P. 500–501.
15. Pearson G.D., Veille J.C., Rahimtoola S., Hsia J., Oakley C.M., Hosenpud J.D., Ansari A., Baughman K.L. Peripartum cardiomyopathy: National Heart, Lung, and Blood Institute and Office of Rare Diseases (National Institutes of Health) workshop recommendations and review // JAMA. 2000. Vol. 283. № 9. P. 1183–1188.
16. Elkayam U., Tummala P.P., Rao K., Akhter M.W., Karaalp I.S., Wani O.R., Hameed A., Gviazda I., Shotan A. Maternal and fetal outcomes of subsequent pregnancies in women with peripartum cardiomyopathy // N. Engl. J. Med. 2001. Vol. 344. № 21. P. 1567–1571.
17. Murali S., Baldisseri M.R. Peripartum cardiomyopathy // Crit. Care. Med. 2005. Vol. 33. Suppl. 10. P. S340–S346.
18. Felix S.B., Staudt A., Landsberger M., Grosse Y., Stangl V., Spielhagen T., Wallukat G., Wernecke K.D., Baumann G., Stangl K. Removal of cardiodepressant antibodies in dilated cardiomyopathy by immunoadsorption // J. Am. Coll. Cardiol. 2002. Vol. 39. № 4. P. 646–652.
19. Frustaci A., Chimenti C., Calabrese F., Pierone M., Thiene G., Maseri A. Immunosuppressive therapy for active lymphocytic myocarditis: virological and immunologic profile of responders versus nonresponders // Circulation. 2003. Vol. 107. № 6. P. 857–863.
20. Беленков Ю.Н., Белянко И.Э., Коротеев А.В. и др. Имплантация экстракардиального сетчатого каркаса в лечении дилатационной кардиомиопатии. Рандомизированное клиническое исследование ТОЛК (терапевтическое и операционное лечение кардиомиопатии) // Кардиология. 2005. № 7. С. 4–9.
21. Коротеев А.В., Белянко И.Э., Долотов В.К., Нечаев А.И., Терновская Е.А., Кулагина Т.Ю., Варданян А.А., Трекова А.Н., Еременко А.А., Колпаков Е.П., Ховрин В.В. Имплантация экстракардиального сетчатого каркаса: новая хирургическая технология в лечении сердечной недостаточности // Международный журнал интервенционной кардиоангиологии. 2008. № 14. С. 60–61.
22. Медикаментозная терапия в комбинации с операцией имплантации экстракардиального сетчатого каркаса при лечении дилатационной кардиомиопатии беременных (клиническое наблюдение) / Ивашкин В.Т., Драпкина О.М., Корнеева О.Н., Коротеев А.В. // Тезисы II Конгресса Общества специалистов по сердечной недостаточности «Сердечная недостаточность 2007». Москва, 2007. С. 10.
Новости на тему
13.02.2025
14.05.2024
Отправить статью по электронной почте
Ваш адрес электронной почты:
В статье рассматривается клинический случай успешного лечения дилатационной кардиомиопатии беременных при сочетании лекарственной терапии и операции имплантации экстракардиального сетчатого каркаса.
Такой подход препятствует прогрессированию дилатации полостей сердца, способствует обратному ремоделированию левого желудочка и увеличению его насосной функции и позволяет достичь компенсации хронической сердечной недостаточности.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
