Мезотелиома плевры
- Аннотация
- Статья
- Ссылки






![Рис. 1. Перспективы индивидуализации лечения мезотелиомы плевры (Адаптировано по [112])](/upload/resize_cache/iblock/766/195_350_1/766360acde80c7415d0ed13bc8657caf.png)
Эпидемиология и этиология
Мезотелиома плевры (МП) – злокачественная агрессивно растущая опухоль, которая возникает при трансформации мезотелиальных клеток или аденокарциномы легкого. Первый случай злокачественной мезотелиомы был зарегистрирован в 1947 г. В 1960 г. J. Wagner и соавт. опубликовали данные об эпидемии злокачественной мезотелиомы среди шахтеров и впервые продемонстрировали взаимосвязь между временем контакта с асбестом и развитием этого заболевания. Продолжающийся рост уровня заболеваемости связан с широким использованием асбеста в прошлом веке (асбест довольно часто использовался в кораблестроении и строительстве, особенно в период с 1940 по 1979 г. в США и Европе, так как он обладает огнестойкими свойствами) [5]. В среднем латентный период от момента начала экспозиции и до постановки диагноза составляет 30 лет, этот период может варьировать от 20 до 50 лет [26], поэтому можно предположить, что уровень смертности от злокачественной мезотелиомы будет увеличиваться. Мужчины болеют значительно чаще, чем женщины, в соотношении 6:1 [1].
В мире добывают три основных типа асбестовых волокон: хризотил наиболее часто встречается в Канаде, России, Китае и Зимбабве; кроцидолит (голубой асбест) добывается в Южной Африке и Австралии; амозит (коричневый асбест) встречается обычно только в Южной Африке. Способность этих волокон вызывать развитие мезотелиомы плевры зависит от их физических характеристик, связанных с соотношением длины волокна к его диаметру: чем больше величина этого соотношения, тем выше канцерогенные характеристики этого минерала. Кроцидолит в 10 раз опаснее амозита, который, в свою очередь, в 10 раз опаснее хризотила [3, 4].
Механизм асбестового канцерогенеза еще не изучен до конца. В недавних исследованиях была продемонстрирована критическая роль фактора некроза опухоли альфа (TNF-α) и NF-kB-сигнала в процессе ответа мезотелиальных клеток человека на воздействие асбеста [5]. К другим факторам, участвующим в асбестовом канцерогенезе и развитии злокачественной мезотелиомы, относятся: трансформирующий фактор роста β (TGF-β), участвующий в стимуляции роста опухоли; тромбоцитарный фактор роста (PDGF), который, возможно, регулирует пролиферацию клеток злокачественной мезотелиомы; инсулиноподобный фактор роста (IGF), влияющий на пролиферацию опухоли и процессы миграции клеток [6]; интерлейкины IL-6 и IL-8, которые способствуют росту опухоли и развитию капиллярной сети [7]; сосудистый эндотелиальный фактор роста (VEGF), который также влияет на процессы опухолевого ангиогенеза [8]; и фактор роста гепатоцитов (HGF), стимулирующий миграцию клеток мезотелиомы и отвечающий за процессы опухолевой инвазии [9]. Роль этих факторов в развитии злокачественной мезотелиомы уточняется.
При мезотелиомах наблюдаются типичные хромосомные альтерации, которые включают потерю участка (р) короткого плеча хромосом 1, 3 и 9, длинного плеча хромосом 6, 13 и 15 [10]. Кроме того, часто отмечается потеря целой копии хромосомы 4 или 22. Многие хромосомные изменения могут возникать в тандеме в данной опухоли, что позволяет предположить многоступенчатый характер патогенетического процесса. Для мезотелиомы характерна потеря генов опухолевой супрессии, например, CDKN2A/ARF и CDKN2B, локализующихся на участке 9р21, и NF2 – на участке 22q12. Ген CDKN2A/ARF кодирует процессы опухолевой супрессии р16(INK4a) и р14(ARF), являясь составляющими рRb и р53 клеточного регуляторного цикла соответственно. Ген CDKN2B кодирует процессы опухолевой супрессии р15(INK4b) – другого блокатора клеточного цикла. Делеция CDKN2A/ARF и CDKN2B выявляется в 50–80% мезотелиом, потеря экспрессии р16(INK4a) выявлена в 100% случаев (12 из 12) мезотелиом при проведении иммуногистохимического анализа [11]. Делеция CDKN2A/ARF локуса ослабляет как pRb-, так и р53-пути опухолевой супрессии.
Мутации NF2 определяются приблизительно в 50% мезотелиом [12]. Они могут влиять на патогенез мезотелиомы путем усиления процессов пролиферации и инвазии опухолевых клеток. Потеря NF2 также неблагоприятно воздействует на фокусную адгезию киназ (FAK) – ключевого компонента клеточного пути, влияющего на процессы миграции и инвазии [13]. Существуют другие этиологические факторы (помимо контакта с асбестом), влияющие на развитие злокачественной мезотелиомы. Например, минерал эрионит [26, 27, 29, 14, 15, 16], обезьяноподобный вирус SV-40 ассоциируются с развитием злокачественной мезотелиомы [17, 18]. Наиболее вероятным путем поступления вируса в организм является введение поливакцины, выпускавшейся с 1955 по 1978 г. [19]. Анализ клеток злокачественной мезотелиомы человека показал, что последовательность оснований SV-40 присутствует в опухолевых клетках, чего не наблюдается в соседних нормальных тканях мезотелия [2, 20, 21]. SV-40 продуцирует два белка-онкогена: большой Т- и малый т-антигены.
При изучении биопсированных тканей злокачественной мезотелиомы человека было выявлено, что большой Т-антиген (Tag) присоединяется и ингибирует белки опухолевой супрессии р53 и pRb, что стимулирует процессы канцерогенеза. Другими словами, присоединение Tag к p53, p300, pRb, с одной стороны, инактивирует процессы опухолевой супрессии, с другой – комплекс Tag-p53-p300-pRb обладает своей собственной онкогенной активностью посредством активации IGF-1/IGFR-пути. Малый т-антиген (tag) ингибирует клеточную фосфатазу 2А (РР2А) белка, участвующего в процессах дефосфорилирования многих протеинов, включая компоненты МАР-киназного (МАРК) патогенетического пути. Малый т-антиген через блокаду РР2А может активировать МАРК-сигнальный путь и активизировать АР-1. Тот факт, что SV-40 и асбест могут быть ко-канцерогенами, впервые был продемонстрирован M. Bocchetta и соавт. [22] и подтвержден данными B. Kroczynska и соавт. [23]. Существует три гистологических подтипа мезотелиомы плевры: эпителиальная, саркоматоидная или фибросаркоматоидная и смешанная [24]. При первом гистологическом подтипе можно говорить о благоприятном прогнозе, наличие второго и третьего свидетельствует о неблагоприятном прогнозе заболевания.
Клинические проявления и диагностика мезотелиомы плевры
Мезотелиома плевры обычно диагностируется в возрасте 50–70 лет, 70–80% пациентов – мужчины. Если заболевание диагностируется у молодых людей (20–40 лет), в анамнезе имеется контакт с асбестом в детском возрасте [25]. Мезотелиома имеет тенденцию к локорегионарному росту, ограничиваясь гемитораксом [14, 26, 27]. Рост мезотелиомы обычно медленный, поэтому симптомы появляются уже в поздней стадии заболевания. Иногда в плевральной полости выявляется жидкость, которая со временем убывает, и лишь спустя несколько лет может быть поставлен диагноз «мезотелиома плевры». Тенденция распространения мезотелиомы вначале по плевре, а затем на соседние структуры (мышцы, ребра, диафрагму) крайне затрудняет раннюю диагностику заболевания. В то же время при аутопсии более чем у 70% пациентов отмечается инвазия опухоли в лимфатические узлы грудной клетки, а отдаленные метастазы в печень, легкие, почки, надпочечники, кости выявляются у 50% больных [28].
Диагностика МП довольно сложна. Дифференциальный диагноз необходимо проводить с метастатическим поражением плевры при различных первичных злокачественных опухолях (аденокарцинома легкого, рак молочной железы, рак яичников и другие). Затруднительна дифдиагностика между синовиальной саркомой и мезотелиомой плевры [29]. Диагноз обычно устанавливается после цитологического исследования плевральной жидкости, торакоскопии и биопсии плевры [28]. Важно отметить, что для постановки точного диагноза необходимо провести иммуногистохимическое исследование [29]. Компьютерная томография (КТ) с внутривенным контрастированием является первой ступенью в постановке диагноза злокачественной мезотелиомы – она позволяет получить изображение всей поверхности плевры, диафрагмы, а также медиастинальных лимфатических узлов.
Магнитно-резонансная томография (МРТ) не используется рутинно для диагностики заболевания, это исследование необходимо для получения заключения о потенциальной резектабельности опухоли. При позитронно-эмиссионной томографии (ПЭТ) происходит полуколичественная оценка метаболической активности очагов, при этом стандартизированный объем захвата контрастного вещества значительно выше при злокачественной мезотелиоме, чем при других доброкачественных опухолях плевры. В одном исследовании было показано, что при проведении дифференциальной диагностики доброкачественных и злокачественных заболеваний плевры чувствительность метода составляет 96,8%, специфичность – 88,5% [30]. ПЭТ-сканирование также помогает выявить метастатические медиастинальные лимфоузлы [31]. Таким образом, комбинация метаболической и анатомической оценок полезна для определения стадии и предоперационного изучения опухоли.
Существует не менее 6 различных систем стадирования для злокачественной мезотелиомы, однако ни одна из них не коррелирует с прогнозом заболевания [111]. Недавно International Mesothelioma Interest Group (IMIG) было предложено стадирование по системе TNM, аналогичное тому, что используется при немелкоклеточном раке легкого [32]. Для выживаемости больных важен ответ опухоли на лечение. Критерии опухолевого ответа WHO и RECIST непригодны для оценки большой сферической опухоли. В настоящий момент опубликованы модифицированные критерии RECIST со специальной ссылкой на мезотелиому плевры [33]. Оценка ответа на лечение производится путем измерения размера опухоли в области наибольшего его перпендикуляра к грудной стенке в двух местах на трех различных уровнях КТ-снимка.
Сывороточные маркеры, используемые для ранней диагностики и мониторирования прогрессирования заболевания
В некоторых работах высказаны предположения, что для ранней диагностики, дифференцировки, оценки ответа на лечение и прогноза МП можно использовать такие маркеры, как остеопонтин, мезотелин или мегакариоцит-потенцирующий фактор. Остеопонтин – гликопротеид, гиперэкспрессия которого наблюдается при раке легкого, молочной железы, колоректальном раке, раке желудка, яичников и меланоме. Недавно получены данные, указывающие на его потенциальное использование при мезотелиоме [34], – информативность остеопонтина в прогнозе развития мезотелиомы эквивалентна СА-125 при раке яичников. Чувствительность и специфичность остеопонтина к мезотелиоме составляют 77% и 85% соответственно [35].
Мезотелин – мембранный гликопротеин, экспрессируемый мезотелиальными клетками, его гиперэкспрессия характерна для злокачественной мезотелиомы [36]. Эти белки являются потенциальными сывороточными маркерами заболевания [37]. У большинства пациентов с мезотелиомой отмечен повышенный уровень мезотелина в крови, чувствительность этого маркера составляет 80–83%, а специфичность – 80–100% [38–40]. Повышение уровня мезотелина наиболее характерно для эпителиоидного подтипа опухоли [41].
Мегакариоцит-потенцирующий фактор (MPF) секретируется клетками нескольких клеточных линий мезотелиомы. В одном из исследований были получены данные о повышении уровня этого маркера в 91% случаев у 56 пациентов с диагнозом мезотелиомы плевры по сравнению с контрольной группой. При проведении хирургического лечения пациентов с перитонеальной мезотелиомой уровень MPF снижался до нормальных значений [41, 42]. Таким образом, MPF можно использовать для мониторирования ответа злокачественной мезотелиомы на лечение.
Хирургическое лечение
Роль хирургии в лечении злокачественной мезотелиомы еще до конца не определена. Полное удаление опухоли хирургическим путем является возможным вариантом лечения у небольшого числа пациентов с МП. Выполняются три основные хирургические процедуры: хирургический плевродез посредством видеоассистируемой торакоскопии, а также две циторедуктивные операции – плеврэктомия с декортикацией и экстраплевральная пневмонэктомия.
Экстраплевральная пневмонэктомия включает в себя удаление единым блоком легкого, прилегающих лимфатических узлов, перикарда и вовлеченных участков диафрагмы. Впервые операция была выполнена в 1980 г. с целью достижения локорегионарного контроля заболевания. Первые результаты указывали на увеличение выживаемости при хирургическом вмешательстве у пациентов с I стадией заболевания, преимущественно с эпителиальной формой опухоли, при этом уровень послеоперационной смертности и осложнений был достаточно высок и составлял 10–20% [43]. В 1990-е гг. удалось значительно снизить уровень смертности – до 5–10% [44, 45]. D.J. Sugarbaker и соавт. сообщали об уровне послеоперационной смертности 3,4% у 328 пациентов, подвергшихся экстраплевральной пневмонэктомии за период с 1980 по 2000 г. [46–48]. Значительное уменьшение уровня операционной смертности было связано в первую очередь с накоплением опыта проведения хирургического вмешательства в данном объеме, более тщательным обследованием пациентов, интенсификацией лечения осложнений и привлечением высококвалифицированного персонала. Дооперационные критерии отбора включают в себя: хорошее физическое состояние пациентов, наличие достаточного кардиопульмонального резерва, а также отсутствие местнораспространенной или диссеминированной форм заболевания. Аналогичное снижение уровня послеоперационной смертности было получено в большинстве других исследований [49].
Плеврэктомия с декортикацией ассоциируется с меньшим количеством послеоперационных осложнений, уровень смертности составляет 1–2% при выполнении данной операции высококвалифицированными специалистами, однако отмечается больший процент местных рецидивов [50, 51]. Операция включает в себя отсепаровывание опухоли и висцеральной плевры от легочной паренхимы. Данный объем операции рекомендуется выполнять пациентам, подлежащим экстраплевральной пневмонэктомии, однако у некоторых не хватает кардиопульмонального резерва для выполнения данного объема хирургического вмешательства. Недавно были опубликованы результаты исследования R.M. Flores, в котором 663 пациентам было выполнено хирургическое вмешательство либо в объеме экстраплевральной пневмонэктомии, либо в объеме плеврэктомии с декортикацией [52]. Послеоперационный уровень смертности был выше в группе экстраплевральной пневмонэктомии – 7%, в группе плеврэктомии с декортикацией он составил 4%. С учетом статистической достоверности уровень выживаемости был выше в группе плеврэктомии.
Большинство клиницистов рекомендуют проведение комплексной терапии мезотелиомы, так как хирургическое вмешательство без адъювантной терапии ассоциируется с высоким уровнем местных рецидивов. Возможно проведение химиотерапии (ХТ) и/или лучевой терапии (ЛТ) в адъювантном режиме, а также индукционной химиотерапии [53, 54]. Однако вопрос применения неоадъювантной химиотерапии остается дискутабельным, аргументами для ее проведения являются лучшая переносимость лечения до хирургического этапа и уменьшение объема опухоли, контраргументом – увеличение риска хирургического вмешательства после неоадъювантной химиотерапии. Недавно был проведен сравнительный анализ данных литературы по выживаемости больных с мезотелиомой плевры, подвергшихся различным видам лечения (табл. 1) [114].
Как видно из таблицы 1, наилучшие результаты по выживаемости получены при проведении комплексного лечения (операция + ЛТ + ХТ), однако при проведении индукционной химиотерапии медиана выживаемости недостоверно выше. Мы считаем, что необходимы дальнейшие исследования для определения роли химиотерапии в комплексном лечении МП. Несколько вопросов относительно хирургического лечения МП остались неразрешенными, а именно – критерии отбора пациентов для хирургического лечения, оптимального объема и срока проведения хирургического вмешательства.
Лучевая терапия
Лучевой терапии обычно отводится роль паллиативного варианта лечения после проведения ХТ или после хирургического вмешательства. Так как МП чаще всего выявляется в диссеминированной форме с поражением соседних органов, таких как легкие, пищевод, сердце и печень, то использование ЛТ в качестве первичной терапии невозможно у большинства больных. В исследовании C.J. Linden и соавт. [55] изучение лучевой терапии осуществлялось в монорежиме и в комбинации с химиотерапией. Практически у всех пациентов был зарегистрирован постлучевой фиброз легких на фоне отсутствия значимых результатов лечения. Медиана выживаемости составила 6 месяцев.
В недавно опубликованном обзоре Cochrane Collaboration данные по радикальной ЛТ мезотелиомы плевры или в комбинации с другими методами лечения указывают на отсутствие эффекта от ее проведения, отмечено достоверное увеличение уровня смертности до 17% и выше [56]. Использование паллиативной ЛТ возможно при наличии болей в грудной клетке или при местных рецидивах опухоли после хирургического вмешательства. Считается, что короткие курсы ЛТ (например, 20 Гр за 5 фракций) так же эффективны, как и пролонгированные курсы (30 Гр за 10+ фракций) [56].
Изучается роль ЛТ в составе комбинированного лечения пациентов с МП. В первую очередь рассматривается комбинация хирургического лечения и облучения с целью уменьшения уровня рецидивов и увеличения выживаемости [57, 58]. Обычно облучение гемиторакса комбинируется с экстраплевральной пневмонэктомией, и в случае корректного определения стадии заболевания медиана выживаемости увеличивается до 33 месяцев [59]. Недавно стали изучать использование интенсивно-модулируемого облучения (IMRT) для лечения МП. Эта техника облучения позволяет увеличить дозу ЛТ в области высокого риска возникновения рецидива, при этом значительно уменьшается лучевая нагрузка на соседние органы.
В одном исследовании (n = 100) проводилось комбинированное лечение: на первом этапе – экстраплевральная пневмонэктомия, на втором – IMRT (медиана дозы 45 Гр, n = 63) [60]. Медиана общей выживаемости в группе пациентов с IMRT составила 14,4 месяца, в другой группе – 10 месяцев. Местный рецидив заболевания выявлен в трех случаях. В работе A.M. Allen и соавт. (n = 13) отмечено 6 случаев фатальной легочной токсичности при проведении IMRT после ХТ и экстраплевральной пневмонэктомии [61]. Таким образом, использование интесивно-модулируемого облучения является перспективным направлением развития в лечении МП, однако на сегодняшний день данный вариант облучения не может быть рекомендован для использования в клинической практике.
Комплексное лечение МП состоит из последовательной комбинации трех методов терапии: химиотерапия + хирургия + послеоперационная ЛТ. Недавние результаты исследований II фазы продемонстрировали медиану выживаемости 29 месяцев у пациентов, которым комплексное лечение было проведено полностью [62, 63]. Комплексный подход не был изучен в многоцентровых исследованиях, а небольшие ретроспективные работы не смогли доказать эффективность комплексного лечения по сравнению с экстраплевральной пневмонэктомией [66]. Такое лечение характеризуется высоким уровнем осложнений и даже смертности, при этом большая часть случаев является следствием хирургических вмешательств. Хочется отметить, что имеющиеся данные ограниченны и неубедительны. До тех пор пока не будут получены данные проспективных многоцентровых рандомизированных исследований, пациенты, являющиеся кандидатами для такого вида терапии, должны проходить лечение в рамках исследований в специальных клиниках.
Лекарственная терапия
Лекарственная терапия – единственный вариант лечения для большинства пациентов с мезотелиомой, у которых возраст, сопутствующие заболевания, гистологический тип (неэпителиальная опухоль) и местнораспространенная форма заболевания являются препятствиями для выполнения операции.
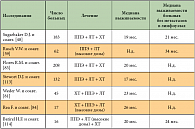
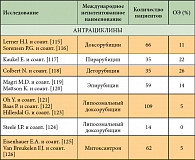
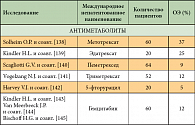
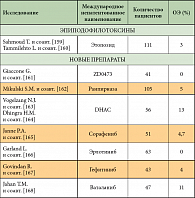
Многие годы химиотерапия считалась малоэффективной при данном заболевании. Было проведено много исследований эффективности цитостатиков в монотерапии при МП. Составлен полный список препаратов, применявшихся при мезотелиоме плевры в последние 10 лет. В него входят препараты различных групп, таких как антрациклины и антрациноиды (доксорубицин, эпирубицин, митоксантрон, пирарубицин, деторубицин, липосомальный доксорубицин); алкилирующие препараты (циклофосфан, ифосфамид, митоксантрон С); препараты платины (цисплатин, карбоплатин, оксалиплатин); винкаалкалоиды (викристин, винбластин, виндезин, винфлюнин); таксаны (паклитаксел, доцетаксел); антиметаболиты (5-фторурацил, метотрексат, гемцитабин, эдатрексат, пеметрексед, триметрексат), а также биологические препараты (БЦЖ, интерферон-α, -β и -γ, интерлейкин-2). При лечении этими препаратами общая эффективность варьирует от 10 до 30% (табл. 2) [65]. Многие факторы препятствовали развитию эффективного системного лечения мезотелиомы. Это заболевание относительно редко встречается, в проводимых клинических исследованиях отсутствует рандомизация, они малочисленны. Оценка ответа на лечение затруднена из-за сложностей визуализации и измерения очагов, располагающихся на плевре.
В обзоре исследований, проведенном T. Berghmans и соавт. [66], получены данные о том, что цисплатин является наиболее активным препаратом в монотерапии мезотелиомы плевры; отмечено, что карбоплатин обладает аналогичной эффективностью, а в комбинации с доксорубицином отмечен более высокий уровень ответа по сравнению с другими схемами терапии, однако сделать однозначный вывод о достоверном увеличении выживаемости нельзя. При монотерапии винорельбином и лечении по схеме MVP (митомицин С, винбластин, цисплатин) отмечено снижение клинических проявлений заболевания при приемлемом уровне токсичности. В период с 1980 по 1990 г. активно изучалась роль биологических препаратов в лечении солидных и гематологических опухолей, основной целью исследований в то время являлась активизация иммунного ответа. Интерфероны и интерлейкины использовались системно и внутриплеврально, при этом получен низкий уровень эффективности.
В большинстве клинических исследований использовались комбинации препаратов. При составлении схем химиотерапии пытались объединить наиболее эффективные цитостатики с различным профилем токсичности. В большинстве этих комбинаций как в проспективных исследованиях II фазы, так и в некоторых рандомизированных исследованиях III фазы использовались антрациклины (эпирубицин, доксорубицин) и препараты платины (цисплатин, карбоплатин), в последние несколько лет в схемы лечения был включен гемцитабин [65]. Схему лечения «цисплатин/карбоплатин + гемцитабин», широко используемую при НМРЛ, начали интенсивно изучать при мезотелиоме плевры в Австралии, довольно скоро ее стали широко применять во многих онкологических центрах, несмотря на то, что полученная эффективность была не выше, чем у других комбинаций. По всей видимости, токсический профиль этой схемы был низок, что сделало ее привлекательной для клиницистов [67].
Комбинированная химиотерапия не позволила значимо увеличить уровень или длительность ответа при сравнении с монохимиотерапией. В 90-е годы прошлого века наиболее популярными схемами стали комбинации препаратов платины и антрациклинов или гемцитабина (табл. 3) [65]. Комбинация липосомального доксорубицина, гемцитабина и карбоплатина изучалась у 167 пациентов во II фазе исследования Скандинавской группы по изучению мезотелиомы, при этом уровень ответа составил 33%. Это исследование было начато до утверждения в качестве стандарта I линии лечения МП схемы «цисплатин + пеметрексед». У 23% пациентов лечение было приостановлено по причине гематологической токсичности, однолетняя выживаемость составила 50% [68].
Недавно появился повышенный интерес к использованию антифолата пеметрекседа (Алимта®) – нового мультитаргетного препарата с широким спектром противоопухолевой активности, включая рак легкого, толстой кишки, мочевого пузыря, головы и шеи, шейки матки и молочной железы [69]. Противоопухолевый механизм действия препарата заключается в блокировании трех различных ферментов, необходимых для метаболизма фолатов, синтеза пуринов и пиримидинов (дегидрофолатредуктазы, тимидилатсинтетазы и глицинамид-рибонуклеотид-формилтрансферазы) [69].
N.J. Vogelzang и соавт. [70] провели рандомизированное исследование III фазы по изучению эффективности комбинации цисплатина и пеметрекседа. Рандомизация ранее не леченных пациентов (n = 456) проводилась в две группы, в одной из которых назначалась схема «цисплатин + пеметрексед», в другой – цисплатин в монотерапии. Главной целью данного исследования стало изучение общей выживаемости, второстепенными задачами – изучение уровня эффективности, времени до прогрессирования и длительности ответа. Больные из группы «цисплатин + пеметрексед» получили в среднем 6 курсов ХТ. Наиболее частыми проявлениями гематологической токсичности были нейтропения 3-й и 4-й степени (28%) и лейкопения (18%). Негематологическая токсичность 3-й степени включала тошноту (15%), повышенную утомляемость (10%) и рвоту (13%). Токсические проявления чаще регистрировались в группе ПХТ. Эффективность также была выше в этой группе и составила 42% против 17% в группе монотерапии цисплатином (р < 0,001), медиана времени до прогрессирования – 5,7 против 3,9 месяца (р < 0,001), медиана общей выживаемости – 12,1 против 9,3 месяца (р = 0,02) соответственно. У пациентов, получавших сопроводительную витаминотерапию, медиана выживаемости составила 13,3 месяца против 10 среди пациентов, не получавших витамины (р = 0,051). Таким образом, комбинация пеметрекседа и цисплатина достаточно эффективна и хорошо переносима. Полученные результаты позволили сделать вывод о том, что комбинация «цисплатин + пеметрексед» открыла новую эру в лечении МП, в связи с чем Food and Drug Administration (FDA) разрешила применять эту схему в качестве стандартного лечения пациентов с диссеминированной формой МП.
Менее токсичной может быть комбинация пеметрекседа с карбоплатином. Во II фазе исследования проводилось изучение эффективности этой комбинации у пациентов (n = 102) с ранее не леченной МП [71]. Уровень частичной регрессии составил 18%, стабилизации – 50%, медианы общей выживаемости и безрецидивной выживаемости равны 12,7 и 6,5 месяца соответственно. Лечение хорошо переносимо, в 100% случаев введение цитостатиков было выполнено в запланированной дозе. Таким образом, схема «карбоплатин + пеметрексед» может быть альтернативным вариантом лечения. Другой препарат из группы антифолатов – ралтитрексед – в комбинации с цисплатином также продемонстрировал увеличение выживаемости при МП, медиана общей выживаемости увеличилась с 8,8 месяца при монотерапии цисплатином до 11,4 месяца при лечении комбинацией (р = 0,05) [72]. Результаты этого исследования еще раз подтвердили возможность использования комбинации цисплатина с антифолатами при мезотелиоме плевры.
Препараты из группы винкаалкалоидов неэффективны при мезотелиоме, исключение составляет винорельбин. При назначении в монотерапии у леченых больных уровень ответа составляет 24%, стабилизация – 55%, медиана общей выживаемости – 10,9 месяца, отмечена хорошая переносимость лечения [73]. При оценке качества жизни было отмечено улучшение психологического и физического самочувствия у 41% больных, уменьшение болей, кашля и улучшение общего самочувствия – у 48%. При изучении комбинации винорельбина с оксалиплатином уровень эффективности не увеличивается и составляет 23% [74].
Не существует четких указаний относительно оптимального времени начала химиотерапии. Общепринятая тенденция заключается в откладывании лечения при хорошем самочувствии пациента после начальных терапевтических мероприятий. Однако подобный подход уязвим, так как переход от состояния «слишком здоров для проведения химиотерапии» к состоянию «слишком болен для проведения химиотерапии» бывает неожиданно быстрым, вследствие чего многие пациенты упускают возможность получить системную терапию [75, 76]. Назначение химиотерапии не должно откладываться, ее необходимо начинать до появления функционально-клинических нарушений.
Оптимальная продолжительность химиотерапии обсуждается, были получены данные об отсутствии достоверного увеличения эффективности терапии при проведении более 6 курсов ХТ. Таким образом, проведение химиотерапии необходимо прекратить при наличии прогрессирования заболевания, появлении 3–4-й степени токсичности или после окончания 6-го курса лечения.
В настоящее время при прогрессировании МП после проведения I линии лечения и хорошем общем статусе больного рекомендуется провести химиотерапию II линии. У больных, не получавших ранее пеметрексед, стандартом лечения является монотерапия данным препаратом во II линии [77]. Для пациентов, ранее получавших пеметрексед, на сегодняшний день не существует стандартных рекомендаций. В качестве вариантов второй линии могут быть рекомендованы схемы: гемзар + цисплатин, навельбин в монотерапии или в комбинации с цисплатином. В отдельных случаях при длительной ремиссии после I линии терапии пеметрекседом возможно его повторное назначение в комбинации. Однако эти рекомендации не являются стандартом лечения МП. Вышеперечисленные факты позволяют рассматривать II линию лечения МП как идеальное поле для изучения новых препаратов и терапевтических стратегий.
Неоадъювантная химиотерапия
Трудности в проведении адъювантной химиотерапии у пациентов с экстраплевральной пневмонэктомией и внедрение в клиническую практику эффективных схем лечения стали стимулом к началу изучения неоадъювантного подхода в лечении МП (табл. 4) [78, 79].
В пилотном исследовании W. Weder и соавт. [80] 19 пациентам с мезотелиомой плевры T1–3N0–2M0 было проведено 3 курса неоадъювантной химиотерапии по схеме «цисплатин + гемцитабин». Уровень ответа составил 32%, экстраплевральная пневмонэктомия была выполнена 16 больным, послеоперационная ЛТ – 13 пациентам. Медиана выживаемости составила 23 месяца, однолетняя и двулетняя выживаемость – 79% и 37% соответственно [80]. Полученные результаты соответствовали данным многоцентрового исследования II фазы (SAKK 17/00) (n = 61) [81]. Уровень резектабельности опухоли – 61%, медиана выживаемости для всей популяции – 19,8 месяца, 45 больным произведена экстраплевральная пневмонэктомия, медиана выживаемости этой группы составила 23 месяца. После проведения промежуточного анализа этих двух исследований уровень послеоперационных осложнений и смертности составил 62% и 3,2% соответственно, что сравнимо с данными, полученными при выполнении только экстраплевральной пневмонэктомии [82].
Недавно R.M. Flores и соавт. [83] опубликовали результаты II фазы исследования (n = 21) комплексного лечения (индукционная ХТ + экстраплевральная пневмонэктомия + высокодозная ЛТ) при местнораспространенной стадии МП. Пациенты, получившие 4 курса химиотерапии по схеме «цисплатин + гемцитабин», при отсутствии признаков прогрессирования заболевания подвергались хирургическому лечению в объеме экстраплевральной пневмонэктомии и адъювантному облучению гемиторакса (СОД 54 Гр). После проведения химиотерапии частичная регрессия (ЧР) зарегистрирована в 26% случаев, хирургический этап лечения выполнен у 8 из 9 пациентов. Медиана общей выживаемости (ОВ) составила 19 месяцев, медиана выживаемости пациентов с экстраплевральной пневмонэктомией – 33,5 месяца.
F. Rea и соавт. [84] представили данные комплексного лечения (индукционная химиотерапия по схеме «карбоплатин + гемцитабин», экстраплевральная пневмонэктомия, послеоперационная ЛТ СОД 45 Гр) у 21 пациента. Уровень резектабельности составил 81%, послеоперационных осложнений – 52%. Медиана выживаемости всех пациентов – 25,5 месяца, пятилетняя выживаемость пациентов с экстраплевральной пневмонэктомией – 24%. Общие предварительные результаты комплексного лечения с включением неоадъювантной химиотерапии обнадеживают, однако необходимо подтвердить их большим количеством наблюдений. Проводятся исследования с использованием схемы «цисплатин + пеметрексед» в индукционном режиме [85, 86]. Первые предварительные результаты указывают на более высокую эффективность этой схемы в сравнении с комбинацией «цисплатин + гемцитабин» [87].
Индивидуализация системной терапии мезотелиомы плевры
В последнее время наметился прогресс в изучении системной терапии мезотелиомы плевры в связи с появлением препаратов из группы антифолатов (пеметрексед, ралтитрексед). Были разработаны стандарты химиотерапии (платиновые производные + антифолаты) в лечении больных с мезотелиомой [88, 89]. Медиана выживаемости при использовании этой дуплетной комбинации увеличилась с 12 до 15 месяцев. Персонализация химиотерапии – это та стратегия, которая может привести к улучшению клинического исхода заболевания. В двух исследованиях появились данные о прогностическом значении биомаркеров при лечении пеметрекседом. Корреляция между экспрессией опухолью белков тимидилатсинтетазы и безрецидивной и общей выживаемостью отмечена у пациентов, пролеченных комбинацией «пеметрексед + карбоплатин», у которых гиперэкспрессия тимидилатсинтетазы ассоциируется с плохим прогнозом заболевания [90, 91]. Другие биомаркеры, такие как дегидрофолатредуктаза, глицинамид-рибонуклеотид-формилтрансфераза, могут помочь в определении чувствительности мезотелиомы к терапии пеметрекседом [92, 93].
В поисках прогностических маркеров для определения чувствительности к препаратам платины опухолевые ткани исследуются на экспрессию кросс-комплементирующих генов эксцизионной репарации 1 группы (ERCC 1), изучаются механизмы транспорта платины. Небольшое число цитостатиков проявляют свою активность при мезотелиоме плевры, поэтому необходимо дальнейшее изучение биомаркеров, которые помогут добиться улучшения клинических исходов и избежать проведения неэффективного, токсичного лечения.
Таргетная терапия
Продолжается дальнейшее развитие таргетных препаратов, что позволит расширить терапевтические подходы к лечению мезотелиомы плевры. Как отмечалось выше, гиперэкспрессия рецептора эпидермального фактора роста отмечена у большинства пациентов с МП [94, 95], сосудистый эндотелиальный фактор роста и тромбоцитарный фактор роста являются важными звеньями аутокринной регуляции этого заболевания [96, 97]. Исследования, изучающие ингибиторы тирозинкиназы EGFR (гефитиниб и эрлотиниб), продемонстрировали низкую активность этих препаратов при МП [98, 99], аналогичные результаты были получены в исследованиях с иматинибом [100]. При немелкоклеточном раке легкого отсутствие EGFR-мутаций подтверждает нечувствительность опухоли к гефитинибу и эрлотинибу, этим можно объяснить резистентность МП к ингибиторам тирозинкиназы EGFR [94, 101].
Бевацизумаб – рекомбинантное человеческое анти-VEGF моноклональное антитело, блокирующее прикрепление VEGF к рецепторам, – изучается в двойном слепом плацебоконтролируемом рандомизированном исследовании II фазы в комбинации с цисплатином и гемцитабином. Набор пациентов в это исследование уже закончен; промежуточный анализ показал, что медиана безрецидивной выживаемости составила 6,4 месяца, медиана общей выживаемости – 15,7 месяца, однолетняя выживаемость – 60,1%. Было показано, что VEGF может быть фактором прогноза только безрецидивной и общей выживаемости [102].
В стадии изучения находятся другие таргетные препараты: цедираниб (Astra Zeneca) – ингибитор тирозинкиназ VEGFR-2, PDGFR-β и B-Raf, вориностат – ингибитор гистон-деацетилазы, оба эти препарата вошли в исследование Southwest Oncology Group S0905 и международное исследование III фазы, в котором проводится сравнение вориностата с симптоматической терапией [103, 104]. Бортезомиб – протеосомный ингибитор, который продемонстрировал свою активность на преклиническом этапе при МП. Механизм действия его осуществляется через блокаду ангиогенеза и ядерной транскрипции фактора NF-kB, который, в свою очередь, является ключевым клеточным эффектором развития химиорезистентности при МП [105, 106]. Продолжается международное многоцентровое исследование по изучению этого препарата [107].
В MD Anderson Cancer Center проводилось исследование по неоадъювантному назначению дазатиниба, предполагающее двукратное взятие биопсии – на этапе до начала лечения и через 4 недели лечения дазатинибом. Это исследование основано на данных, полученных на доклиническом этапе, где дазатиниб in vitro проявил свою активность в клеточных линиях мезотелиомы. Мишенью препарата являются киназы BCR-ABL, семейство SRC, c-Kit, EPHA2 и PDGFRβ [108, 109]. Первичной целью данной работы было определить биомаркерные изменения SRC Tyr-киназ [109], вторичной – оценить выживаемость, эффективность, безопасность, выполнить анализ антиангиогенных биомаркеров в опухолевой ткани, плазме крови и плевральной жидкости. Пациенты с клиническим или молекулярным ответом на дазатиниб в неоадъювантном режиме продолжали лечение препаратом в течение двух лет после выполнения циторедуктивной операции.
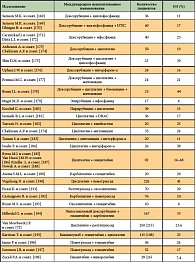
Таким образом, была персонализирована адъювантная фаза лечения. Предварительные результаты указали на то, что существует субпопуляция пациентов с мезотелиомой, ответивших на лечение дазатинибом, и что экспрессия SRC Tyr-киназ [109] является потенциальным маркером прогноза [110]. Это исследование является образцом будущего изучения эффективности лекарственного лечения при мезотелиоме. Существует мнение, что в ближайшие 5–10 лет появится некоторое количество предиктивных и прогностических молекулярно-генетических биомаркеров, которые можно будет использовать в клинической практике для персонализации лечения. На рисунке 1 представлен концептуальный дизайн персонализации комплексного лечения локализованной формы заболевания.
Заключение
В последние годы большой шаг вперед был сделан в попытке расширить терапевтические возможности для пациентов с мезотелиомой плевры. Пожалуй, наиболее существенным достижением можно считать принятие комбинации «пеметрексед (Алимта®) + цисплатин» в качестве стандарта лечения диссеминированной формы заболевания. Эта комбинация позволяет улучшить как выживаемость, так и качество жизни таких больных. Для пациентов с локализованной формой МП основным методом лечения считается хирургическое вмешательство, целями которого являются циторедукция и временное ослабление симптомов болезни.
Роль неоадъювантной химиотерапии продолжает изучаться, полученные результаты необходимо подтвердить дополнительными исследованиями. Комплексное лечение мезотелиомы плевры, включающее химиотерапию, хирургию и послеоперационное облучение, также находится в стадии изучения. До тех пор пока не будут получены данные проспективных многоцентровых рандомизированных исследований, пациентам рекомендовано проходить такое лечение в рамках клинических исследований.
В настоящий момент не существует стандартов II линии химиотерапии. В отдельных случаях возможен возврат к терапии пеметрекседом, в других можно рекомендовать назначение комбинации «гемцитабин + цисплатин» или монотерапию винорельбином. Наметилась тенденция индивидуализации системного лечения мезотелиомы плевры, что связано с появлением предиктивных и прогностических молекулярно-генетических биомаркеров, которые можно будет использовать в клинике для персонализации лечения. Продолжается дальнейшее развитие таргетных препаратов, что позволит расширить терапевтические подходы к лечению МП. Многие вопросы остаются пока без ответа, поэтому исследования с целью улучшения терапевтических подходов в лечении этой категории пациентов должны быть продолжены.
