Микробиота кишечника и метаболом у больных, получающих перитонеальный диализ
- Аннотация
- Статья
- Ссылки
- English



Введение
По данным зарубежных популяционных регистров и исследований, распространенность хронической болезни почек (ХБП) среди населения составляет 10–13%, достигая 20% в группах высокого риска, что сопровождается широким спектром социально значимых заболеваний. В последние годы исследование микробиома человека, в частности микробиоты кишечника, представляет большой интерес для ученых коллективов по всему миру. ХБП тесно связана с дисбалансом микробиома человека не только из-за своих специфических проявлений, таких как уремия, хроническое воспаление, иммуносупрессия, но и в связи с фармакологической нагрузкой и диетическими ограничениями. Группа больных с терминальной стадией ХБП, получающая заместительную почечную терапию методом постоянного амбулаторного перитонеального диализа (ПАПД), представляет большой интерес в изучении изменений микробиома в связи с дополнительными факторами воздействия на организм, связанными с особенностью методики. Нахождение в брюшной полости диализирующего раствора с глюкозой и перитонеального катетера – немаловажные факторы, влияющие на микробиом человека.
Измененная микробиота играет важную роль в продукции, циркуляции и накоплении разнообразных уремических токсинов, ответственных за возникновение типичных осложнений ХБП (прогрессирование сердечно-сосудистых заболеваний, сосудистая кальцификация, инфекции, диализный перитонит и т.д.) [1].
Уремические токсины представляют собой гетерогенную группу веществ, различающихся по своему происхождению и молекулярной массе, связи с белками-переносчиками оказывают патологический эффект на организм человека: их насчитывается более 200 и список продолжает пополняться. В настоящее время многочисленные исследования указывают на непосредственное участие кишечной микробиоты в метаболизме уремических токсинов (например, индоксилсульфат, п-крезол, амины, аммиак, триметиламиноксид (ТМАО) и многие другие) [2–4].
Среди факторов, способствующих образованию и повышению проникновения токсических метаболитов, выделяют непропорциональное соотношение потребляемых белков и углеводов, в частности клетчатки, изменение pH кишечника, увеличение времени пассажа по толстой кишке, увеличение проницаемости кишечной стенки.
Продолжаются исследования потенциальных методов воздействия на кишечную микробиоту с целью снижения уровня бактериальных уремических токсинов. Среди перспективных методов можно выделить: вмешательства, модулирующие рост кишечных бактерий (например, пробиотики, пребиотики, диетическая модификация); адсорбенты, связывающие бактериальные уремические токсины в просвете кишечника; трансплантация фекальной микробиоты [2].
Эффективность и клиническая польза этих стратегий в настоящее время являются активной областью интереса нефрологов.
Цель исследования – изучить особенности микробиоты кишечника у больных группы перитонеального диализа и оценить влияние пробиотических препаратов на основные биохимические показатели и метаболомный профиль в исследуемой группе.
Материал и методы
В исследование были включены 60 пациентов с ХБП стадии 5Д (ХБП 5Д), находившихся на лечении ПАПД в нефрологическом центре Московского многопрофильного научно-клинического центра им. С.П. Боткина. Основным заболеванием у 42 из них был хронический гломерулонефрит, у 10 – хронический тубулоинтерстициальный нефрит, у шести – диабетическая болезнь почек и у двух – поликистозная болезнь почек взрослых. Из исследования были исключены пациенты, перенесшие лечение антибиотиками, пробиотиками/пребиотиками и слабительными в течение последних 12 недель, предшествовавших сбору образцов, а также пациенты с острым перитонитом и те, кто перенес его менее чем за три месяца до начала исследования. Целью исследования было изучение особенностей микробиоты кишечника пациентов, находящихся на перитонеальном диализе, и влияния лечения пробиотическим препаратом Нормофлорин-Д в течение одного месяца на метаболический профиль крови пациентов с ХБП. Участники были разделены на две группы: группа контроля (n = 20) и исследуемая группа, в который каждый пациент получал Нормофлорин-Д в течение одного месяца (n = 38).
Все пациенты получали препараты железа, вводимые парентерально, антигипертензивные и фосфатсвязывающие препараты. 42 пациента получали препараты соединений кальция и витамин D. В подгруппах пациентов значительных различий по полу, возрасту, индексу массы тела (ИМТ) не было (табл. 1).
Образцы венозной крови собирали утром натощак и центрифугировали со скоростью 3000 об/мин при 4 °C в течение 10 минут. Полученные супернатанты немедленно замораживали при температуре -80 °C. Метаболомное профилирование сыворотки крови проводили с использованием спектроскопии ядерного магнитного резонанса методикой (ЯМР) всем пациентам в двух точках, до и после приема пробиотика. Для ЯМР-анализа использовали 600 мкл сыворотки крови. Экстракцию полярных метаболитов проводили в соответствии с рекомендациями [5]. Для этого к образцу добавляли 600 мкл охлажденного (-20 °С) метанола и 600 мкл охлажденного (-20 °С) хлороформа. После интенсивного перемешивания в течение 30 минут при 5 °C образцы выдерживали 30 минут при -20 °C, затем центрифугировали в течение 30 минут (14000 g, 5 °C). Верхний водно-метанольный слой, содержащий полярные метаболиты, переносили в новую пробирку и высушивали с помощью вакуумного концентратора (SpeedVac Eppendorf Concentrator Plus) при комнатной температуре в течение 14 часов до полного испарения растворителей. До проведения измерений образцы хранили при температуре -60 °C. Высушенные экстракты растворяли в 600 мкл буфера для ЯМР. Для приготовления буферного раствора (20 мМ фосфат натрия при pH 7,0; 100 мкМ DSS-d6; 2 мМ азида натрия) смешивали сухие навески, растворяли в минимальном объеме D2O, лиофилизировали, а затем повторно растворяли в D2O (99,9%, Solvex).
Образцы переносили в стандартные пробирки (5 мл) для измерения ЯМР-спектров. Измерения проводили на ЯМР-спектрометре Bruker Avance 700 МГц (Bruker BioSpin, Ettlingen, Германия), оснащенном криодатчиком HCN Prodigy с градиентом по оси Z диаметром 5 мм, с использованием термостатируемого автосемплера (температура хранения 5 °C). Измерения спектров проводили при 25 °C. Одномерные спектры ЯМР 1Н были получены для каждого образца с использованием импульсной последовательности noesypr1d (1D NOESY-presat) со следующими параметрами: 131 072 точки данных, четыре пустых сканирования, 400 сканирований, ширина спектра – 19,8364 миллионных долей, время накопления – 4,7 секунды, релаксационная задержка между сканированиями – 3,0 секунды. Идентификацию метаболитов проводили с использованием программы Chenomx NMR Suite, а также с помощью базы данных Human Metabolome Database [6]. Концентрации метаболитов определяли по отношению к площади пика DSS с помощью функции интегрирования в программе Mestrenova.
У всех пациентов, включенных в исследование, были отобраны образцы стула в утреннее время в стерильной посуде. Образцы биоматериала по 500–700 мкг впоследствии заморожены при температуре -80 °С в пробирках «эппендорф» со стабилизирующим раствором этилендиаминтетрауксусной кислоты. Выделение ДНК проводили с использованием механической гомогенизации клеток при помощи керамических микрочастиц с использованием набора HiPure Stool DNA Kit (Magen Biotechnology, Китай), в соответствии с инструкциями производителя. Количественное определение выделенной ДНК проводили с помощью флуорометра Qubit 4.0 (Thermo Fisher Scientific, США). Библиотеки ампликонов для гипервариабельной области V4 гена 16S рРНК были подготовлены с использованием двухэтапной стратегии полимеразной цепной реакции (ПЦР). Каждый образец выделенной ДНК из окружающей среды и два отрицательных контроля ПЦР проводили в двух ПЦР-репликах по описанной методике [7].
Амплификацию проводили на термоциклере Veriti (Applied Biosystems, США). Условия амплификации: начальная денатурация –120 секунд при 95 °С, затем 25 циклов; денатурация 95 °С – 20 секунд, отжиг праймера 59 °С – 20 секунд, элонгация 72 °С – 30 секунд; 72 °С – 5 минут, затем 4 °C до восстановления образца [7]. Полученные библиотеки объединяли эквимолярно. Конечный пул очищали с помощью набора QIAquick PCR Extraction Kit (Qiagen, Германия) в соответствии с протоколами производителя. Количественное определение полученных после очистки библиотек образцов проводили с помощью флуорометра Qubit 4.0 (Thermo Fisher Scientific, США). Концентрация итогового пула составляла 22,8 нг/мкл.
Секвенирование выполняли на системе MiSeq (Illumina, США) при помощи реагентов, которые позволяют прочитать 150 нуклеотидов с каждого конца фрагмента. Минимальная глубина секвенирования каждого образца составила 10 000 прочтений. Отрицательные контроли (образец, содержащий лабораторную воду, а также отрицательный контроль ПЦР) также были секвенированы для исключения ложноположительных результатов.
После секвенирования полученные данные подвергли тщательной предобработке: с использованием программы Cutadapt были обрезаны праймеры, соответствующие 16S рРНК [8], определены парные риды для одинакового соотношения forward и revers прочтений с помощью программы fastq_pair [9] и проведено демультиплексирование – сортировка ридов по файлам, соответствующим образцам, с помощью программы deML [10].
Для дальнейшего анализа 16S рРНК секвенирования использовали язык программирования R. С помощью библиотеки The Divisive Amplicon Denoising Algorithm 2 [11] были определены последовательности, относящиеся к одному организму, и их таксономическое положение на основе выравнивания к последней версии базы данных Silva99 [12]. В библиотеке Phyloseq [13] была создана база данных организмов, присутствующих в пробе, c указанием их количества и характеристиками каждого из образцов. Анализ был проведен с помощью библиотек Pheatmap, Vegan, Microeco и др. [14–16].
Для измерения креатинина мы использовали кинетический колориметрический метод; для измерения биохимических показателей крови использовали стандартные клинические ферментативные методы.
Все пациенты с ХБП 5Д более трех месяцев находились на ПАПД, и все пациенты подписали информированное согласие. Образцы собирали в период с 1 июня 2023 г. по 31 марта 2024 г.
С помощью статистического программного обеспечения spss22.0 был проанализирован стандартный биохимический профиль всех пациентов. Данные измерений с нормальным распределением были выражены как среднее значение ± стандартное отклонение, а данные измерений с ненормальным распределением были описаны медианой (M) и квартилью (P25, P75); для сравнения использовали непараметрический тест. Парный t-тест (нормальное распределение) или знаковый ранговый тест Вилкоксона (ненормальное распределение) использовали для сравнения биохимических показателей до и после лечения Нормофлорином-Д; p < 0,05 считали статистически значимым.
Результаты
На рис. 1 показаны микроорганизмы на уровне филума, класса, ордера и семейства у пациентов, получающих ПАПД. Наглядно показано, что в среднем преобладающим филумом в образцах был Bacillota (синоним – Firmicutes), а вторым по величине филумом был Bacterioidota. Также наблюдалось присутствие Actinomycetota и Proteobacteria в значительных количествах. Значимыми на уровне класса были Bacterioidia филума Bacterioidota и Clostridia и Bacilli филума Bacillota. К филуму Actinomycetota относились классы Coriobacteriia и Actinobacteria. Протеобактерии были представлены в основном гамма-протеобактериями.
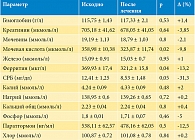
Получена разнонаправленная лабораторная динамика с положительными изменениями некоторых биохимических показателей. Некоторые лабораторные параметры представлены в табл. 2.
Как видно из табл. 2, уровни острофазовых плазменных биомаркеров, таких как С-реактивный белок (СРБ) и ферритин, снизились на 31,3% (p ≤ 0,05) и 13,2% (р ≤ 0,05) соответственно. Достоверно на 9,8% (р < 0,05) снизился уровень мочевой кислоты. Отмечалась положительная тенденция к снижению паратгормона и фосфора, но показатели не достигли статистически значимых значений.
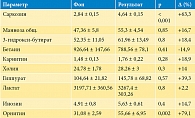
У пациентов основной и контрольных групп было проведено исследование метаболомного профиля сыворотки крови. Исследуемыми веществами были аминокислоты, некоторые из уремических токсинов, глицерофосфолипиды и метаболиты цикла трикарбоновых кислот. Наиболее значимые изменения в концентрациях некоторых из них до и после лечения представлены в табл. 3.
По данным, представленным в табл. 3, достоверно повысились уровни метаболитов, таких как саркозин и орнитин, на 63,3% (p < 0,001) и 79,1 % (р = 0,002) соответственно. Отмечается тенденция к увеличению гиппурата на 39,3% (р = 0,57) и инозина на 14,7% (р = 0,4).
Всего в образцах сыворотки пациентов с ХБП было исследовано 58 метаболитов. Статистически значимые изменения после лечения Нормофлорином-Д были выявлены в метаболитах саркозин, фумарат, гипоксантин, метионин, изобутират, орнитин, ацетилхолин и пируват (рис. 2).
Полученные данные свидетельствуют о том, что терапия Нормофлорином-Д вызывает специфические метаболические изменения у пациентов с ХБП, в основном затрагивая метаболизм аминокислот и, в меньшей степени, метаболизм глицерофосфолипидов и цикл трикарбоновых кислот. У пациентов был отмечен положительный клинический эффект в виде улучшения настроения, уменьшения слабости, нормализации перистальтики кишечника. Побочных и нежелательных эффектов во время приема препарата не было отмечено ни у одного пациента.
Обсуждение
Представленные данные отражают результаты работы по оценке влияния пробиотиков на микробиом путем изучения микробиоты кишечника и динамики метаболома крови и биохимических показателей.
Выявленная динамика метаболитов, произошедшая на фоне лечения пробиотическим препаратом, интересна и требует дальнейшего изучения. Изменение концентраций некоторых метаболитов, таких как орнитин, оказывает гипоаммониемическое действие, утилизирует аммонийные группы в синтезе мочевины (орнитиновый цикл), что, в свою очередь, снижает концентрацию аммиака в плазме крови и способствует нормализации кислотно-щелочного состава организма, улучшает белковый обмен при ХБП. Повышение уровня саркозина в крови может служить биомаркером продолжительности жизни у млекопитающих, отражающим возрастные изменения метаболизма [17]. Обнаружено положительное влияние Нормофлорина-Д на данные биохимических параметров крови, выявлена тенденция к снижению креатинина, мочевины и мочевой кислоты, также отмечено достоверное снижение маркеров воспаления (СРБ, ферритин).
Заключение
На фоне лечения пробиотиком «Нормофлорин-Д» наблюдалось снижение уровней маркеров эндогенной интоксикации, что может косвенно указывать на благоприятное изменение состава микробиоты кишечника. Эти результаты дают надежду на то, что в перспективе появится возможность модулирования микробиоты, что, в свою очередь, позволит замедлить прогрессирование заболевания и улучшить исходы у больных с ХБП.
Исследование проведено в рамках гранта правительства Москвы № 1803-7/23.
E.V. Shutov, MD, Prof., S.A. Bolshakov, I.A. Fedoseev, S.M. Sorokoletov, MD, Prof., A.S. Krylova, S.V. Toshchakov, PhD, S.V. Maryasina, PhD, U.V. Bulgakovа
S.P. Botkin City Clinical Hospital
Russian Medical Academy of Continuous Professional Education, Moscow
National Research Center ‘Kurchatov Institute’, Moscow
M.V. Lomonosov Moscow State University
Contact person: Evgeny V. Shutov, shutov_e_v@mail.ru
Gut dysbiosis is always present in chronic kidney disease. A number of factors, including uremic toxins, decreased synthesis of short-chain fatty acids (SCFAs), diet, medications, impaired intestinal motility, pH of the intestinal contents and increased wall permeability, are directly related to changes in the composition and function of the microbiota. Altered gut microbiota plays a crucial role in the synthesis and accumulation of protein-bound uremic toxins, leading to increased levels of oxidative stress, inflammation. Relationships between dysbacteriosis and progression of CKD, impaired bone mineral metabolism, anemia, cardiovascular and several other complications have already been proven. Understanding and influencing the mechanisms that lead to dysbiosis is an urgent area of research for scientists around the world today. The potential for linking the gut microbiota to chronic kidney disease opens the door to extensive research in this area, which could result in the development and incorporation of new probiotic drugs in the treatment and prevention of CKD.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.