Питание больных, получающих лечение диализом
- Аннотация
- Статья
- Ссылки
- English
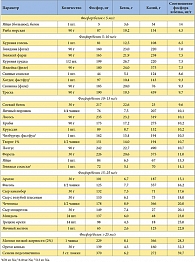
Соблюдение диеты больными на диализе преследует несколько значимых целей. Среди них следует отметить поддержание хорошего статуса питания пациента, профилактику и замедление развития сердечно-сосудистых, цереброваскулярных и периферических сосудистых заболеваний, предотвращение развития минерально-костных нарушений, а также профилактику и коррекцию метаболических расстройств, возникающих вследствие уремической интоксикации и неадекватного диализа. Таким образом, все пациенты, получающие лечение диализом, должны придерживаться определенного рациона, поскольку не только здоровье, но и их жизнь зависит от соблюдения принципов питания. Основные рекомендации по диетическому питанию приведены в таблице 1.
Белково-энергетическая недостаточность
Одна из важнейших проблем, которая возникает у больных на диализе при неправильном питании, – это белково-энергетическая недостаточность [1]. У больных, получающих гемодиализ, нарушения нутриционного статуса встречаются в 10–70% случаев. Так, в России перед диализом у 43,4% больных концентрация альбумина в сыворотке составляет < 35 г/л, что свидетельствует о недостаточности питания [2].
Причины возникновения белково-энергетической недостаточности у больных, получающих лечение диализом, приведены в таблице 2. Снижение индекса массы тела, уровней холестерина, альбумина, преальбумина, других показателей белково-энергетической недостаточности ассоциируется с повышенным риском заболеваемости и смерти [3–5]. Увеличение риска летального исхода при белково-энергетической недостаточности может быть обусловлено разными факторами (табл. 3) [6].
Диагностика белково-энергетической недостаточности включает анализ анамнеза (изменения массы тела больного), физикальный осмотр, антропометрию, определение состава тела (чаще всего для этого применяется биоимпедансная спектроскопия), лабораторных и функциональных показателей (табл. 4). Изучению количества белка, которое должны получать в сутки больные на диализе, было посвящено всего несколько рандомизированных исследований с очень небольшим количеством участников [7, 8]. С одной стороны, было установлено, что при потреблении белка 1,1–1,2 г/кг/сут у больных поддерживается нейтральный или позитивный азотистый баланс и повышается уровень альбумина. С другой стороны, было отмечено, что потребление белка 1,2 г/кг/сут не индуцирует уремическую интоксикацию [9].
Потребность в калориях
В исследовании L. Slomowitz и соавт. [10] было убедительно показано, что нейтральный энергетический баланс у больных достигается при потреблении 35 ккал/кг/сут. У пожилых людей (возраст старше 60 лет) допускается меньшее потребление калорий (30–35 ккал/кг/сут).
Потребность в жирах
Дислипидемия встречается у больных на диализе чаще, чем в общей популяции [11]. Кроме того, для больных на гемодиализе характерны гипертриглицеридемия, низкий уровень холестерина липопротеинов высокой плотности. Уровень холестерина липопротеинов очень низкой плотности у таких больных, как правило, повышен, в то время как холестерин липопротеинов низкой плотности и общий холестерин обычно находятся в норме. У больных, получающих лечение перитонеальным диализом, дислипидемия выражена значительнее, чем у больных на гемодиализе. Одной из причин данных изменений является гиперинсулинемия, развивающаяся в ответ на всасывание глюкозы, что приводит к повышенному синтезу и секреции липопротеинов очень низкой плотности. Интенсивная потеря белка стимулирует синтез альбумина, липопротеинов. В этой связи необходимость назначения пациентам с дислипидемией на перитонеальном диализе статинов очевидна. Использование растворов с икодекстрином ассоциируется с 5%-ным уменьшением концентрации общего холестерина. У больных, получающих гемодиализ, могут быть использованы те же принципы лечения дислипидемии, что и в общей популяции.
Потребность в жидкости и натрии
Больные на диализе, особенно при отсутствии остаточной функции почек, должны избегать потребления большого количества хлорида натрия. Избыточное потребление соли может привести к повышению массы тела в междиализный промежуток времени (у больных на гемодиализе), артериальной гипертонии, отекам, гипертрофии миокарда, сердечной недостаточности.
Больным на гемодиализе рекомендуется ограничить прием хлорида натрия в пределах 2,5–3,8 г/сут (1–1,5 г натрия). Следует обратить внимание на то, что наибольшее количество соли содержится в полуфабрикатах, готовых продуктах, а также консервах и соленьях.
У пациентов, потребляющих много жидкости, развивается гипергидратация, появляются отеки, развивается гипонатриемия. Необходимо помнить, что вода поступает в организм не только из напитков (которые, как правило, учитываются), но и из твердых продуктов (за сутки в среднем 800–1000 мл жидкости). Вода также образуется в результате метаболизма в объеме 200–300 мл/сут. Удаление большого количества жидкости на гемодиализе может привести к тяжелой артериальной гипотонии, стенокардии, аритмиям, судорогам. В терминальной стадии хронической болезни почек рекомендуется расчет приема жидкости, включая твердые продукты, производить по следующей формуле: 600 мл + объем суточного диуреза + экстраренальные потери жидкости.
Потребность в калии
В норме почки экскретируют от 80 до 90% потребляемого калия (около 2–6 г/сут). Значительно меньшая часть выводится с фекалиями (около 0,3–0,4 г). Падение функции почек может привести к развитию гиперкалиемии. Защитным механизмом предотвращения гиперкалиемии мог бы служить переход калия из внеклеточного пространства в клеточное. Однако этот механизм часто ингибируется метаболическим ацидозом, инсулинорезистентностью, гиперкатаболизмом, использованием в лечении больных с хронической почечной недостаточностью ингибиторов ангиотензинпревращающего фермента и ренина.
Повышенный уровень калия (> 5,3 ммоль/л) ассоциируется с высоким риском летального исхода у больных на гемодиализе [12]. Тяжелая гиперкалиемия (> 7,0 ммоль/л) может привести к остановке сердца.
Пациентам на диализе рекомендуется потребление не более 3 г калия в сутки. В этой связи больным необходимо знать о содержании калия в продуктах. Больше всего калия содержится в орехах (арахис, фисташки, грецкие орехи, фундук), фруктах и сухофруктах (абрикосы, инжир, изюм, финики, бананы), бобовых, грибах, овощах (петрушка, шпинат, укроп), хлебе из муки грубого помола, рисе, чипсах, овощных бульонах, фруктовых соках, шоколаде, какао, кетчупе, растворимом кофе, сухом молоке. За день рекомендуется съедать не более 1 фрукта и 1 овоща (в сыром или обработанном виде). Сырые овощи и фрукты должны обязательно очищаться от кожуры. Калий растворяется в воде, поэтому до тепловой обработки овощи также должны быть очищены, промыты большим количеством воды и оставлены в воде на 2–3 часа, после приготовления овощей воду необходимо слить.
Гемодиализ должен проводиться с использованием диализата с концентрацией калия от 3 до 4 ммоль/л, избегая низкокалиевого диализата, поскольку постдиализная гипокалиемия может привести к повышению риска летального исхода [13].
Потребность в магнии
Магний, так же как и калий, в основном экскретируется почками. Однако гипермагниемия встречается реже, чем гиперкалиемия, поскольку большинство продуктов питания содержит небольшое количество магния, а всасывание в кишечнике составляет не более 50% от количества потребленного магния. Нетяжелая гипермагниемия часто встречается у больных, получающих гемодиализ. В то же время применение препаратов с магнием (антациды, сульфат магния и т.п.) может стать причиной тяжелой гипермагниемии, которая может приводить к угнетению дыхания, развитию неврологических нарушений и даже к остановке сердечной деятельности. Потребление магния у больных на гемодиализе должно быть в пределах 200–300 мг/сут.
Потребность в кальции
Потребление кальция не должно превышать 900–1200 мг/сут, однако больные на гемодиализе получают не менее 1,5 г/сут кальция. Избыточное потребление кальция в основном обусловлено приемом кальцийсодержащих средств, связывающих фосфаты (кальция карбоната, ацетата кальция и кальция глюконата) [14]. Чрезмерное получение кальция обусловливает положительный кальциевый баланс, ведет к гиперкальциемии и кальцификации сосудов и тканей. В то же время использование средства, связывающего фосфаты, не содержащего кальций, – севеламера – сопровождалось значительно меньшей скоростью прогрессирования кальцификации сосудов [15].
Таким образом, если нет необходимости контролировать фосфор при помощи кальцийсодержащих средств, связывающих фосфаты, больным на гемодиализе рекомендуется потреблять до 1200 мг/сут кальция, при использовании кальцийсодержащих средств, связывающих фосфаты, потребление кальция следует снизить до 900–1000 мг/сут.
Надо также учитывать то, что при повышении уровня кальция в крови выше 10,5 мг/дл и снижении ниже 8,0 мг/дл смертность пациентов на гемодиализе возрастает [16].
Потребность в фосфоре
При обычном рационе питания человек потребляет 1500–1700 мг/сут фосфора (при этом всасывается около 60%). В среднем за процедуру гемодиализа удаляется около 250 мг фосфора. Таким образом, только гемодиализ не может обеспечить достаточное выведение фосфора из организма и предотвратить гиперфосфатемию.
В последнее время было убедительно показано, что фосфор является независимым фактором риска развития сердечно-сосудистых заболеваний даже у больных без заболеваний почек. По результатам Фрамингемского исследования, уровень фосфора > 3,5 мг/дл увеличивал риск развития сердечно-сосудистых заболеваний на 55%. Повышение уровня фосфора на 1 мг/дл у больных хронической болезнью почек 3–4-й стадии повышает риск развития инфаркта миокарда на 35% и более. Кроме того, повышенный уровень фосфора играет важную роль в развитии кальциноза сосудов, сердца и повреждения почек. Гиперфосфатемия и гиперпаратиреоз часто наблюдаются у больных с хронической почечной недостаточностью и ассоциируются с ренальной остеодистрофией, кальцификацией сосудов, сердечно-сосудистыми болезнями и внезапной смертью. Таким образом, потребление фосфора должно быть ограничено при любой стадии хронической болезни почек.
Однако не только гиперфосфатемия [18], но и гипофосфатемия [19] может ассоциироваться с неблагоприятными исходами у больных на гемодиализе. Попытка контроля уровня фосфора путем уменьшения потребления белка может приводить к нежелательным последствиям. Так, в 6-месячном наблюдении за пациентами на гемодиализе отмечена более высокая выживаемость пациентов со снижением в течение 6 месяцев уровня фосфора при условии одновременного повышения показателя потребления белка по сравнению с пациентами, у которых произошло повышение обоих показателей. Однако пациенты, у которых отмечено снижение потребления белка, имели повышенный риск смерти вне зависимости от динамики уровня фосфора в крови – как при его увеличении, так и при снижении в течение 6 месяцев наблюдения [20].
Известны три источника поступления фосфора с пищей:
1) органический фосфор, поступающий с растительной пищей;
2) органический фосфор, поступающий в организм с белковыми продуктами животного происхождения;
3) неорганический фосфор, находящийся в пищевых добавках, используемых для приготовления пищи.
Только 20–40% фосфора растительного происхождения усваивается в организме человека из-за недостатка фермента фитазы, в то время как фосфор из животного белка легче гидролизуется и усваивается на 40–60%. На 100% усваивается неорганический фосфор. Чрезмерное потребление пищи с наиболее биодоступным фосфором может приводить к гиперфосфатемии. Надо также учитывать, что содержание фосфора в мясе животных или рыбе, выращенных на ферме, значительно выше, чем у диких особей. Кроме того, именно в доступных по цене продуктах, фастфуде содержится больше всего фосфатов. Так, наиболее высокий уровень фосфора в крови наблюдался у малообеспеченного населения в США.
На сегодняшний день нет полной информации о содержании фосфора в продуктах, но можно ориентироваться на расчетные данные по содержанию фосфора. Однако надо помнить: ранее применявшиеся методы оценки занижали количество фосфора в продуктах на 15–25%. Реальное содержание фосфора в продуктах часто неизвестно по причине того, что не учитывается содержание фосфора в пищевых добавках. В таблице 5 указаны пищевые добавки, содержащие неорганический фосфор. Фосфатные соли используются в приготовлении бекона, колбас, сосисок, для окраски, как ароматизатор, для уменьшения окисления и стабилизации белка. Разные типы сыров содержат фосфор в разных количествах, так, в мягких видах сыра количество фосфора может достигать 1000 мг на 100 г, а в твердых – всего 100 мг на 100 г.
Учитывая, что основным источником фосфора является белок, представляется целесообразным в питании использовать продукты с минимальным содержанием фосфора по отношению к белку (табл. 6) [17].
При невозможности добиться у пациента нормального уровня фосфора могут быть использованы препараты, связывающие фосфаты. Алюминийсодержащие препараты, связывающие фосфаты, применяются редко ввиду возможного развития серьезных побочных эффектов (деменция, рефрактерная к лечению анемия, адинамическая болезнь кости).
Наиболее часто применяемые средства, связывающие фосфаты, в нефрологической практике делят на 2 группы: кальцийсодержащие (карбонат кальция и ацетат кальция) и кальцийнесодержащие (севеламера гидрохлорид и севеламера карбонат). В карбонате кальция содержится 40% элементарного кальция, в ацетате – 25%. Простой подсчет содержания кальция в этих средствах, связывающих фосфаты, показывает, что для предотвращения гиперкальциемии больной может принимать не более 3–4 г карбоната кальция в сутки и до 10 таблеток ацетата кальция (желательно этот прием осуществлять вместе с продуктами с высоким содержанием фосфора, в обед или ужин). Ацетат кальция, возможно, более эффективный препарат, связывающий фосфаты, однако ему сопутствуют более выраженные побочные эффекты, а гиперкальциемия встречается одинаково часто при приеме обоих препаратов [21].
Применение кальцийсодержащих средств, связывающих фосфаты, не только приводит к повышению частоты кальцификации сосудов, но может также способствовать развитию адинамической болезни кости [22]. Использование севеламера гидрохлорида и других не содержащих кальций соединений дает меньше побочных эффектов (реже возникают гиперкальциемия и кальцификация сосудов) [23]. Метаанализ 11 рандомизированных исследований (n = 4622) показал, что не содержащие кальций средства, связывающие фосфаты, снижают общую смертность на 22% по сравнению с кальцийсодержащими препаратами [24]. В исследовании RISCAVID (Cardiovascular risk in dialysis: RISCAVID study), в котором приняло участие 757 человек, было показано, что применение севеламера гидрохлорида привело к снижению сердечно-сосудистой смертности [25].
Заключение
К сожалению, только диализ не может обеспечить хороших результатов лечения больных на терминальной стадии почечной недостаточности. Необходим комплексный подход, включающий в себя изменение образа жизни (отказ от курения, алкоголя, физические упражнения), соблюдение диеты, адекватность проведения диализных процедур, коррекцию осложнений уремии при помощи медикаментов. Использование всех возможных лечебных мероприятий позволит повысить выживаемость пациентов.
Nutrition in dialysis patients
Ye.V. Shutov
Russian Medical Academy of Postgraduate Education, Nephrology and Hemodialysis Department
Contact person: Yevgeny Viktorovich Shutov, shutov_e_v@mail.ru
The article addresses basic principles of nutrition in patients with end-stage renal disease recieving hemodialysis or peritoneal dialysis. The author emphasizes that diet adherence is essential for life and well-being of dialysis patients. Recommendations on intake of energy, fats, proteins, carbohydrates, fluids, electrolytes and microelements are presented.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.